热毒宁注射液雾化吸入给药的安全性研究
2024-05-14张腾之唐黎明侯红平谷舒怡高云航陈韡亚陈腾飞张广平
张腾之,宋 玲#,唐黎明,侯红平,谷舒怡,高云航,航 艾,李 晗,彭 博,陈韡亚,陈腾飞,张广平
热毒宁注射液雾化吸入给药的安全性研究
张腾之1,宋 玲1#,唐黎明2,侯红平1,谷舒怡2,高云航1,航 艾2,李 晗1,彭 博1,陈韡亚1,陈腾飞1*,张广平1*
1. 中国中医科学院中药研究所,北京 100700 2. 上海市食品药品检验研究院药理毒理所,上海 201112
针对热毒宁注射液雾化吸入给药后可能的安全性风险开展研究,为热毒宁注射液雾化吸入临床应用提供基础和依据,探讨中药雾化吸入制剂临床前安全性评价的技术方法。在GLP条件下开展热毒宁注射液大鼠雾化吸入单次给药和重复给药30 d毒性实验,大鼠黏膜刺激(伴随反复给药观察)和豚鼠全身主动过敏实验。在连续给药7 d后,分别在停药1、7、14 d时对热毒宁注射液在肺中检测到的31种成分进行分析。大鼠单次口鼻暴露120 min/次、2次/d,动物未见明显异常;热毒宁低、中、高剂量(30、60、120 min/d)组大鼠口鼻吸入重复给药30 d、恢复期14 d毒性实验对血液学、血液生化、肺系数、尿液、组织病理学未见药物相关的病理改变,对呼吸道黏膜未见刺激性。豚鼠全身主动过敏实验为阴性。所分析到的热毒宁注射液的31种成分在停药14 d后所有成分均检测不到或者在检测限下。热毒宁注射液雾化吸入给药对呼吸道黏膜无刺激和过敏,大鼠口鼻暴露1个月未见明显毒性反应,所测定的31种成分均能够在肺部代谢,无明显沉积。
热毒宁注射液;雾化吸入;安全性;肺沉积;栀子苷;新绿原酸;绿原酸;隐绿原酸
相对于传统的口服和注射给药,雾化吸入给药治疗呼吸道疾病具有明显的优势。雾化吸入给药为肺部靶向给药,可提高呼吸道的药物浓度,同时可以避免首过效应和胃肠道降解,因而能够提高药物的疗效。雾化吸入给药剂量远低于注射和口服给药,药物进入全身血液循环的浓度大幅度降低,因而极大地减少了药物全身暴露可能的安全性风险。尽管目前中药仍然没有雾化吸入制剂上市,但是其作为一种疗法在临床广泛应用。近年来将中药注射剂雾化吸入应用于临床治疗呼吸系统疾病有大量报道[1]。热毒宁注射液是由青蒿、金银花、栀子3味中药经过水蒸气蒸馏技术、连续逆流萃取技术和超滤膜分离技术提纯精制而成的中药注射剂。临床用于治疗外感风热所致感冒、咳嗽,症见高热、微恶风寒、头痛身痛、咳嗽、痰黄等。临床报道显示热毒宁注射液采用雾化吸入方式给药,在治疗急性上呼吸道感染[2-3]、急性支气管炎[4]、慢性支气管炎[5]、毛细支气管炎[6-10]等呼吸道疾病上取得了良好的疗效。然而将注射液雾化吸入给药属于用药途径改变,其临床前的安全性研究仍然是空白,注射制剂用于雾化吸入方式给药带来的呼吸道高暴露、药物成分肺沉积及对黏膜刺激等安全性问题尚需论证。本研究首先基于《中国药典》2020年版四部0111吸入制剂项下供雾化器用液体制剂的规定,对热毒宁注射液作为雾化吸入制剂的可行性进行评估,在此基础上通过热毒宁注射液大鼠雾化吸入急性毒性、重复给药30 d毒性、大鼠黏膜刺激和豚鼠全身主动过敏实验,对热毒宁注射液在肺中成分进行检测,对热毒宁注射液雾化吸入给药的临床前安全性进行研究,为临床应用提供依据和基础。
1 材料与方法
1.1 动物
SPF级Wistar大鼠,体质量180~200 g,6~8周龄,雌雄各半,购自上海斯莱克实验动物有限责任公司,动物生产许可证号SCXK(沪)2017-0005。SPF级SD大鼠,体质量180~200 g,6~8周龄,雌雄各半,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0006。SPF级Hartley豚鼠,体质量298.0~371.3 g,5~6周龄,购自北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0011。动物合格证号为2015000548281、11400700359727、1100111911043753、1100111911043753、11400700359729、11400700262038。本实验中涉及操作均符合本单位伦理委员会要求和标准。动物伦理编号为IACUC-SIFDC17119、IACUC-SIFDC18103、IACUC-SIFDC17100。单次多次给药毒性实验、过敏反应均在上海市食品药品检验所药物安全评价中心开展;肺组织沉积实验在北京市医疗器械检验所实验动物饲养房开展,均为屏障环境。
1.2 药品与试剂
热毒宁注射液(批号180709)购自江苏康缘药业股份有限公司;氯化钠注射液(批号16102102)购自华裕(无锡)制药有限公司;栀子苷对照品(批号110749-201718,质量分数为97.6%)购自中国食品药品检定研究院;对照品新绿原酸(批号MUST-18031001,质量分数为99.67%)、绿原酸(批号MUST-18030620,质量分数为99.39%)、隐绿原酸(批号MUST-18032403,质量分数为99.07%)购自成都曼思特生物科技有限公司;肝素钠(批号B02M8S30252)购自上海源叶生物科技有限公司;戊巴比妥钠、甲醇(色谱纯)购自德国Merck公司;甲酸(色谱纯)购自美国ROE公司;0.9%氯化钠注射液(批号1901293203)购自石家庄四药有限公司。
1.3 仪器
Pari LC PLUS雾化发生器、Turbo Boy N型蓝芯雾化器(德国Pari公司);IES-N型口鼻式吸入暴露系统(上海瑞曼信息科技有限公司);PCXR8型采样泵(美国SKC公司);LLC型Intox7级联撞击器(美国In-Tox Products公司);4146型流量校准计(美国TSI公司);ADVIA 2120i型血液分析仪(西门子公司);CA1500型全自动血凝仪(日本Sysmex公司);URIT-1600型全自动尿液分析仪(优利特);7100型全自动生化分析仪(日本HITACHI公司);ASP6025型旋转式组织处理机、Histocore组织包埋处理中心、ST5020型自动组织切片染色机(德国Leica公司);MICROM HM 315型旋转切片机(美国Thermo公司);液相色谱-质谱联用分析系统由ExionLC AC超高效液相仪及QTRAP 5500质谱仪组成,系统工作软件为Analyst 1.62(美国Sciex公司);601-2202-002 Rev04型、601-2202-002 Rev05型动物口鼻暴露系统(美国DSI公司);RVC 2-18 CD plus真空离心浓缩系统(德国CHRIST公司);T18 digital ultra turrax高速分散匀浆机(德国IKA公司);5424R型台式离心机(德国Eppendorf公司);Vortex-genie2型可调速涡旋混合器(美国Industrial Scientific公司);BCD-189WDPV型−20 ℃低温冰箱(海尔集团公司)。
2 方法
2.1 雾化质量控制
2个Y型并联的Pari LC PLUS雾化发生器,发生体积流量4 L/min;口鼻式吸入暴露系统:双层塔,每层12孔,每层装12只动物。热毒宁注射液符合相关治疗标准,雾化器为Pari Turbo Boy N蓝芯;呼吸模拟器型号为BRS2000。结果以绿原酸计,递送速率0.71 mg/min,递送总量1.92 mg。
按照吸入制剂微细粒子空气动力学特征测定法(《中国药典》2020年版四部0951)以装置3(NGI)项下供雾化器用的液体制剂检查法检查微细粒子剂量。以绿原酸和栀子苷计,空气动力学中值直径(mass median aerodynamic diameter,MMAD)约为4.6 μm,微细粒子分数(fine particle fraction,FPF)为46%。
2.2 热毒宁注射液大鼠口鼻吸入单次给药毒性实验
取体质量合格的Wistar大鼠40只,随机分为阴性对照组和热毒宁组,每组20只,雌雄各半。热毒宁组雾化吸入给药120 min,2次/d,间隔4 h,阴性对照组动物同法吸入空气。给药后观察14 d,观察给药后14 d内动物反应症状,对观察期结束后的存活动物进行大体解剖,观察脏器病变情况。
2.3 热毒宁注射液大鼠口鼻吸入重复给药30 d恢复期14 d毒性实验
取Wistar大鼠120只,雌雄各半,随机分为阴性对照组和热毒宁低、中、高剂量组,每组30只,每笼5只饲养。热毒宁低、中、高剂量组暴露时间分别为30、60、120 min。阴性对照组动物同法吸入空气,吸入时间与同周期内吸入时间最长的组相同,1次/d,连续30 d,停药恢复期为14 d。实验期间观察大鼠一般状况(发病、死亡、体质量、摄食摄水、毛发、皮肤、腺体分泌、粪便形状、呼吸及循环系统、自主效应、神经系统)及血液学指标,每日给药前观察大鼠鼻腔黏膜与口腔黏膜可视范围内有无红肿、流血、溃疡等现象,给药后即刻观察动物局部刺激症状(如哮喘、咳嗽、呕吐、窒息等症状),对解剖动物进行大体观察和组织病理学观察。
2.4 热毒宁注射液全身主动过敏试验
取体质量合格的豚鼠32只,按随机分组表均分为阴性对照组、阳性对照组和热毒宁高、低剂量组。热毒宁高剂量组取受试物原液作为致敏液与激发液,致敏给药时间60 min,激发时给药时间为120 min。热毒宁低剂量组取受试物原液作为致敏液与激发液,致敏给药时间为30 min,激发给药时间为60 min。阴性对照组采用氯化钠注射液原液,吸入时间与同周期内吸入时间最长的组相同。阳性对照组致敏时取卵白蛋白,以氯化钠注射液配制成3 mg/mL致敏液,与热毒宁组同法雾化致敏液20 min。激发时取卵白蛋白,以氯化钠注射液配制成6 mg/mL激发液,与热毒宁组同法雾化致敏液最长至40 min。
实验中致敏阶段受试物与对照品均采用口鼻雾化方式给药,每隔1 d给药1次,连续3次。激发阶段仍采用口鼻雾化方式给药,各组各取半数动物于末次致敏后第14、21天进行激发。每次致敏和激发当日称量记录每组每只动物的体质量。致敏期间,每日观察记录动物的一般症状。激发当日,动物口鼻雾化给予热毒宁高、低剂量组或阴性、阳性对照药物后即刻至30 min,详细观察每只动物的反应,记录症状的出现及消失时间。
2.5 热毒宁注射液大鼠肺组织沉积实验
2.5.1 分组、给药和取材 SD大鼠适应性饲养5 d,取体质量合格的大鼠54只,随机分为空白组、热毒宁低、高剂量(30、120 min/次)组,每组18只,雌雄各半,每日给药1次,连续给药7 d。首次给药前,大鼠禁食过夜,正常饮水,给药开始时禁食禁水,给药后2 h恢复饮水,4 h恢复饮食。各组大鼠分别在末次给药结束后1、7、14 d进行处理和取材,每组每个取材点各处理6只动物,雌雄各半。动物处理前禁食过夜,正常饮水。大鼠麻醉后,腹主动脉采尽血液,采集完整的肺组织。取肺组织用流动的生理盐水冲洗,滤纸吸干水分,称定质量,−20 ℃保存。将肺组织37 ℃水浴解冻,剪成小块,加入4倍体积的生理盐水,冰浴匀浆3 min,−20 ℃保存。
2.5.2 工作溶液配制 精密称取栀子苷、新绿原酸、绿原酸和隐绿原酸对照品适量,分别置10 mL量瓶中,加甲醇超声溶解后定容,摇匀后取该母液适量,分别用甲醇稀释成质量浓度均为1 mg/mL的对照品储备液。取一定量的各化合物储备液,混合后加甲醇配制成栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为1、10、2、5 μg/mL的混合对照品溶液(MIX0),用甲醇按一定比例将MIX0稀释成栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为1、10、2、5 ng/mL的混合检出限工作溶液;取一定量的各化合物储备液,混合后加甲醇配制成栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为2、20、5、10 μg/mL的混合标准溶液(MIX1),用甲醇按一定比例将MIX1稀释成栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为2、20、5、50 ng/mL的混合定量限工作溶液。于−80 ℃冰箱冷冻保存。
2.5.3 样品处理 精密吸取50 μL检出限及定量限混合样品溶液或大鼠肺组织匀浆样品,加甲醇150 μL,涡旋2 min,超声1 min,−4 ℃、12 000 r/min离心5 min,取150 μL上清,45 ℃真空离心浓缩至干燥。加入75 μL 5%甲醇水溶液复溶,涡旋2 min,−4 ℃、12 000 r/min离心5 min,取上清进样分析。
2.5.4 精密度 取“2.5.2”项下混合检出限和定量限工作溶液各10 μL,各加入大鼠空白肺组织匀浆90 μL,涡旋混匀,得栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为0.1、1.0、0.2、0.5 ng/mL的混合检出限质控溶液,以及栀子苷、新绿原酸、绿原酸和隐绿原酸质量浓度分别为0.2、2.0、0.5、5.0 ng/mL的混合定量限质控溶液,之后各取50 μL,按“2.5.3”项进行样品处理并分析,每个批次每个质控样品设置5个重复,测定3个批次。
2.5.5 色谱条件 色谱柱:Waters Symmetry C18色谱柱(150 mm×2.1 mm,5 μm),Waters VanGuard Cartridge for Symmetry C18,5 μm预柱;柱温40 ℃;流动相为0.05%甲酸水溶液(A)-甲醇(B),梯度洗脱:0~1.5 min,95% A;1.5~10 min,95%~5% A;10~12 min,5% A;12~15.5 min,5%~95% A;15.5~17 min,95% A。体积流量0.5 mL/min;进样量5 µL;样品盘温度6 ℃;分析时间17 min。
2.5.6 质谱条件 电喷雾离子源(ESI),负离子模式,喷雾电压−4 500 V,辅助气1(N2)50 Arb,辅助气2(N2)50 arb,辅助气加热温度550 ℃,气帘气35 arb。采用MRM扫描方式对31个化合物进行分析,质谱参数见表1。
2.6 统计学分析


表1 热毒宁注射液吸入溶液中31种检测成分质谱参数及保留时间

表1(续)
*为[M+HCOO]−。
*is [M+HCOO]−.
3 结果
3.1 单次给药毒性
Wistar大鼠雾化吸入热毒宁注射液,热毒宁组给药时间为120 min/次,2次/d,各组动物给药后即刻均未见明显异常,未见明显急性毒性反应及动物死亡。动物继续观察14 d,毛发、行动、精神状态、采食、饮水、二便及腔道分泌物均未见明显异常。给药后第7、14天称定质量,动物体质量均增长。两组同性别动物在相同实验周期中体质量无明显组间差异。大体观察与大体解剖均未见明显异常。
3.2 多次给药毒性
3.2.1 一般状况观察 给药期间和给药结束后观察14 d,热毒宁各剂量组与阴性对照组动物一般状况未见明显异常。
3.2.2 动物体质量和耗食量观察 如表2所示,实验期间动物各组动物的体质量呈增长趋势。与阴性对照组比较,热毒宁高剂量组雄性动物自第11天起平均体质量低于阴性对照组,同时在给药期间动物耗食量减少,推测可能与动物雾化给药过程中暴露时间长应激反应相关,停止给药后耗食量较给药期间增加,虽仍低于阴性对照组,但动物体质量增加与其他各剂量组无明显差异。
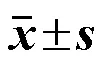
表2 各组大鼠体质量变化(, n = 15)
C-阴性对照;RH-热毒宁高剂量组;RM-热毒宁中剂量组;RL-热毒宁低剂量组;与阴性对照组比较:*<0.05**<0.01,下表同。
C-negative control; RH-Reduning high-dose group; RM-Reduning medium-dose group; RL-Reduning low-dose group;*< 0.05**< 0.01negative control group, same as below tables.
3.2.3 血液学观察 如表3、4所示,与阴性对照组比较,给药30 d雄鼠热毒宁中剂量组红细胞、血红蛋白、血细胞比容出现明显异常(<0.05);恢复期末雄鼠热毒宁高剂量组平均红细胞体积、嗜碱性粒细胞、网织红细胞,热毒宁中剂量组嗜碱性粒细胞以及热毒宁低剂量组白细胞、嗜碱性粒细胞出现明显异常(<0.05、0.01),血液学其余各检查指标均未见明显差异。尽管上述指标统计数值出现异常变化,但其相关联的其余血液学检查均未见明显异常,未见明显量效关系,故不认为以上这些改变具有生物学意义。
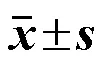
表3 各组雄性大鼠血液学检查结果(, n = 15)
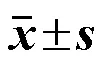
表4 各组雌性大鼠血液学检查结果(, n =15)
3.2.4 血液生化结果 如表5、6所示,与阴性对照组比较,给药30 d雌鼠热毒宁中剂量组TG水平出现明显异常(<0.05),恢复期末雄鼠热毒宁中剂量组GLU水平以及热毒宁低剂量组GLU和BUN水平出现明显异常(<0.05、0.01),血液生化学其余各项指标均未见明显差异。由于上述指标改变为偶发且不具备剂量相关性,故不认为以上这些改变具有生物学意义。
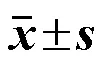
表5 各组雄性大鼠血生化检查结果(, n = 15)
ALT-丙氨酸氨基转移酶;AST-天冬氨酸氨基转移酶;ALP-碱性磷酸酶;TP-血清总蛋白;ALB-血清白蛋白;TB-血清总胆红素;GLU-血糖;BUN-血尿素氮;CRE-血肌酐;CHO-胆固醇;TG-三酰甘油;CK-肌酸激酶;γ-GT-γ-谷氨酰转肽酶,表6同。
ALT-alanine aminotransferase; AST-aspartate aminotransferase; ALP-alkaline phosphatase; TP-total protein; ALB-albumin; TB-total bilirubin; GLU-glucose; BUN-blood urea nitrogen; CRE-creatinine; CHO-cholesterol; TG-triglyceride; CK-creatine kinase; γ-GT-γ-glutamyl transferase, same as Table 6.
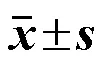
表6 各组雌性大鼠血生化检查结果(, n = 15)
3.2.5 脏器系数结果 如表7、8所示,与阴性对照组比较,给药30 d雄鼠热毒宁高剂量组脑、睾丸、附睾指数具有显著差异(<0.01),热毒宁中剂量组脑指数具有显著差异(<0.01),热毒宁低剂量组脑指数具有显著差异(<0.05);恢复期末雄鼠热毒宁高剂量组肾脏、肺脏指数具有显著差异(<0.05),热毒宁中剂量组肺脏指数具有显著差异(<0.05),热毒宁低剂量组肝脏指数具有显著差异(<0.01)。给药30 d雌鼠热毒宁中剂量组肺脏指数具有显著差异(<0.05),热毒宁低剂量组肾上腺指数具有显著差异(<0.01)。但是数值异常变化未见明显剂量相关性,脏器系数以及动物血液学、血清生化学结果均未见明显相关性的改变,考虑这些改变无生物学意义,与给予受试物无关。
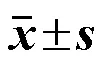
表7 各组雄性大鼠脏器指数变化(, n = 10)
与RH组比较:#<0.05##<0.01,表8同。
#< 0.05##< 0.01RH group, same as below table 8.
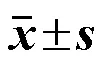
表8 各组雌性大鼠脏器指数变化(, n =10)
3.2.6 组织病理学观察 对各组动物的鼻甲、口腔黏膜、咽喉部、气管及肺部均进行组织病理学检查,并对阴性对照组及热毒宁高剂量组的其他脏器包括心、肝、脾、肺、肾等器官进行常规组织病理学检查。大体剖检与组织病理学检查结果表明,上述检测未见与药物相关的病理表现,各组动物脏器[脑、脊髓、垂体、胸腺、甲状腺、胃、小肠和大肠、肝脏、肾脏、肾上腺、脾脏、胰腺、气管、肺、主动脉、心脏、附睾、睾丸、卵巢、子宫、前列腺、坐骨神经、膀胱、食管旁淋巴结、肠系膜淋巴结、骨髓(股骨)、阴道、精囊、眼-哈氏腺]未见明显异常;所有受试动物鼻黏膜、口腔黏膜及咽喉部组织未见明显出血、变性等明显异常改变,肺及气管组织无明显渗出、出血及组织坏死等病理反应,提示热毒宁注射液对大鼠口腔黏膜、咽喉部组织及呼吸系统不产生明显的刺激作用,见图1。综上,认为热毒宁注射液未对受试动物产生药物毒性相关性病理改变。
3.3 全身主动过敏实验
实验过程中各组动物致敏和激发阶段体质量均增长,均未见其他明显异常症状。阴性对照组和热毒宁高、低剂量组动物采用不同激发物质雾化激发后,均未见明显过敏反应,激发后观察30 min,动物未见明显异常。阳性对照组动物激发后出现不安宁、咳嗽、呼吸急促、呼吸困难、紫绀、痉挛、潮式呼吸、死亡。热毒宁注射液吸入经豚鼠全身主动过敏实验,过敏反应呈阴性。
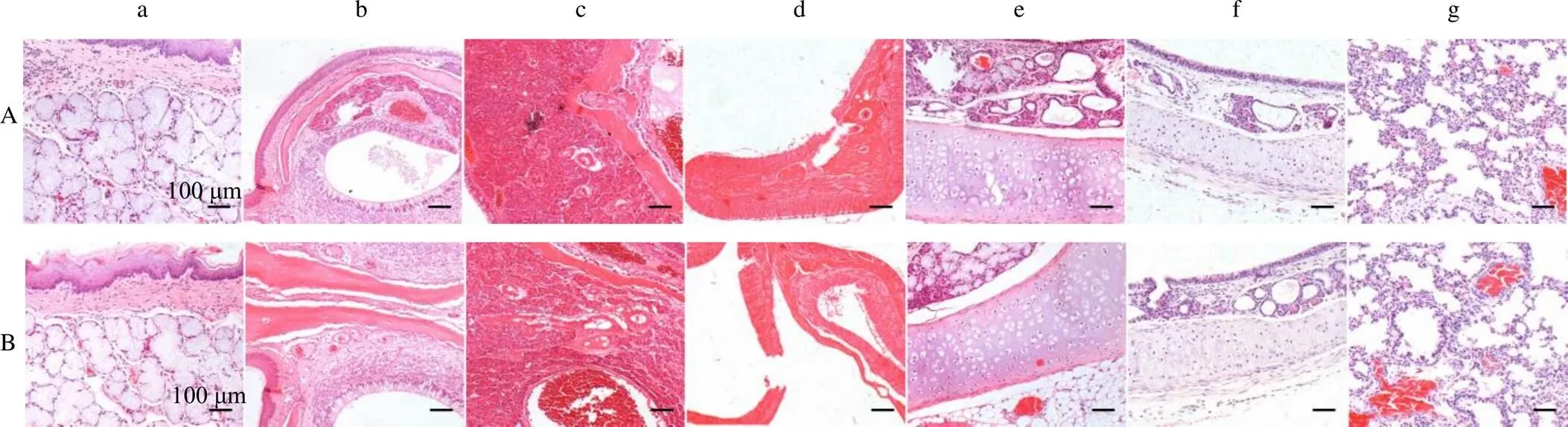
a-口腔黏膜组织;b-鼻腔前庭部鼻黏膜组织;c-鼻呼吸部鼻黏膜组织;d-鼻嗅部鼻黏膜组织;e-咽喉部组织;f-气管壁组织;g-肺脏组织。
3.4 大鼠肺组织沉积实验
3.4.1 热毒宁注射液药物成分筛选结果 栀子苷、新绿原酸、绿原酸及隐绿原酸4种成分是热毒宁注射液的质控成分。其定量分析方法已经在前期经过方法学验证[10]。另外从热毒宁注射液中共筛选出其他27种成分。31种成分的相对分子质量为138~756,包括环烯醚萜及其苷类、咖啡酰奎宁酸类、黄酮及其苷类以及其他糖苷类等。优化了31种药物成分的质谱参数,通过对稀释2 000倍和4 000倍的热毒宁溶液样品进行分析和检测,确定31种药物成分的保留时间。保留时间见表1,相应图谱见图2。
3.4.2 4种指标成分在大鼠肺组织的检出限与定量限
(1)检出限:本实验条件下,肺组织中栀子苷的检出限低于0.1 ng/mL,新绿原酸的检出限低于1 ng/mL,绿原酸的检出限低于0.2 ng/mL,隐绿原酸的检出限低于0.5 ng/mL。
(2)定量限:本实验条件下,肺组织中栀子苷的定量限约为0.2 ng/mL,新绿原酸的定量限约为2 ng/mL,绿原酸的定量限为0.5 ng/mL,隐绿原酸的定量限约为1 ng/mL。
(3)精密度:以各化合物的峰面积计算精密度,结果显示,4个化合物检出限的批内精密度RSD在10.0%~11.9%,批间精密度RSD在9.9%~11.2%;4个化合物定量限的批内精密度RSD在5.6%~10.3%,批间精密度RSD在6.3%~8.8%。
3.4.3 热毒宁注射液连续给药后不同恢复期大鼠肺组织沉积研究
(1)4种代表成分的大鼠肺组织沉积研究:如图3-A所示,随着恢复天数的增加,肺组织中栀子苷的峰面积呈现递减的趋势。恢复期第7天,低剂量组栀子苷的峰面积已经基本低于定量限。恢复期第14天,低、高剂量组栀子苷的峰面积已经基本低于检出限。如图3-B所示,随着恢复天数的增加,肺组织中新绿原酸的峰面积呈现递减的趋势,恢复期第7、14天,低、高剂量组雌、雄大鼠肺组织中均未检测到新绿原酸。如图3-C所示,恢复期第7天,低、高剂量组绿原酸的峰面积已经基本低于定量限。恢复期第14天,低、高剂量组栀子苷的峰面积已经基本低于检出限。如图3-D所示,恢复期第1天大鼠肺组织中均检测到隐绿原酸;恢复期第7、14天,低、高剂量组雌、雄大鼠肺组织中均未检测到隐绿原酸。上述结果表明栀子苷、绿原酸、新绿原酸均够在大鼠肺组织中逐渐被代谢和消除。
(2)其他27种药物成分的大鼠肺组织沉积研究:在其他27种药物成分的沉积研究中,来源于金银花的咖啡酸在每个恢复期取材点仅有1只大鼠肺中可检测到,其余5只均未检测到,说明该成分在肺组织中被代谢和消除。京尼平龙胆双糖苷、jasminoside、山栀子苷、京尼平苷酸、6′′--芥子酰基京尼平龙胆双糖苷均为环烯醚萜苷类成分;木犀草苷、芹菜素-7--葡萄糖苷、芦丁均为黄酮类成分,以及断氧化马钱子苷、断氧马钱子酸和獐牙菜苷仅能在恢复期第1、7天能检测到,其余15种成分在恢复期1、7和14 d均未检测到。

1-栀子苷;2-新绿原酸;3-绿原酸;4-隐绿原酸;5-山栀子苷;6-京尼平苷酸;7-京尼平龙胆双糖苷;8-6′′-O-香豆酰基京尼平龙胆双糖苷;9-6′′-O-阿魏酰基京尼平龙胆双糖苷;10-6′′-O-芥子酰基京尼平龙胆双糖苷;12-奎宁酸;13-咖啡酸;14-1,5-二咖啡酰奎宁酸;15-异绿原酸B;16-异绿原酸A;17-异绿原酸C;18-马钱苷酸;19-断氧化马钱子苷;20-断氧马钱子酸;23-阿魏酸;24-原儿茶醛;25-獐牙菜苷;26-芦丁;27-山奈酚;28-芹菜素-7-O-葡萄糖苷;29-木犀草苷;30-槲皮素-3-O-半乳糖苷。

图3 连续给药后不同恢复期大鼠肺组织中栀子苷 (A)、新绿原酸(B)、绿原酸(C) 和隐绿原酸(D) 的峰面积变化(, n = 18)
4 讨论
吸入给药在治疗呼吸道疾病方面具有明显的优势,近几年吸入给药的产品开发获得药品生产企业的重点关注,其中毒理研究是其关键的一环。目前针对吸入药物非临床评价的技术要求,仅经济合作与发展组织(OECD)颁布了吸入药物非临床试验技术指南。美国FDA提出了针对吸入药物的非临床评价建议[11],2008年药品审评中心组织专家对于吸入给药的安全性进行讨论,针对化药吸入给药的安全性公布了《肺部吸入制剂毒理研究的关注点》。指出吸入给药药物直接作用于肺部且有全身吸收,因此肺部、全身性吸入毒性研究十分有价值,其他给药途径的毒性无法替代。
雾化吸入给药为呼吸道的局部给药,药物在呼吸道的高暴露,需要关注药物对呼吸道黏膜的刺激和过敏。肺泡表面积巨大,血气屏障薄,代谢酶少,血流丰富,吸入后药物能够迅速入血,药物吸入给药的过程中会沉积在口咽部可通过胃肠道入血使药物在全身暴露,因此还需要关注药物全身暴露导致的其他脏器以及胃肠道的毒性。不同于单一成分化药,中药成分复杂药物成分吸入肺部后期代谢情况尚不清楚,因此对于多成分复方中药药物成分在肺部的滞留可能带来的风险是中药吸入给药安全性关注的焦点。热毒宁注射液是2005年版《药品注册管理办法》实施后获批的第1个中药注射剂新药,已经在临床应用多年,开展过系统的注射给药的临床前的安全性研究。本研究重点关注呼吸道高暴露以及药物成分在肺部滞留导致的安全性风险,包括雾化吸入给药黏膜刺激、过敏、重复给药对呼吸道带来的损害以及药物成分在肺部的滞留。
药物在肺部沉积的量和沉积部位是影响药物的安全性和有效性的重要因素,而粒径的大小是关键,粒径大小和分布影响着吸入制剂气溶胶在呼吸道不同部位的沉积量,只有具有足够小的空气动力学粒径的药物气溶胶才可能随着吸气进入肺部,才能充分暴露因雾化给药带来的风险。在毒理学实验中,推荐的气溶胶颗粒MMAD数值应为1~4 μm,而几何标准差应为1.5~3.0[12]。本研究对雾化粒径进行检测,其MMAD符合相关要求。实验采用口鼻暴露系统对动物进行雾化给药,考虑到药物的浓度不同,药物雾化产生的粒径大小、分布以及递送速率和递送总量等雾化特性参数也会产生变化,因而在实验中不同的剂量是以雾化吸入不同的给药时间区分,低、中、高剂量连续给药时间分别为30、60、120 min。药物的毒性与其吸入后药物的沉积量密切相关,目前对吸入药物的沉积测定体内技术包括以放射性同位素标记气雾粒子采用γ闪烁扫描法、单光子发射计算机断层成像、正电子发射计算机断层成像等影像技术和药物动力学体内方法和采用模拟支气管树观察粒子在不同部位的沉积的体外方法[13-16]。根据动物肺活量、雾化气溶胶浓度、给药时间计算出吸入量,以此作为毒性的给药剂量,计算所得低、中、高剂量分别为0.14、0.27、0.54 mL/kg,该剂量包括吸入沉积在口咽的量以及随着呼吸呼出的量,文献报道药物沉积量是吸入量的5%~30%[17]。
重复给药一般状况结果显示未见药物全身暴露导致的明显毒性反应,呼吸系统是药物的主要靶器官,因此对于呼吸系统的组织病理学检查要求的更为细致,需要对口鼻到肺部整个系统不同切面进行病理检查,结果显示,阴性对照组和受试物各剂量组所有受试动物肺、气管、鼻黏膜、口腔黏膜及咽部均未见明显病理性改变,其他脏器系统也未见明显异常,亦未出现豚鼠全身过敏反应。
中药雾化吸入药液由于其是多成分的复杂体系,其成分吸入后的代谢清除往往不清楚,其药物成分在肺部滞留可能带来的安全性的风险是关注的焦点。本研究通过检测热毒宁注射液吸入后不同时间点药物成分在肺脏中的浓度来探讨药物在肺部的滞留情况。热毒宁注射液成分主要包括环烯醚萜类、木脂素类、香豆素类、倍半萜类、黄酮类、咖啡酰奎宁酸类、酚酸类和单萜类等多种成分[18-19],以及一些微量物质如莫诺香、獐牙菜香[20]。热毒宁注射液化学成分除了来源于其组成药材中的成分外[21]还发现其在制备过程中产生了新的化合物[22]。目前已经从热毒宁注射液中分离和鉴定了100种成分。本研究首先选择了热毒宁注射液中的栀子苷、绿原酸、新绿原酸及隐绿原酸4种质控成分在肺组织的清除情况开展了重点研究,其次,根据文献资料及通过MRM-IDA-EPI方法从热毒宁注射液中鉴定出的27种成分作为补充研究,从而更全面地评价热毒宁注射液雾化吸入给药后药物成分从肺组织中消除的情况。本研究结果显示连续给药7 d,停药恢复14 d后,4种指标成分和其他27种药物成分均能够从肺中清除。
在吸入毒理的评价方面,中药制剂与单一化药成分有一致的部分,如在实验方案的总体设计、动物选择、实验的技术和方法以及指标评价等,但中药因为多成分复杂体系也有其特殊的地方,如何进行毒性评价需要进一步探讨。本研究为热毒宁注射液吸入制剂的临床应用提供依据和基础,同时也为中药吸入给药的安全性研究进行有益的探索。
利益冲突 所有作者均声明不存在利益冲突
[1] 张广平, 高云航, 苏萍, 等. 经肺吸入用中药液体制剂的研发及其应用前景展望 [J]. 中国现代中药, 2019, 21(12): 1732-1738.
[2] 王严冬, 劳成峰, 潘伊凡, 等. 热毒宁超声雾化吸入治疗急性上呼吸道感染发热临床研究 [J]. 湖北中医杂志, 2011, 33(3): 10-11.
[3] 聂微萱, 杨立华, 易宜江. 热毒宁注射液超声雾化吸入治疗小儿急性支气管炎96例临床研究 [J]. 亚太传统医药, 2012, 8(3): 125-126.
[4] 王辉. 热毒宁注射液雾化吸入治疗急性支气管炎的临床观察 [J]. 中国现代药物应用, 2010, 4(15): 140-141.
[5] 万珍, 徐志锋, 林俊明, 等. 热毒宁超声雾化吸入辅治慢性支气管炎急性发作疗效观察 [J]. 实用中医药杂志, 2014, 30(4): 298-299.
[6] 吕荣华, 侯明, 李素, 等. 热毒宁注射液静脉滴注和雾化吸入治疗毛细支气管炎45例 [J]. 中国实验方剂学杂志, 2013, 19(20): 289-292.
[7] 陈飞. 热毒宁注射液联合肾上腺素雾化吸入佐治小儿毛细支气管炎63例 [J]. 中医儿科杂志, 2013, 9(6): 25-28.
[8] 万玛措. 细辛脑配合热毒宁注射液雾化吸入治疗毛细支气管炎临床观察 [J]. 新中医, 2013, 45(9): 44-46.
[9] 申玉, 李若飞, 韩雄信, 等. 热毒宁雾化吸入对急性喘息性支气管炎患儿动脉血气指标及炎性介质水平的影响 [J]. 中国药业, 2015, 24(9): 28-30.
[10] 王丹, 史宏硕, 王宗浩, 等.6种清热解毒类中药注射液治疗儿童毛细支气管炎的贝叶斯网状Meta分析[J]. 药物评价研究, 2023, 46(2): 430-444.
[11] Zhang G P, Li Y F, Chen T F,. Comparative study of the efficacy and pharmacokinetics of Reduning Injection and atomization inhalation [J]., 2019, 118: 109226.
[12] Glover W, Chan H K, Eberl S,. Effect of particle size of dry powder mannitol on the lung deposition in healthy volunteers [J]., 2008, 349(1/2): 314-322.
[13] 周学海, 张成飞, 杨敏, 等. 肺部吸入制剂评价方法研究进展 [J]. 药物评价研究, 2019, 42(9): 1891-1895.
[14] 陈超阳, 赵侠, 周颖, 等. 吸入制剂肺部沉积量测定的方法学研究进展 [J]. 临床药物治疗杂志, 2014, 12(5): 12-15.
[15] 康修远, 葛庆华. 吸入制剂的肺部沉积与全身暴露的研究方法 [J]. 世界临床药物, 2015, 36(9): 636-639.
[16] 张海飞, 余珊珊, 曹瑾, 等. 吸入药物非临床毒性评价特点与要求 [J]. 中国药物警戒, 2021, 18(6): 570-574.
[17] 吴明慧, 刘强, 滕晓茗. 雾化吸入治疗的研究进展 [J]. 中国临床新医学, 2018, 11(11): 1167-1171.
[18] 葛雯, 李海波, 于洋, 等. 热毒宁注射液化学成分、药理作用及临床应用研究进展 [J]. 中草药, 2017, 48(5): 1027-1036.
[19] 李海波. 热毒宁注射液药效物质基础研究 [D]. 南京: 南京中医药大学, 2013.
[20] 王琳, 朱靖博. 热毒宁注射液微量化学成分研究 [A] // 中国食品科学技术学会第十五届年会论文摘要集 [C]. 青岛: 中国食品科学技术学会, 2018: 758-759.
[21] 葛雯, 李海波, 于洋, 等. 热毒宁注射液化学成分研究(Ⅳ) [J]. 中草药, 2017, 48(15): 3042-3050.
[22] 李海波, 于洋, 王振中, 等. 热毒宁注射液化学成分研究 (Ⅱ) [J]. 中草药, 2015, 46(11): 1597-1602.
Safety study of Reduning Injection after atomization inhalation administration
ZHANG Tengzhi1,SONG Ling1,TANG Liming2, HOU Hongping1,GU Shuyi2, GAO Yunhang1,HANG Ai2,LI Han1,PENG Bo1,CHEN Weiya1,CHEN Tengfei1,ZHANG Guangping1
1. Institute of Chinese Materia Medica China Academy of Chinese Medical Sciences,Beijing 100700, China 2. Department of Pharmacology and Toxicology of Shanghai Institute for Food and Drug Control,Shanghai 201112, China
To carry out a study on the possible safety risks after the administration of Reduning Injection (热毒宁注射液) by atomization inhalation, to provide a basis for the clinical application of Reduning Injection by atomization inhalation, and to explore the methods of preclinical safety evaluation of traditional Chinese medicine nebulized inhalation preparations.Toxicity tests for single-dose administration and repeated-dose administration for 30 d of Reduning Injection by nebulized inhalation in rats, and mucosal irritation in rats (observed with repeated administration) and active systemic anaphylaxis in guinea pigs were carried out under GLP conditions. The 31 components detected by the compositional analysis of Reduning Injection were examined in the lungs by stopping the drug for 1, 7, 14 d after seven consecutive days of administration.Rats were exposed orally and nasally 120 min/time, 2 times/d, and animals did not show obvious abnormalities; Reduning Injection low-, medium-, high-dose (30, 60, 120 min/d) groups of rats orally and nasally inhalation repeated administration of 30 d and recovery period of 14 d of toxicity test on the hematology, blood biochemistry, lung coefficients, urine, histopathology did not in the drug-related pathology, the mucous membranes of the respiratory tract did not see the irritation. The active systemic anaphylaxis in guinea pigs was negative. All 31 components analyzed for Reduning Injection were either undetectable or below the detection line after 14 d of withdrawal.The nebulized inhalation administration of Reduning Injection did not cause irritation and sensitization to the respiratory mucosa, and no obvious toxic reaction was observed in rats exposed orally and nasally for one month, and all the 31 components determined were able to be metabolized in the lungs without any deposition.
Reduning Injection; atomization inhalation; safety; lung deposition; geniposide;neochlorogenic acid;chlorogenic acid;cryptochlorogenic acid
R285.53
A
0253 - 2670(2024)09 - 3015 - 12
10.7501/j.issn.0253-2670.2024.09.016
2023-12-04
中国中医科学院科技创新工程重大攻关项目(CI2021A04615);国家自然科学基金青年项目(82204740);中国中医科学院中药研究所中药药理创新团队项目(CI2021B015);中央级公益性科研院所基本科研业务费专项(ZXKT22045);中国中医科学院科技创新工程课题(CI2023E001TS12)
张腾之(2001—),女,硕士研究生,主要从事中药药理研究。E-mail: ztz0113@163.com
宋 玲(1987—)女,助理研究员,主要从事中药药理研究。E-mail: lsong@icmm.ac.cn
通信作者:陈腾飞(1986—),男,副研究员,主要从事中药药动学研究。E-mail: flychen04@126.com
张广平(1975—),男,研究员,博士生导师,主要从事中药药理毒理研究。E-mail: iamzgp@163.com
[责任编辑 李亚楠]
