人参囊泡调控肿瘤免疫微环境的活性成分研究
2024-05-14肖莲莲余灵静刘艺芃张云羽程建明
肖莲莲,余灵静,刘艺芃,胡 杨,张云羽,嵇 晶,程建明*
人参囊泡调控肿瘤免疫微环境的活性成分研究
肖莲莲1, 2,余灵静1, 2,刘艺芃1, 2,胡 杨1, 2,张云羽1, 2,嵇 晶1, 2,程建明1, 2*
1. 南京中医药大学药学院,江苏 南京 210023 2. 江苏省经典名方工程研究中心,江苏 南京 210023
探讨人参来源的细胞外囊泡(ginseng-derived nanoparticles,GDNPs)在调控肿瘤相关巨噬细胞表型及抑制黑色素瘤生长方面的潜在物质基础。采用纳米颗粒跟踪分析仪、透射电镜测试及紫外-可见分光光度法全面表征GDNPs及其主要成分(蛋白质、多糖和皂苷)的含量;通过qRT-PCR和流式细胞术检测GDNPs与其含有的多糖、皂苷成分对骨髓来源巨噬细胞(bone marrow-derived macrophage,BMDM)表型的调控影响。收集不同极化程度的BMDM条件培养基(conditional medium,CM)孵育小鼠皮肤黑色素瘤B16F10细胞,CCK-8法测定不同CM处理后B16F10细胞活力,验证活性成分对肿瘤免疫微环境的调控作用;通过PMP柱前衍生法定量分析GDNPs活性成分组成。透射电镜下观察GDNPs形态结构良好,含量测定结果为2.46×1011颗粒的GDNPs含有4.31 mg蛋白质、4.46 mg多糖、1.22 mg皂苷。qRT-PCR和流式细胞术实验结果显示GDNPs多糖可以逆转M2型巨噬细胞表型,向M1方向极化。GDNPs多糖诱导巨噬细胞极化后的CM显著抑制了B16F10细胞活力。PMP柱前衍生法分析GDNPs多糖成分由葡萄糖、半乳糖、阿拉伯糖组成,其物质的量比为4.72∶1.07∶2.15。揭示了GDNPs中多糖成分在调控肿瘤免疫微环境的关键作用,为进一步的机制研究和临床应用提供了实验依据。
人参细胞外囊泡;肿瘤免疫微环境;巨噬细胞极化;多糖;葡萄糖;半乳糖;阿拉伯糖
目前,肿瘤免疫治疗在癌症的进展及其治疗策略中占据核心地位,肿瘤免疫治疗是指免疫细胞渗透到肿瘤部位启动抗癌免疫应答,控制或杀灭肿瘤细胞的疗法。但肿瘤细胞会通过劫持免疫检查点、重塑肿瘤的细胞外基质形成阻止免疫细胞浸润的屏障,以及通过影响免疫抑制细胞和免疫微环境中相关信号通路形成免疫抑制的肿瘤微环境,从而逃避机体免疫系统识别和攻击[1-2]。肿瘤免疫微环境由免疫细胞、肿瘤细胞、细胞因子以及其他多种分子间的精细相互作用所构成。癌细胞与肿瘤微环境之间持续、动态的相互作用是促进肿瘤发生、发展和转移的关键因素。在此环境中,巨噬细胞作为免疫反应的关键效应细胞,其表型转变及功能活性对肿瘤免疫微环境具有显著的调控作用。它们可以根据刺激和环境因素被激活为M1型(经典激活)或M2型(替代激活)。M1型巨噬细胞具备显著的抗肿瘤能力,呈现出免疫激活态,并能够释放免疫刺激性细胞因子。M2型巨噬细胞则具有促进肿瘤生长和扩散的潜力,释放免疫抑制性因子[3-5]。鉴于此,诱导巨噬细胞向M1型表型的转变已被视为肿瘤治疗的潜在策略,通过调节巨噬细胞极化状态来优化肿瘤免疫微环境,进而增强免疫治疗效果。
几乎所有的细胞类型,无论是在体内还是体外,都会产生细胞外囊泡(extracellular vesicles,EVs),它们的结构、成分和分子加工反映了它们起源细胞中发生的活动[6]。植物来源EVs具有天然生物活性脂质、蛋白质、RNA和其他药理活性分子,具有独特的形态和组成特征[7-9]。人参来源的细胞外囊泡(ginseng-derived nanoparticles,GDNPs)已经被证明具有调节免疫[10]、抗肿瘤[11]、抗衰老[12]、促进伤口愈合[13]、抗心肌损伤[14]、抗炎[15]、抗骨质疏松[16]的药理作用。之前的研究分别从体内、体外实验证明了GDNPs能够逆转肿瘤免疫微环境促进肿瘤相关巨噬细胞由M2向M1表型的极化,产生总活性氧,导致小鼠黑色素瘤细胞凋亡增加并显著抑制了荷瘤小鼠的黑色素瘤生长[17]。除此之外,药物通过血脑屏障治疗脑肿瘤的能力被认为是最重要的药物特性之一,而GDNPs在调节肿瘤免疫微环境,募集M1巨噬细胞的同时,对于透过血脑屏障靶向神经胶质瘤具有良好的潜力[18]。早期研究已揭示GDNPs内含丰富的代谢产物,并能够介导细胞间的信号通讯。这种介导机制主要通过Toll样受体4(Toll-like receptor 4,TLR4)和髓样分化因子88(myeloid differentiation primary response 88,MyD88)信号通路来实现,进而调节M2型巨噬细胞的功能,使其表现出抗肿瘤活性[17]。尽管有此初步发现,但GDNPs在调控肿瘤免疫微环境中的确切作用的活性成分还不完全。基于此,本研究旨在采用巨噬细胞极化模型,深入探讨GDNPs中的活性成分,以揭示其在肿瘤免疫微环境调控中的详细机制。
1 材料
1.1 动物与细胞株
SPF级雄性C57BL/6小鼠,6~8周龄,体质量18~22 g,由南京安诺康生物科技有限公司提供,实验动物合格证编号为NO.202343651,实验动物使用许可证号SYXK(苏)2018-0049,饲养温度为24~25 ℃,相对湿度为50%~60%,自由进食饮水。动物实验方案经南京中医药大学机构动物护理与使用委员会批准(批准号202306A011)。
B16F10小鼠皮肤黑色素瘤细胞系购自上海中科院细胞库。
1.2 药品与试剂
GDNPs由实验室制备,具体方法参考文献[17];RPMI 1640完全培养基(批号WHAA23X032)、0.02% EDTA溶液(Versene液,批号WH2622F311)均购自武汉普诺赛生物科技有限公司;巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF,批号0332537CL21)、白细胞介素-4(interleukin-4,IL-4,批号0332538KE01)、IL-13(批号0332650NG026)均购自苏州近岸蛋白质科技股份有限公司;BCA蛋白浓度测定试剂盒(批号GK10009)购自美国GlpBio公司;脂多糖(lipopolysaccharide,LPS,批号L8880)、红细胞裂解液(批号20220818)均购自北京索莱宝科技有限公司;甲醇(批号20230228)、乙醇(批号20220325)、三氯甲烷(批号20220311)、正丁醇(批号20221020)、石油醚(批号20220429)、无水磷酸二氢钠(批号20220217)均为分析纯,购自国药集团化学试剂有限公司;高氯酸(批号2012003)购自天津鑫源化工有限公司;流式细胞染色缓冲液(批号2207X220780)购自上海懋康生物科技有限公司;PE抗鼠CD206抗体(批号B369245)、FITC抗鼠CD86抗体(批号B367027)、抗鼠CD16/32抗体(批号B343988)均购自Biolegend公司;人参皂苷Re对照品(批号AZ21122181,质量分数为98%)购自成都埃法生物科技有限公司;岩藻糖标准品(批号C20PB02541B)购自普西唐生物科技有限公司;标准品半乳糖(批号S07HB193921)、葡萄糖醛酸(批号R09J11H115178)、阿拉伯糖(批号K28J12B135956)、半乳糖醛酸(批号J09HB187862)、鼠李糖(批号O12A10K95105)、木糖(批号D17N9S74410)购自上海源叶生物科技有限公司;葡萄糖标准品(批号E1811036)购自上海阿拉丁生化科技股份有限公司。
1.3 仪器
Gallios分析型流式细胞仪(美国Beckman公司);Nanosight NS300型纳米颗粒跟踪分析仪(英国Malvern公司);2695型高效液相色谱仪、2998型PDA紫外检测器(美国Waters公司)。
2 方法
2.1 GDNPs的表征及稳定性测试
2.1.1 透射电镜观察 取适量GDNPs,使用PBS稀释至适当浓度。取10 μL稀释液滴在铜网上,静置4 min,随后用2%磷钨酸染色3 min。在室温下自然风干后,置于200 kV电压的透射电镜下进行成像。
2.1.2 粒径与粒子浓度的测定 取适量GDNPs,并用PBS稀释到所需浓度,随后在纳米颗粒跟踪分析仪的自动模式下进行测量。
2.1.3 稳定性测试 将GDNPs置于4 ℃保存,每天于同一时间点利用纳米颗粒跟踪分析仪测定粒径,连续测定7 d,观察GDNPs粒径变化。
2.2 蛋白质、多糖、皂苷类成分含量测定
2.2.1 蛋白质含量测定 根据BCA蛋白浓度测定试剂盒测定蛋白质含量,精密量取供试品溶液2 μL,用空白溶剂补足至20 μL,各孔加入200 μL BCA工作液,37 ℃放置30 min,在562 nm下测定各个样品吸光度()值,按标准曲线计算其在GDNPs中的含量。
2.2.2 多糖含量测定 采用苯酚硫酸法测定GDNPs中的多糖含量,精密量取葡萄糖标准品溶液0、0.1、0.2、0.4、0.6、0.8、1.0 mL分别置于干燥至恒定质量的试管中,以蒸馏水补至1.0 mL。精密加入5%苯酚溶液0.5 mL及浓硫酸2.5 mL,充分振摇5 min,置沸水浴加入20 min,立即置于冰水浴中冷却3 min,在488 nm处测定各溶液的值。精密量取供试品溶液0.1 mL,测定方法同标准品,在488 nm处测定各供试品的值,按标准曲线计算其在GDNPs中的含量。
2.2.3 皂苷类成分含量测定 精密吸取人参皂苷Re对照品溶液0、10、20、40、80、100、120 μL,分别置10 mL干燥的具塞试管中,60 ℃水浴蒸干溶剂,精密加5%香草醛冰醋酸溶液-高氯酸(2∶8)的混合溶液1 mL,置60 ℃水浴中加热15 min,取出,置冰水浴中冷却,精密加冰醋酸5 mL,摇匀,在544 nm处测定各溶液的值。精密量取供试品溶液300 μL,测定方法同标准品,在544 nm处测定各供试品的值,按标准曲线计算其在GDNPs中的含量。
2.3 GDNPs多糖、皂苷成分提取方法
取适量GDNPs加入10倍量的去离子水在80 ℃下煎煮2 h,趁热抽滤,收集滤液,减压浓缩至10 mL,加入无水乙醇调整体积分数至95%,4 ℃静置过夜,收集沉淀,纯水复溶后使用Sevag法进行脱蛋白处理,蒸干溶剂,纯水复溶得到GDNPs多糖样品(GP)。
取适量GDNPs加入10倍量的70%乙醇溶液回流提取2 h,趁热抽滤,收集滤液,减压浓缩至无醇味,依次使用石油醚、三氯甲烷、水饱和正丁醇萃取,回收正丁醇层,蒸干,纯水复溶得到GDNPs皂苷样品(GG)。
2.4 B16F10细胞培养
B16F10细胞用含10%胎牛血清的RPMI 1640完全培养液,于37 ℃、5% CO2的细胞培养箱中培养,每隔3 d传代1次。
2.5 骨髓来源巨噬细胞(bone marrow-derived macrophage,BMDM)极化相关实验
2.5.1 BMDM提取 C57BL/6小鼠脱颈处死,迅速浸泡在75%乙醇中5~10 min。在超净台上分离小鼠的股骨和胫骨,并转移至PBS中。利用无菌手术剪刀小心地切除股骨的两端,随后用1 mL带针注射器抽取PBS,并注入股骨两端,使骨髓细胞流出到培养皿内。利用移液枪反复吹打,使细胞形成单细胞悬液。细胞悬液过100 μm的细胞滤网,以去除细胞团块、骨碎片、皮毛和其他杂质。细胞悬液于室温1 500 r/min离心5 min后,去掉上清液。加入1 mL红细胞裂解液孵育3 min,于室温1 500 r/min离心5 min,然后用PBS洗涤细胞。将细胞重新悬浮在含20 ng/mL M-CSF的RPMI 1640完全培养基中。在显微镜下观察细胞形态,并放置在CO2恒温培养箱中培养。每2~3天更换1次培养基,直到第7天观察到梭形细胞,标志着BMDM的成熟。
2.5.2 qRT-PCR分析BMDM的、mRNA表达 将成熟的BMDM调整至1×106个/孔,设置空白组、模型组和给药组,空白组只添加不含胎牛血清的RPMI 1640培养基,模型组加入20 ng/mL的IL-4、IL-13),孵育48 h;给药组在添加20 ng/mL的IL-4、IL-13孵育24 h后,分别添加低、中、高剂量(10、20、40 μg/mL)的多糖提取物(GP1、GP2、GP3)或低、中、高剂量(3、6、12 μg/mL)的皂苷成分提取物(GG1、GG2、GG3)孵育至48 h。给药结束后弃去培养基,用PBS缓冲液冲洗2次,按照试剂盒说明书提取细胞总RNA并合成cDNA,进行qRT-PCR分析。引物序列见表1。

表1 引物序列
2.5.3 流式细胞术检测BMDM的CD206、CD86荧光表达 将成熟的BMDM调整至1×106个/孔,设置空白组、模型组和给药组,空白组只添加不含胎牛血清的RPMI 1640培养基,模型组加入20 ng/mL的IL-4、IL-13),孵育48 h;给药组在添加20 ng/mL的IL-4、IL-13孵育24 h后,分别添加10 μg/mL GDNPs或低、中、高剂量(10、20、40 μg/mL)的多糖提取物(GP1、GP2、GP3)或低、中、高剂量(3、6、12 μg/mL)的皂苷成分提取物(GG1、GG2、GG3)孵育至48 h。给药结束后,每孔加入1 mL 0.02% EDTA溶液,消化收集细胞,加入1 mL细胞染色缓冲液洗涤细胞2次,500 μL细胞染色缓冲液重悬,收集细胞于1.5 mL EP管中。加入Fc受体封闭剂抗鼠CD16/32冰上孵育10 min,然后加入PE抗鼠CD206抗体、FITC抗鼠CD86抗体于冰上染色30 min。孵育结束后,加入1 mL PBS洗涤细胞2次,4 ℃、1 500 r/min离心5 min;弃去上清,加入500 μL PBS重悬细胞,过300目筛网转移至流式管中,使用流式细胞仪检测各个标记物的表达情况。
2.5.4 BMDM条件培养基(conditional medium,CM)的制备[19-20]诱导成熟的BMDM分为M1组(加入100 ng/mL的LPS)、M2组(加入20 ng/mL的IL-4、IL-13)、GP1组(在添加IL-4、IL-13孵育24 h后添加10 μg/mL GP孵育至48 h)、GP2组(在添加IL-4、IL-13孵育24 h后添加20 μg/mL GP孵育至48 h)、GP3组(在添加IL-4、IL-13孵育24 h后添加40 μg/mL GP孵育至48 h),给药孵育后得到不同极化的巨噬细胞,在无血清培养基中孵育24 h后弃去培养基,10 000 r/min离心5 min,收集上清作为CM,分别得到M1-CM、M2-CM、GP1-CM、GP2-CM、GP3-CM用于孵育B16F10细胞,测定B16F10细胞活力以验证GDNPs中的活性成分。
2.6 CCK-8法检测B16F10细胞活力
常规培养B16F10细胞,调整细胞数为5×103个/mL,接种于96孔板,每孔加入细胞混悬液100 µL,待细胞贴壁后,加入不同CM继续培养,空白组与调零孔(不含细胞)加入无血清培养基,24 h后弃去旧培养基,每孔加入100 μL培养基洗涤2次后更换新的培养基,各孔加入10 µL的CCK-8试剂,37 ℃孵育4 h,并于酶标仪上读取各孔在450 nm处的值,计算细胞活力。
细胞活力=(给药-调零)/(空白-调零)
2.7 GDNPs多糖的单糖组成分析及方法学考察[21-23]
2.7.1 PMP柱前衍生法分析单糖组成 取适量GDNPs,加入3 mol/L三氟乙酸溶液3 mL,超声溶解,封口,110 ℃水解6 h,放冷至室温,3 000 r/min离心10 min,取上清液减压蒸干,加甲醇溶解蒸干5~6次,残渣加超纯水溶解定容至1 mL,制得水解后样品供试液。取葡萄糖、阿拉伯糖、鼠李糖、木糖、半乳糖、甘露糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸标准品溶液及样品各400 μL,加400 μL的0.5 mol/L PMP甲醇溶液和400 μL的0.3 mol/L氢氧化钠溶液,混匀,70 ℃水浴加热100 min后,再加500 μL的0.3 mol/L盐酸,混匀。加入2 mL三氯甲烷萃取,剧烈摇晃,3 500 r/min离心5 min,弃去氯仿层,过0.22 μm滤膜得PMP衍生化样品。使用Waters高效液相色谱仪进行分析,色谱条件为Agilent ZORBX SB-aq C18色谱柱(150 mm×4.6 mm,4 μm);检测波长250 nm;柱温25 ℃;体积流量1 mL/min;流动相为磷酸二氢钠盐缓冲液(0.1 mol/L,pH 6.85)-乙腈(82∶18),等度洗脱。
2.7.2 线性关系考察 按“2.7.1”项下方法制备各对照品系列质量浓度的PMP衍生化标准品溶液,在“2.7.1”项色谱条件下进样分析。以葡萄糖、半乳糖、阿拉伯糖3个成分的质量浓度为横坐标(),峰面积为纵坐标(),分析得到其线性回归方程、线性系数()和线性范围分别为葡萄糖=585 162+837 782,=0.999 3,线性范围1.05~20.96 mg/mL;半乳糖=901 803+35 251,=0.999 6,线性范围0.20~12.26 mg/mL;阿拉伯糖=950 752-92 833,=0.999 7,线性范围0.35~10.46 mg/mL。结果显示,3个成分的线性系数在0.999 3~0.999 7,符合线性关系考察要求。
2.7.3 精密度试验 取上述对照品溶液,按照“2.7.1”项下制备PMP衍生化标准品溶液,在“2.7.1”项色谱条件下连续进样6次,测定峰面积并计算RSD值。结果显示,葡萄糖、半乳糖、阿拉伯糖3个成分的峰面积RSD分别为1.23%、1.19%、1.36%,均小于3%,表明仪器精密度良好。
2.7.4 稳定性试验 取GDNPs样品,按照“2.7.1”项下方法制备PMP衍生化供试品溶液,室温下于0、2、4、8、12 h在“2.7.1”项色谱条件下进样测定峰面积并计算RSD值。结果显示,供试品溶液中葡萄糖、半乳糖、阿拉伯糖3个成分的峰面积RSD分别为2.34%、2.78%、2.06%,均小于3%,表明供试品溶液在12 h内稳定性良好。
2.7.5 重复性试验 取GDNPs样品,按照“2.7.1”项下方法平行制备6份PMP衍生化供试品溶液,按“2.7.1”项色谱条件下进样测定峰面积并计算RSD值。结果显示,供试品溶液中葡萄糖、半乳糖、阿拉伯糖的峰面积RSD分别为1.40%、1.82%、1.52%,均小于3%,表明该方法重复性较好。
2.7.6 加样回收率试验 精密量取6份已测定单糖含量的GDNPs样品,每份1 mL,分别精密加入样品中指标成分质量与对照品质量比例约为1∶1的对照品溶液,按照“2.7.1”项下方法制备PMP衍生化供试品溶液,在“2.7.1”项色谱条件下进样测定,计算各供试品的加样回收率和RSD值。结果显示,葡萄糖、半乳糖、阿拉伯糖3个成分的平均加样回收率分别为98.30%、102.11%、101.76%,RSD分别为2.52%、2.08%、1.79%,且均小于3%,加样回收率试验结果良好。
2.8 统计学分析
3 结果
3.1 GDNPs的表征及稳定性测试
GDNPs是由人参细胞分泌的一种具有膜结构的小泡,能够携带蛋白质、mRNA、miRNA和代谢物等成分,在植物机体中参与生长代谢过程。对GDNPs进行表征如图1-A所示,在透射电镜下可以看出GDNPs呈双层膜结构的圆形小泡,独特空间结构可作为载体运载人参的活性成分靶向受体部位,介导一系列的生物学功能。使用纳米颗粒跟踪分析仪测定GDNPs的粒径,结果见图1-B,GDNPs的粒径分布在60~320 nm。本研究利用纳米颗粒跟踪分析仪连续7 d监测GDNPs在4 ℃环境存放过程中的粒径变化,结果如图1-C所示,GDNPs的粒径并无明显变化,表明在4 ℃条件下GDNPs可以储存7 d,且稳定性良好。

A-GDNPs超微结构;B-GDNPs粒径;C-GDNPs在4 ℃环境存放过程中的粒径变化。
3.2 GDNPs的含量测定
2.46×1011颗粒的GDNPs含有4.31 mg蛋白质、4.46 mg多糖、1.22 mg皂苷,结果显示多糖成分的含量最高。在目前的研究报道中,人参中多糖成分与皂苷均具有逆转巨噬细胞表型,调控肿瘤免疫微环境的作用[3,24]。前期研究已经证明GDNPs脂质和蛋白质导致了M2型巨噬细胞极化的改变[17]。本研究进一步对GDNPs中的皂苷与多糖是否为调控巨噬细胞表型活性成分进行研究。
3.3 不同成分对M2型BMDM极化的影响
3.3.1 不同成分对M2型BMDM、mRNA表达的影响 为探究GDNPs逆转M2巨噬细胞表型的活性成分,分别提取了GDNPs的多糖与皂苷成分。CD206为M2型巨噬细胞表面标志物,CD86为M1型巨噬细胞表面标志物。由图2可知,GP组可以改变巨噬细胞表型,向M1方向极化,而GG组不能逆转M2型巨噬细胞的极化表型。
3.3.2 不同成分对M2型BMDM CD206、CD86荧光表达的影响 如图3所示,GP组与GG组结果同qRT-PCR实验结果一致,GP组诱导的巨噬细胞表面标志物CD86和CD206均呈显著性升高和降低(<0.05、0.01)。其中GDNPs组对于逆转M2型巨噬细胞表型药理效应最佳,这可能与GDNPs具有纳米囊泡结构有关,提高了生物利用度。GG组虽然没有对M2型巨噬细胞表型起逆转作用,但其驱使巨噬细胞继续向替代激活的M2抗炎表型极化,其抗炎作用可能协同其他活性成分,防止过度逆转M2表型,避免GDNPs对机体造成炎症损伤。
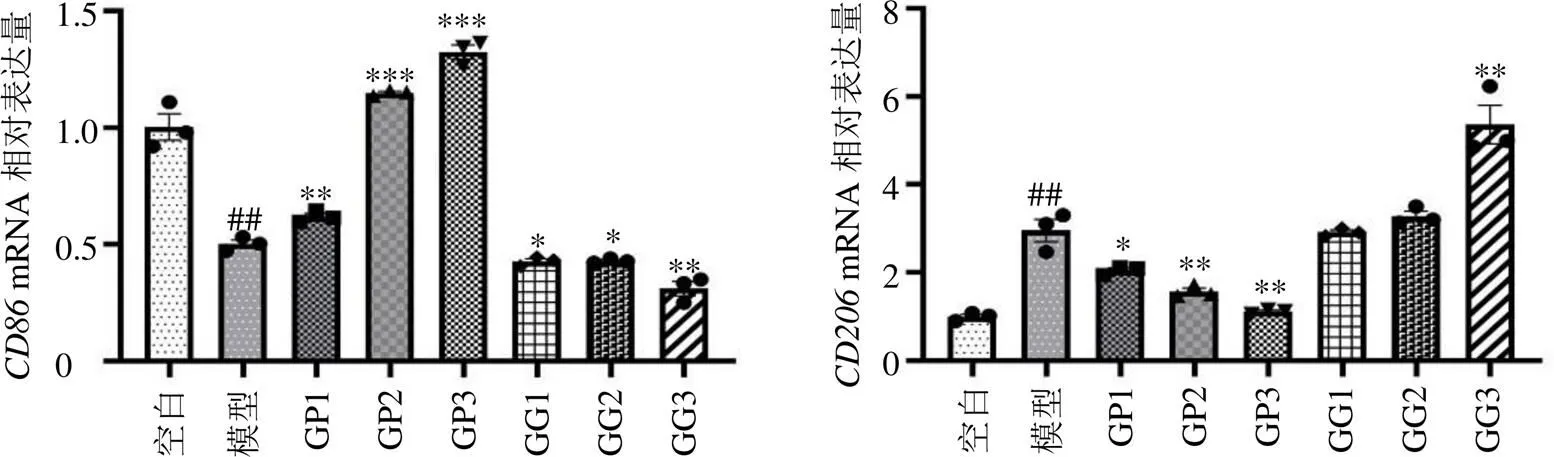
与空白组比较:##P<0.01 ###P<0.001;与模型组比较:*P<0.05 **P<0.01 ***P<0.001,图3同。
3.4 活性成分处理的巨噬细胞CM抑制B16F10细胞增殖
为了进一步验证GP是否为GDNPs介导调控肿瘤免疫微环境发挥抗癌效应的活性成分,制备不同成分诱导后的巨噬细胞CM,使用不同CM处理B16F10细胞24 h,通过CCK-8法评价不同CM对B16F10细胞增殖作用的影响。如图4所示,M2-CM无明显抑制B16F10细胞增殖的作用,GP-CM能够显著抑制B16F10细胞的增殖。
3.5 活性多糖成分的单糖组成分析
采用PMP柱前衍生法对活性GP进行单糖组成分析,图5-A、B分别为单糖标准品色谱图、GDNPs活性多糖成分水解液的色谱图。经HPLC测定GDNPs活性多糖由葡萄糖、半乳糖、阿拉伯糖组成,其物质的量比为4.72∶1.07∶2.15。
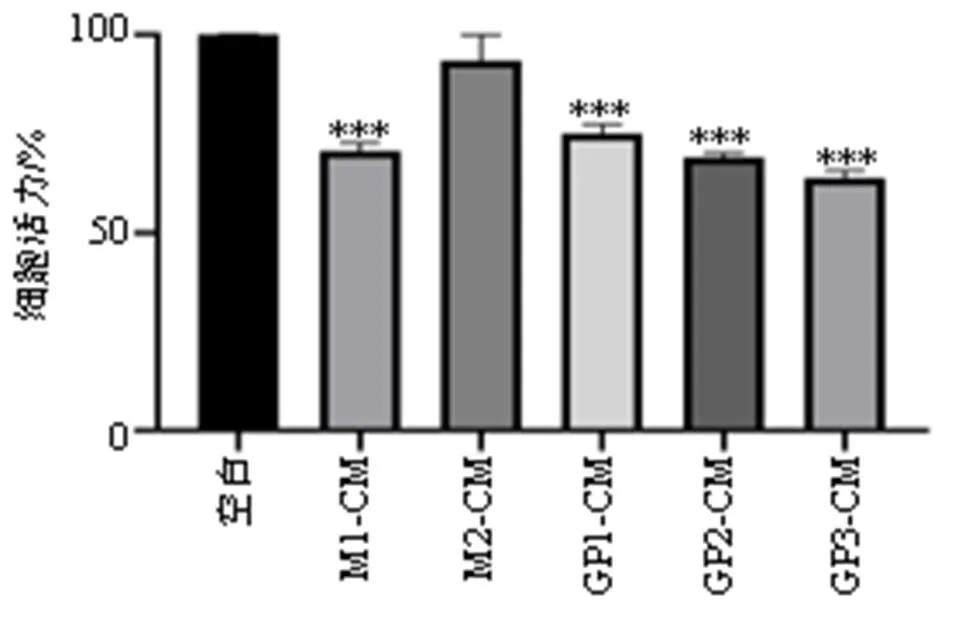
与空白组比较:***P<0.001。

A-单糖标准品色谱图(1-PMP,2-岩藻糖,3-半乳糖,4-葡萄糖醛酸,5-阿拉伯糖,6-半乳糖醛酸,7-鼠李糖,8-葡萄糖,9-木糖);B-水解GDNPs多糖样品的色谱图(1-PMP,2-葡萄糖,3-半乳糖,4-阿拉伯糖)。
4 讨论
目前,治疗癌症方法不再专注于靶向肿瘤细胞本身,因为癌症的进展是由肿瘤细胞和肿瘤部位环境之间的相互作用调控的,肿瘤微环境是一个以肿瘤为主体,由肿瘤细胞、基质细胞、免疫细胞和细胞外基质组成的复杂的肿瘤生态系统。在肿瘤微环境中,巨噬细胞与肿瘤细胞、免疫细胞和基质细胞的密集对话可以驱动促或抗肿瘤表型。反之,肿瘤相关的巨噬细胞在肿瘤微环境中强烈塑造细胞因子和代谢物水平,因此在抗肿瘤免疫中发挥重要作用。M1型巨噬细胞通过支持1型T辅助性细胞(1 type helper T-lymphocyte,Th1)介导的抗癌反应和促进细胞毒性T细胞的招募来促进肿瘤相关巨噬细胞的抗肿瘤反应[25-28]。
植物来源的EVs相较于动物细胞外囊泡展示出一系列显著的优越性[29-32]。这些优势主要体现在植物EVs的低免疫原性上,这一特性在治疗应用中显得尤为重要,因为它极大降低了引发免疫系统反应的可能性。此外,从经济和可持续发展的角度来看,植物细胞的批量培养过程既经济又高效,相比之下,动物细胞的培养更为复杂和成本较高。植物EVs在极端环境条件下展现出的稳定性,如高温和干燥条件下的稳定性,对于药物的长期储存和运输是一个不可忽视的优点。从药物递送的角度来看,植物EVs作为天然的载体,能够有效地运输包括RNA、DNA和蛋白质在内的多种药物分子。这种生物相容性强的特性,减少了在临床应用中产生不良反应的风险。而且,选择植物源的EVs作为递送载体,可以避免与动物源相关的污染和病原体传播的风险。在某些情况下,特定植物的EVs还可能包含有独特的生物活性成分,这为开发新型治疗策略提供了潜在的途径[33]。
植物EVs在药物输送系统中的应用尤其引人注目。它们被认为是一种生物兼容、可生物降解且来源广泛的纳米输送系统,可用于无细胞治疗。在临床前和临床研究中,植物EVs已显示出比传统合成载体更多的优势,为新型药物输送系统开辟了新的前沿领域。例如,姜源EVs在改变肠道菌群和调节宿主生理以抑制结肠炎方面展现出了潜力[34]。Umezu等[35]证明了针叶樱桃衍生的纳米囊泡在封装和保护核酸方面的可行性,以及它们在将这些化合物递送至体内靶位点的有效性。Pomatto等[36]研究了来源于柑橘汁的EVs作为口服给药的编码严重急性呼吸系统综合征冠状病毒2型S1蛋白亚基的信使核糖核酸疫苗的载体,该疫苗具有胃抗性口服胶囊制剂。加载到EVs中的mRNA受到保护,并且在冷冻干燥和封装后在室温下稳定1年。
GDNPs在调节肿瘤免疫微环境方面已显示出显著的潜力,Han等[37]研究证明GDNPs可以重组肿瘤相关巨噬细胞,增加CC类趋化因子5(CC chemokine ligand 5,CCL5)和趋化因子CXC配体9(C-X-C motif chemokine 9,CXCL9)的分泌,招募CD8+T细胞进入肿瘤床,将冷肿瘤微环境转换为热肿瘤微环境改善免疫检查点抑制剂治疗效果。Lv等[10]研究发现由于GDNPs改变了精氨酸酶-1的表达,从而激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)活性,同时上调由mTOR活性调节的T-bet表达。而促进T细胞耗竭的T细胞中转录因子Eomes和Tox的表达受到抑制,最终降低了免疫检查点的表达,改善了T细胞耗竭,恢复了T细胞的抗肿瘤作用,更好地治疗癌症。为了进一步研究GDNPs的药理学作用机制,本研究对其物质基础进行了分析讨论,GDNPs多糖相较于蛋白质、皂苷含量最多,可以有效逆转肿瘤相关巨噬细胞的表型,同时GDNPs多糖作用巨噬细胞后的培养基可有效抑制B16F10细胞的增殖能力。M1型巨噬细胞主导的免疫微环境有助于炎症反应,但也可能导致周围健康组织的损伤。此外发现,GDNPs皂苷能够调节炎症环境,促进肿瘤环境中的巨噬细胞向抗炎表型极化,可以避免持续的炎症反应导致组织损伤与功能障碍。综上,本研究揭示了GDNPs中多糖成分的关键作用,为进一步的机制研究和临床应用提供了有价值的信息。未来的研究可以进一步探讨GDNPs的其他活性成分,以及如何优化其在肿瘤治疗中的应用。
利益冲突 所有作者均声明不存在利益冲突
[1] 高壬驰, 陈潼, 孟兰迪杨, 等. 肿瘤免疫微环境及其在靶向治疗中的应用[J]. 中国新药与临床杂志, 2024, 43(2): 120-127.
[2] 褚国良, 凤志慧. 靶向肿瘤相关巨噬细胞用于肿瘤免疫治疗的研究进展 [J]. 中国药理学与毒理学杂志, 2023, 37(4): 281-288.
[3] Fendl B, Berghoff A S, Preusser M,. Macrophage and monocyte subsets as new therapeutic targets in cancer immunotherapy [J]., 2023, 8(1): 100776.
[4] 王盛典, 贾明明. 肿瘤免疫微环境在肿瘤常规治疗效应中的作用 [J]. 中国肿瘤生物治疗杂志, 2012, 19(3): 229-238.
[5] 姜祺, 郑新, 沈欢, 等. 肿瘤相关巨噬细胞及其靶向治疗的研究进展 [J]. 中国细胞生物学学报, 2022, 44(10): 1944-1953.
[6] Rahmati S, Karimi H, Alizadeh M,. Prospects of plant-derived exosome-like nanocarriers in oncology and tissue engineering [J]., 2024, 37(1): 121-138.
[7] Dad H A, Gu T W, Zhu A Q,. Plant exosome-like nanovesicles: Emerging therapeutics and drug delivery nanoplatforms [J]., 2021, 29(1): 13-31.
[8] 苏勇汇, 徐珊珊, 王欢, 等. 药用植物细胞外囊泡作为新型药效物质的研究进展[J]. 中草药, 2023, 54(12): 4044-4052.
[9] 中国研究型医院学会细胞外囊泡研究与应用专业委员会中草药囊泡研究与应用专家委员会, 中草药囊泡广东省工程研究中心, 广东省中医药学会中草药囊泡研究与应用专业委员会, 等. 中草药囊泡研究与应用专家共识(2023年版)[J]. 中草药, 2024, 55(1): 12-22.
[10] Lv Y, Li M Y, Weng L,. Ginseng-derived nanoparticles reprogram macrophages to regulate arginase-1 release for ameliorating T cell exhaustion in tumor microenvironment [J]., 2023, 42(1): 322.
[11] 刘恬佳. 人参根外囊泡的提取工艺及其抗肿瘤活性研究 [D]. 长春: 长春中医药大学, 2022.
[12] Cho E G, Choi S Y, Kim H,.-derived extracellular vesicles facilitate anti-senescence effects in human skin cells: An eco-friendly and sustainable way to use ginseng substances [J]., 2021, 10(3): 486.
[13] 卢姝言, 杨松, 任李梅, 等. 人参外泌体促进HaCat细胞增殖和伤口愈合 [J]. 中国生物化学与分子生物学报, 2021, 37(11): 1510-1519.
[14] 刘恬佳, 邱智东, 邱野, 等. 人参根外泌体的提取、表征及其对多柔比星诱导的心肌损伤保护作用机制 [J]. 中草药, 2021, 52(12): 3514-3521.
[15] 杨松. 人参外泌体的分离鉴定及其对炎症性肠病的干预作用和机制研究 [D]. 长春: 长春中医药大学, 2023.
[16] Seo K, Yoo J H, Kim J,. Ginseng-derived exosome-like nanovesicles extracted by sucrose gradient ultracentrifugation to inhibit osteoclast differentiation [J]., 2023, 15(12): 5798-5808.
[17] Cao M, Yan H J, Han X,. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth [J]., 2019, 7(1): 326.
[18] Kim J, Zhu Y, Chen S H,. Anti-glioma effect of ginseng-derived exosomes-like nanoparticles by active blood-brain-barrier penetration and tumor microenvironment modulation [J]., 2023, 21(1): 253.
[19] Xu F, Cui W Q, Wei Y,. Astragaloside IV inhibits lung cancer progression and metastasis by modulating macrophage polarization through AMPK signaling [J]., 2018, 37(1): 207.
[20] 张云超, 马金昀, 程晓东. 红花多糖诱导巨噬细胞M1型极化及抑制黑色素瘤细胞侵袭迁移的实验研究 [J]. 免疫学杂志, 2021, 37(5): 380-389.
[21] 黄小兰, 何旭峰, 杨勤, 等. PMP柱前衍生化HPLC法测定地参多糖的单糖组成 [J]. 食品与发酵工业, 2020, 46(7): 250-256.
[22] 周彦强, 吴光斌, 陈发河. PMP柱前衍生化HPLC法测定黄秋葵多糖的单糖组成 [J]. 食品科学, 2019, 40(4): 266-271.
[23] 王小燕, 郭常润, 常军民, 等. 怀牛膝多糖的柱前衍生化-HPLC指纹图谱建立及单糖成分含量测定 [J]. 中国药房, 2021, 32(3): 294-300.
[24] Li M, Wang X, Wang Y,. Strategies for remodeling the tumor microenvironment using active ingredients of ginseng-A promising approach for cancer therapy [J]., 2021, 12: 797634.
[25] 王旭奔, 魏海明, 郑小虎. 肿瘤免疫微环境中的NK细胞及免疫治疗 [J]. 中国肿瘤生物治疗杂志, 2022, 29(12): 1057-1066.
[26] 郭秋均, 李杰. 肿瘤相关巨噬细胞在重塑肿瘤免疫微环境中的作用 [J]. 肿瘤, 2013, 33(10): 922-927.
[27] 王静雅, 夏思源, 赵慧媛, 等. 树突状细胞在肿瘤免疫中作用的初步研究 [J]. 南开大学学报: 自然科学版, 2019, 52(3): 7-10.
[28] Munakata L, Tanimoto Y, Osa A,. Lipid nanoparticles of Type-a CpG D35 suppress tumor growth by changing tumor immune-microenvironment and activate CD8 T cells in mice [J]., 2019, 313: 106-119.
[29] He B Y, Hamby R, Jin H L. Plant extracellular vesicles: Trojan horses of cross-Kingdom warfare [J]., 2021, 3(9): 657-664.
[30] Teng Y, Ren Y, Sayed M,. Plant-derived exosomal microRNAs shape the gut microbiota [J]., 2018, 24(5): 637-652.e8.
[31] Yang M, Luo Q Q, Chen X,. Bitter melon derived extracellular vesicles enhance the therapeutic effects and reduce the drug resistance of 5-fluorouracil on oral squamous cell carcinoma [J]., 2021, 19(1): 259.
[32] de Robertis M, Sarra A, D’Oria V,. Blueberry-derived exosome-like nanoparticles counter the response to TNF-α-induced change on gene expression in EA.hy926 cells [J]., 2020, 10(5): 742.
[33] Logozzi M, Di Raimo R, Mizzoni D,. The potentiality of plant-derived nanovesicles in human health-a comparison with human exosomes and artificial nanoparticles [J]., 2022, 23(9): 4919.
[34] Zhang M Z, Viennois E, Prasad M,. Edible ginger-derived nanoparticles: A novel therapeutic approach for the prevention and treatment of inflammatory bowel disease and colitis-associated cancer [J]., 2016, 101: 321-340.
[35] Umezu T, Takanashi M, Murakami Y,. Acerola exosome-like nanovesicles to systemically deliver nucleic acid medicine via oral administration [J]., 2021, 21: 199-208.
[36] Pomatto M A C, Gai C, Negro F,. Oral delivery of mRNA vaccine by plant-derived extracellular vesicle carriers [J]., 2023, 12(14): 1826.
[37] Han X, Wei Q, Lv Y,. Ginseng-derived nanoparticles potentiate immune checkpoint antibody efficacy by reprogramming the cold tumor microenvironment [J]., 2022, 30(1): 327-340.
Active components of ginseng vesicles regulating tumor immune microenvironment
XIAO Lianlian1, 2, YU Lingjing1, 2, LIU Yipeng1, 2, HU Yang1, 2, ZHANG Yunyu1, 2, JI Jing1, 2, CHENG Jianming1, 2
1. School of Pharmacy, Nanjing University of Chinese Medicine, Nanjing 210023, China 2. Jiangsu Classic Famous Formula Engineering Research Center, Nanjing 210023, China
To explore the potential material basis of ginseng-derived nanoparticles (GDNPs) in regulating tumor-associated macrophage phenotype and inhibiting melanoma growth.GDNPs and their major components (proteins, polysaccharides and saponins) were comprehensively characterized using nanoparticle tracking analyzer, transmission electron microscopy test and UV-Vis spectrophotometry. The regulatory effects of GDNPs and their polysaccharide and saponin components on the phenotype of bone marrow-derived macrophages (BMDM) were examined by qRT-PCR and flow cytometry experiments. B16F10 cells were incubated in BMDM conditioned medium (CM) with different degrees of polarization, and the viability of B16F10 cells was determined by CCK-8 assay to verify the modulation of the tumor immune microenvironment by the active ingredients. The active ingredient composition of GDNPs was quantified by PMP pre-column derivatization.The morphology and structure of GDNPs were well observed under transmission electron microscopy. 2.46 × 1011particles of GDNPs contained 4.31 mg of protein, 4.46 mg of polysaccharides, and 1.22 mg of saponins. qRT-PCR and flow cytometry experiments showed that the polysaccharide group of GDNPs reversed the phenotype of the M2-type macrophage cells, which were polarized toward M1. GDNPs polysaccharides induced macrophage polarization after CM significantly inhibited the viability of B16F10 cells. PMP pre-column derivatization analysis of the polysaccharide components of GDNPs consisted of glucose, galactose, arabinose, and the substance amount ratio was 4.72∶1.07∶2.15.The experimental results reveal the key role of the polysaccharide components of GDNPs in the modulation of the tumor immune microenvironment, and provide the experimental basis for further mechanism study and clinical application.
ginseng extracellular vesicles; tumor immune microenvironment; macrophage polarization; polysaccharides; glucose; galactose; arabinose
R285.5
A
0253 - 2670(2024)09 - 3006 - 09
10.7501/j.issn.0253-2670.2024.09.015
2023-10-18
国家自然科学基金青年基金项目(81803391)
肖莲莲,硕士研究生,研究方向为中药制药技术与产品开发。E-mail: 20210939@njucm.edu.cn
通信作者:程建明,研究员,博士生导师,主要从事中药新剂型、新技术研究及其产品开发。E-mail: 320320@njucm.edu.cn
[责任编辑 李亚楠]
