葱白提取物通过PPARγ/HO-1途径对动脉粥样硬化大鼠血脂异常和炎症反应的调节作用
2024-05-13范鸿儒易春峰贺立群
范鸿儒,王 栋,张 帆,杨 力,易春峰,贺立群
湖北省武汉市第一医院/武汉市中西医结合医院心血管内科,湖北武汉 430022
动脉粥样硬化(AS)是众多心血管疾病的病理基础,表现为慢性血管炎症性疾病,其过程涉及动脉内壁巨噬细胞富集脂质,血管平滑肌细胞与纤维基质增生,导致内膜局部不对称增厚,终形成阻碍血流的斑块。这些斑块的形成与破裂可能引起血管狭窄、器官缺血乃至梗死,并可能触发血栓生成[1-2]。目前,AS的治疗主要依靠他汀类药物、抗血栓药物和手术干预,但是药物不良反应和手术并发症的存在使得AS的临床治疗效果达不到预期[3]。因此,发掘新的治疗方法对于改善AS患者的预后至关重要。过氧化物酶体增殖物激活受体γ(PPARγ)是一类核受体,调控糖脂代谢和炎症反应,对抗AS的发展发挥着重要作用[4]。血红素氧合酶1(HO-1)是一种抗氧化应激酶,也是PPARγ的下游效应之一,其上调可保护血管免受氧化损伤,减少动脉粥样硬化斑块的形成[5]。葱白提取物(FOB)含有丰富的活性成分,已知具有抗炎、抗氧化、抗血小板聚集等多种生物活性[6-8],提示了它在心血管疾病中潜在的治疗价值。相关研究报道,FOB具有抗AS的作用[9],但FOB干预AS的作用机制尚未完全明确。鉴于FOB在抗炎和调节血脂等方面的潜力,笔者推测FOB可能通过激活PPARγ/HO-1途径来发挥作用。因此,本研究探讨FOB对AS大鼠模型血脂异常和炎症反应的调节作用,以及PPARγ/HO-1途径在其中的潜在机制,为开发新型AS治疗策略提供理论基础。现报道如下。
1 材料与方法
1.1实验动物 SPF级雄性SD大鼠40只,体质量180~220 g,6~8周龄,购自北京天诚医药科技有限公司[动物生产许可证号:SYXK(京)2021-0066]。本研究通过本院动物伦理委员会审批(批号:2022-0603)。大鼠自由饮水进食,饲养于湿度50%~60%、温度18~24 ℃、12 h光暗交替的动物房。
1.2主要试剂与仪器 FOB(纯度:98 %,规格:10 mg)购自深圳卓越生物医药科技公司;PPARγ抑制剂GW9662(纯度:98 %,规格:10 mg)购自武汉科斯坦生物科技公司;总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)检测试剂盒均购自上海齐源生物科技公司;白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)的酶联免疫吸附试验(ELISA)试剂盒、油红O染色试剂盒、苏木精-伊红(HE)染色试剂盒均购自上海联迈生物工程公司;Trizol试剂、反转录试剂盒和实时定量聚合酶链反应(qRT-PCR)试剂盒均购自北京百奥莱博科技公司;兔抗PPARγ、HO-1、甘油醛-3-磷酸脱氢酶(GAPDH)抗体以及辣根过氧化物酶(HRP)标记的羊抗兔IgG二抗均购自上海钰博生物科技公司。
XSP-GX14C荧光显微镜购自上海光学仪器六厂;DT-380全自动生化分析仪购自盛世东唐江苏生物科技公司;LD-96A多功能酶标仪购自山东莱恩德智能科技公司;YT-PCR1荧光定量PCR检测仪购自山东云唐智能科技公司;6400 Advanced电泳仪购自深圳市净康科技公司;KETA GL全自动凝胶成像分析系统购自北京好亿科技发展公司。
1.3方法
1.3.1动物模型构建 大鼠适应环境后,参照文献[10]的方法,给予高脂饲料持续喂养10周,喂养1周后腹腔注射60万U/kg维生素D3溶液(注射1次),光学显微镜下观察大鼠主动脉组织上有粥样斑块形成,血管壁和内膜明显增厚,表明AS大鼠模型构建成功。
1.3.2动物分组及给药 40只大鼠随机分为对照组、模型组(AS组)、FOB组和FOB+GW9662组,每组10只。对照组大鼠给予正常饲料喂养,其余各组大鼠均建立AS模型。参考文献[11]并结合预实验结果确定给药剂量,FOB组大鼠灌胃600 mg/kg的FOB溶液;FOB+GW9662组大鼠灌胃600 mg/kg的FOB溶液,并尾静脉注射1 mg/kg的GW9662;AS组和对照组大鼠均灌胃等剂量生理盐水。每天1次,连续给药8周。
1.3.3标本采集 末次给药结束后,采用3%戊巴比妥钠麻醉大鼠,采集大鼠腹主动脉血液,用TD5A台式低速离心机(湖南凯达科学仪器有限公司)在4 ℃以3 500 r/m离心10 min后,收集血清,—80 ℃保存备用。麻醉处死大鼠,分离大鼠胸主动脉组织,清洗后取根部主动脉制作冷冻切片,其余主动脉组织保存于—80 ℃条件下备用。
1.3.4大鼠主动脉病理形态学评估 取大鼠主动脉冷冻切片,根据试剂盒说明书分别行油红O染色、HE染色实验。显微镜下观察大鼠胸主动脉血管壁上脂质斑块面积以及血管壁情况。
1.3.5大鼠血脂水平检测 取大鼠血清,严格按照试剂盒说明书测定血清中TC、TG、HDL-C、LDL-C的水平。计算动脉粥样硬化指数(AI),AI=(TC-HDL-C)/HDL-C。
1.3.6大鼠血清炎症因子水平检测 取大鼠血清,严格按照ELISA试剂盒说明书操作检测血清中TNF-α、IL-6、IL-1β水平。
1.3.7qRT-PCR法检测大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平 以Trizol试剂抽提大鼠胸主动脉组织总RNA,定量RNA浓度后,严格按照反转录试剂盒和qRT-PCR试剂盒说明书操作,反转录合成cDNA,以GAPDH为内参,进行qRT-PCR扩增实验。PPARγ正向引物序列:5′-ACAGACCTCAGGCAGATCGT-3′,反向引物序列:5′-GGGTGAAGGCTCATGTCTGT-3′;HO-1正向引物序列:5′-GGAACGTGTGCAGGTTGGAT-3′,反向引物序列:5′-TCTCCAGCAGTGCCATCTCT-3′;GAPDH正向引物序列:5′-GATCATTGCTCCTCCTGAGC-3′,反向引物序列:5′-ACATCTGCTGGAAGGTGGAC-3′。反应程序:95 ℃ 30 s,95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。采用2-ΔΔCt法分析数据。
1.3.8Western blot法检测大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平 将大鼠胸主动脉组织用RIPA缓冲液裂解提取总蛋白质,使用BCA试剂盒对提取物中蛋白质的水平进行定量。取等量的蛋白质进行SDS-PAGE分离,转移至聚偏氟乙烯(PVDF)膜上,PVDF膜在5%脱脂奶粉中封闭2 h,然后用一级抗体PPARγ(1∶500)、HO-1(1∶1 000)、GAPDH(1∶1 000)在4 ℃条件下孵育膜过夜,清洗膜,加入HRP标记的对应二抗(1∶5 000)室温孵育2 h,ECL试剂显色,凝胶成像仪采集图像,进行定量分析。

2 结 果
2.1各组大鼠胸主动脉组织病理变化及脂质沉积情况 对照组大鼠胸主动脉管壁结构清晰,内膜光滑、形态正常,无脂质沉积;AS组大鼠胸主动脉管壁明显增厚,内皮细胞脱落结构不完整,内膜下可见大量炎症细胞浸润和泡沫细胞堆积,脂质斑块形成;FOB组大鼠胸主动脉管壁增厚有所减轻,内皮细胞较为完整,内膜下存在少量炎症细胞浸润和泡沫样细胞聚集,脂质斑块变小,大鼠胸主动脉组织病理变化较AS组明显改善;FOB+GW9662组大鼠胸主动脉组织病理变化和脂质斑块较FOB组明显加重。见图1、图2。

注:A为对照组;B为AS组;C为FOB组;D为FOB+GW9662组。
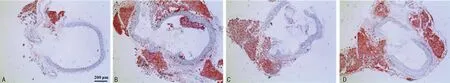
注:A为对照组;B为AS组;C为FOB组;D为FOB+GW9662组。
2.2各组大鼠血脂水平及AI比较 与对照组相比,AS组大鼠血清TC、TG、LDL-C水平以及AI均显著升高,HDL-C水平显著降低,差异均有统计学意义(P<0.05);与AS组相比,FOB组大鼠血清TC、TG、LDL-C水平以及AI均显著降低,HDL-C水平显著升高,差异均有统计学意义(P<0.05);与FOB组相比,FOB+GW9662组大鼠血清TC、TG、LDL-C水平以及AI均显著升高,HDL-C水平显著降低,差异均有统计学意义(P<0.05)。见表1。

表1 各组大鼠血脂水平及AI比较
2.3各组大鼠血清炎症因子水平比较 与对照组相比,AS组大鼠血清IL-6、IL-1β、TNF-α水平均显著升高(P<0.05);与AS组相比,FOB组大鼠血清IL-6、IL-1β、TNF-α水平均显著降低(P<0.05);与FOB组相比,FOB+GW9662组大鼠血清IL-6、IL-1β、TNF-α水平均显著升高(P<0.05)。见表2。

表2 各组大鼠血清炎症因子水平比较
2.4各组大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平比较 与对照组相比,AS组大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平均显著降低(P<0.05);与AS组相比,FOB组大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平均显著升高(P<0.05);与FOB组相比,FOB+GW9662组大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平均显著降低(P<0.05)。见表3。

表3 各组大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平比较
2.5各组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平比较 与对照组相比,AS组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平均显著降低(P<0.05);与AS组相比,FOB组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平均显著升高(P<0.05);与FOB组相比,FOB+GW9662组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平均显著降低(P<0.05)。见图3、表4。

表4 各组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达水平比较

图3 各组大鼠胸主动脉组织中PPARγ和HO-1的蛋白表达电泳图
3 讨 论
AS作为一种血管炎症疾病,在老年人中尤其普遍,对老年人生活质量产生了严重不良影响。目前AS治疗主要集中在中晚期,以抗血小板聚集、调节脂质代谢、控制血压和血糖等综合治疗为主[12]。然而,预防AS进展比改善疾病预后更有意义。FOB在中医中被广泛用于发汗解表、通阳利窍、温中行气和解毒消肿,临床上常与其他药物配伍,治疗风寒感冒、鼻塞、麻疹、消化不良和疮疡等多种疾病,同样也具有抗炎抗氧化的功能[13]。FOB含有多种生物活性成分,这些成分被广泛研究,因其在抗炎中展示的潜在益处而受到关注。例如,FOB主要成分硫化物具有减少炎症细胞浸润的功能,可以对抗病毒引起的免疫过度激活[14]。研究表明,FOB在治疗心肌缺血引起的心肌微血管内皮细胞结构形态和功能变化、心肌梗死后心肌细胞凋亡以及纤维化中均表现出潜在的益处[15-17]。亦有研究证明FOB可以抑制AS进展[18]。本研究在既往研究基础上分析FOB抗AS的作用机制,通过建立AS大鼠模型,观察大鼠胸主动脉组织形态学,结果显示,AS大鼠胸主动脉管壁明显增厚,存在炎症细胞浸润和脂质堆积,斑块形成。该结果与人类AS的病理结果一致,表明AS大鼠模型建立成功。
脂质代谢异常是AS的危险因素和主要特征,血清中的胆固醇可通过受损的血管内皮渗入到动脉壁,进而在动脉内膜积聚形成脂质斑块[19]。异常脂质谱的特征通常是血液TC、TG、LDL-C水平升高和HDL-C水平降低。冯云霞等[20]研究报道,FOB可以明显降低高脂血症大鼠血清TG、LDL-C水平,升高血清HDL-C水平。本研究中,与对照组相比,AS大鼠血清TC、TG、LDL-C水平以及AI均显著升高,HDL-C水平显著降低;FOB干预有效降低了AS大鼠血清TC、TG、LDL-C水平以及AI,有效升高了HDL-C水平。表明FOB能够通过调控血脂水平减轻大鼠AS。炎症存在于整个AS过程中,是AS发展的关键因素。白细胞(主要是巨噬细胞)的积累是AS从开始到晚期的突出特征。巨噬细胞中的脂质积累诱发炎症,炎症促进和增强AS的发展,炎症和AS病变的发展形成正反馈回路。因此,抗炎治疗是延缓AS斑块发展并稳定晚期病变的有效途径之一[21]。研究数据显示,AS中炎症反应表现为TNF-α、IL-1β、IL-6以及黏附分子水平异常升高[22]。本研究结果发现,与对照组相比,AS大鼠血清IL-6、IL-1β、TNF-α水平均明显升高,FOB干预降低了AS大鼠血清IL-6、IL-1β、TNF-α水平。提示FOB在AS中通过调控炎症因子表达发挥抗炎作用。
PPARγ是核激素受体超家族的成员之一,该超家族被认为在各种病理条件下介导许多信号通路[23]。在被特异性配体激活后,PPARγ被易位以进一步激活PPAR应答元件以启动靶基因转录,PPARγ的激活被认为对细胞凋亡和炎症反应都有保护作用[24]。HO-1是一种应激响应蛋白,可将促氧化血红素降解为游离铁、胆绿素(胆红素)和一氧化碳,HO-1通过这些酶促反应发挥其各种生物活性[25]。鹰嘴豆芽素A通过激活PPARγ/HO-1途径抑制脂质积累和炎症反应来预防AS[26]。夏雯等[27]报道,FOB能够促进AS大鼠胸主动脉中PPARγ蛋白表达。本研究在此基础上探究PPARγ/HO-1信号通路是否参与FOB抗AS过程,结果显示,FOB干预后,AS大鼠胸主动脉组织中PPARγ和HO-1的mRNA表达水平以及PPARγ和HO-1的蛋白表达水平均升高。提示FOB干预提高了AS大鼠胸主动脉组织中PPARγ和HO-1的mRNA以及蛋白表达水平。本研究进一步应用PPARγ抑制剂GW9662发现,GW9662干预逆转了FOB对AS大鼠胸主动脉组织中PPARγ和HO-1表达的促进作用,同时,GW9662干预减弱了FOB对AS大鼠血脂水平和炎症反应的调控作用。上述结果表明FOB可能通过激活PPARγ/HO-1信号通路对AS发挥治疗作用。
综上所述,FOB能够通过调节血脂异常和抑制炎症反应缓解高脂饮食诱导的AS,其作用机制可能与激活PPARγ/HO-1信号通路有关。本研究在以往研究基础上进一步证实FOB是治疗AS的潜在候选药物,但其具体作用剂量及潜在作用机制仍需开展大量实验研究来明确。