基于TCGA数据集分析LINC00900在甲状腺乳头状癌中的表达及临床意义
2024-05-13郭陈刚逯素梅马万山
黎 春,郭陈刚,逯素梅,马万山△
1.山东大学山东省千佛山医院检验部,山东济南 250000;2.山东省德州市中西医结合医院检验科,山东德州 253000;3.德州学院生物物理研究所/生物物理重点实验室,山东德州 253000
近30年来,甲状腺癌的发病率明显上升,其最常见的病理组织类型为甲状腺乳头状癌(PTC),占90%左右[1]。PTC又可分为多种病理亚型,常见的有经典型、高细胞亚型、滤泡亚型等,不同病理亚型的预后不同,相对于经典型和滤泡型,高细胞亚型的预后更差。大部分PTC患者可以通过手术或放射碘治愈,预后良好,但有10%左右的患者发展为预后不良的甲状腺癌或出现疾病复发[1-2]。目前,临床对于甲状腺癌手术的范围仍存在争议,对患者预后进行有效评估,有助于在降低手术风险和提高患者预后之间找到平衡点。有研究证实,包括TNM分期系统在内的甲状腺癌分期指标及预后评估方法的预测效果欠佳[1-3]。因此,临床上迫切需要寻找新的分子生物标志物,用于PTC患者预后风险评估,推进PTC患者的个体化治疗和预后管理。
作为肿瘤相关研究热点之一的长链非编码RNA (lncRNA) 广泛存在于真核生物的各个组织器官中,参与分化过程中基因的动态表达,在表观遗传、转录及转录后阶段参与调控[4]。LINC00900是一种lncRNA,据报道,LINC00900在胶质瘤、前列腺癌、食管癌等多种癌症中异常表达,其表达与肿瘤细胞的增殖、侵袭和转移相关并影响预后,此外LINC00900还在肿瘤细胞中调节基因的表达,进一步影响肿瘤相关信号通路的活化[5-10]。然而,关于LINC00900在PTC中的具体作用和相互联系,目前研究甚少。故本研究利用美国癌症基因组图谱(TCGA)数据库,研究LINC00900在PTC中的表达及对预后生存的影响,了解其调控网格,同时为研究其在影响相关肿瘤进展和预后方面提供新的见解。现报道如下。
1 资料与方法
1.1临床资料获取 从TCGA数据库(https://cancergenome.nih.gov/)下载PTC的表达谱数据及每个病例相匹配的临床数据,共获得498例PTC患者,其中包含58对配对的PTC癌组织及癌旁正常甲状腺组织标本;<55岁332例,≥55岁166例;女364例,男134例;肿瘤最大径<4 cm 124例,≥4 cm 275例,未知大小99例;远处转移15例,未转移483例;病理分期:Ⅰ~Ⅱ期333例,Ⅲ~Ⅳ期165例;组织学类型:经典型355例,滤泡型101例,高细胞亚型35例,其他7例;出现新生肿瘤44例,未出现454例;有肿瘤残余50例,无残余437例,未知11例;远处淋巴结转移20例,无远处淋巴结转移478例;临床病理分期中N分期:N0期225例,N1期58例,N1a期90例,N1b期75例,Nx期50例;M分期:M0期279例,M1期10例,Mx期209例;T分期:T1期43例,T1a期19例,T1b期80例,T2期163例,T3期168例,T4期9例,T4a期14例,Tx期2例。
1.2LINC00900表达水平与临床病理特征相关性分析 按LINC00900表达水平的中位数,将PTC患者分成高表达组和低表达组,每组249例。采用卡方检验分析LINC00900表达与临床特征的关系。
1.3LINC00900表达对生存率的影响 498例PTC患者均随访5年。使用R语言的survival软件包进行生存分析,评估LINC00900表达对PTC患者生存率的影响。
1.4与LINC00900表达相关的蛋白编码基因(PCGs)的基因功能富集分析 通过加权基因共表达网络分析(WGCNA)预测与LINC00900相关的PCGs,选择相关系数(r)>0.5、P<0.05的PCGs进行基因注释。利用注释、可视化和集成发现数据库(DAVID)在线注释工具对筛选出的PCGs进行基因本体论(GO)分析和KEGG通路分析。笔者选择了以下注释:生物过程、细胞组分、分子功能和KEGG通路。

2 结 果
2.1LINC00900表达水平分析 58对配对的PTC癌组织及癌旁正常甲状腺组织的检测结果显示,LINC00900在PTC癌组织中的表达水平(3.21±2.28)显著高于癌旁正常甲状腺组织(1.73±0.72),差异有统计学意义(P<0.001),见图1A。498例PTC癌组织和58例癌旁正常甲状腺组织的检测结果显示,LINC00900在PTC癌组织中的表达水平(3.49±2.21)显著高于癌旁正常甲状腺组织(1.73±0.72),差异有统计学意义(P<0.001),见图1B。

注:A为58例配对的PTC癌组织及癌旁正常甲状腺组织中LINC00900的表达;B为498例PTC癌组织和58例癌旁正常甲状腺组织中LINC00900的表达;*P<0.001。
2.2LINC00900表达水平不同临床病理特征LINC00900表达水平比较 TCGA数据集分析结果显示,不同年龄、病理T分期、组织学类型的PTC患者LINC00900表达水平比较,差异均有统计学意义(P<0.05)。见表1。
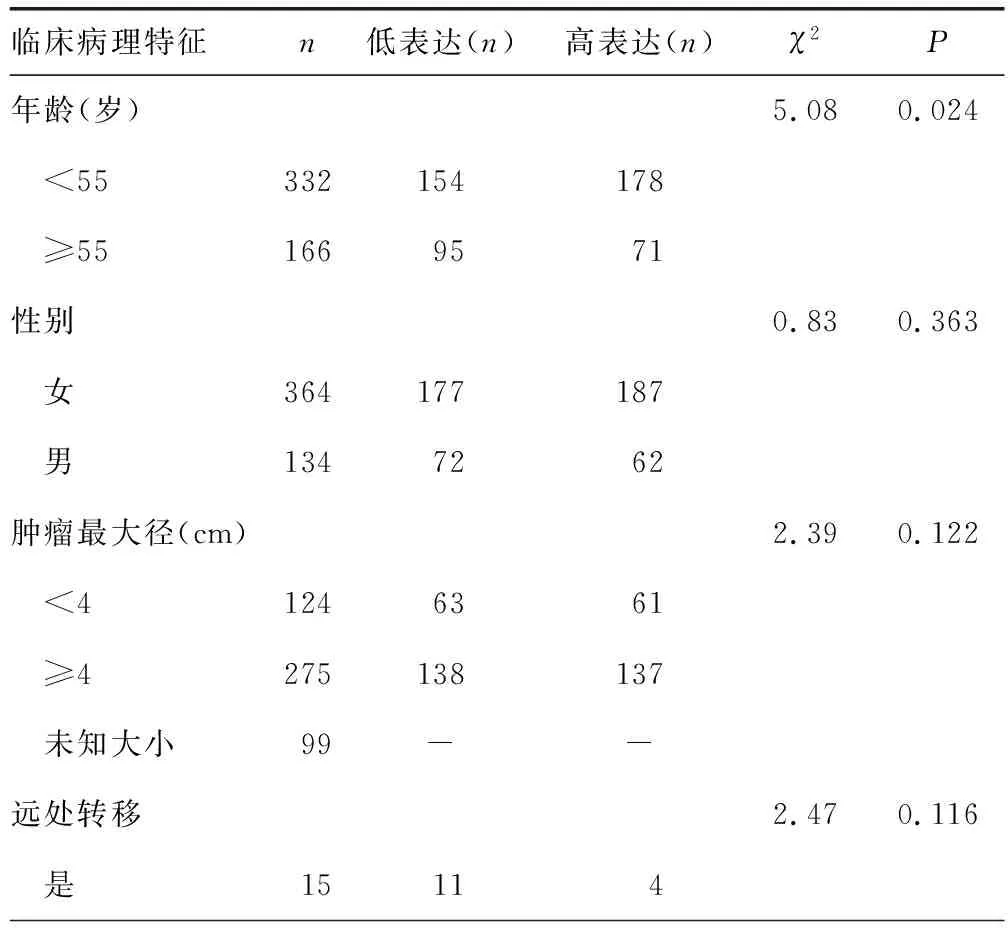
表1 不同临床病理特征的PTC患者LINC00900水平比较
2.3不同年龄PTC患者的LINC00900表达水平比较 ≥55岁PTC患者的LINC00900表达水平(3.18±2.13)明显低于<55岁患者(3.64±2.23),差异有统计学意义(P<0.01)。见图2。
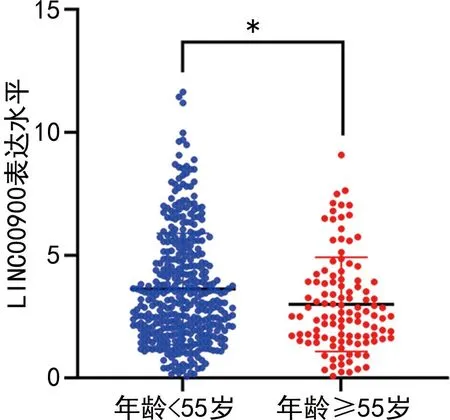
注:*P<0.001。
2.4不同病理T分期PTC患者LINC00900表达水平比较 T分期中,T3~T4期PTC患者的LINC00900表达水平(3.12±2.23)明显低于T1~T2期患者(4.21±2.35),差异有统计学意义(P<0.001)。见图3。
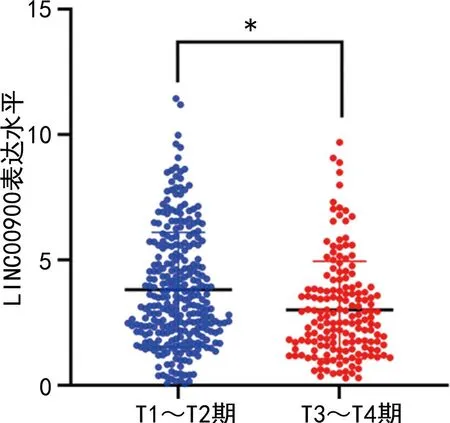
注:*P<0.001。
2.5不同组织学类型PTC患者LINC00900表达水平比较 高细胞亚型PTC患者LINC00900表达水平低于经典型、滤泡型和其他型,差异均有统计学意义(P<0.01)。见图4。

图4 LINC00900在PTC的不同病理亚型中差异表达
2.6LINC00900表达与PTC患者生存率的关系 随访5年,498例PTC患者中死亡16例,生存482例,总生存率(OS)为96.79%。Kaplan-Meier生存曲线结果显示,LINC00900高表达PTC患者的OS[98.80%(246/249)]高于LINC00900低表达患者[90.76%(13/249)],差异有统计学意义(Log-rankχ2=6.691,P<0.05)。见图5。

图5 不同LINC00900表达水平的PTC患者生存曲线的比较
2.7与LINC00900表达相关的PCGs的功能富集分析 功能富集分析结果显示,在核小体装配、mRNA的剪接、组蛋白H3甲基化的修饰、染色体绑定、组蛋白乙酰转移酶调节因子活性调节、鞘氨醇-1-磷酸磷酸酶活性调节、黏蛋白型O-聚糖生物合成等途径在相关的PCGs出现不同程度的富集。见图6。
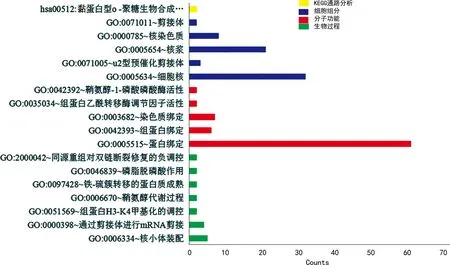
图6 与LINC00900表达相关的基因的功能富集分析结果
3 讨 论
甲状腺癌是最常见的内分泌肿瘤,其中最常见的病理类型是PTC,近年来PTC发病率迅速上升。绝大部分PTC预后良好,但仍有一小部分显示出难治性或者出现转移和复发。因此,当下研究的热点应该是如何对PTC患者进行风险分层及预后评估。据报道,lncRNA可经过调节肿瘤血管内皮细胞的生成、增殖等影响肿瘤的发生及发展[5]。lncRNA在甲状腺癌组织癌旁正常组织以及肿瘤不同进展阶段的差异性表达研究有助于甲状腺癌的诊断和预后预测。部分表达差异的lncRNA与PTC患者临床病理特征之间存在一定的相关性。研究显示,在甲状腺癌中lncRNA可通过促进或者抑制肿瘤细胞的增殖、侵袭和迁移、肿瘤细胞的自噬、凋亡及上皮间充质转化(EMT)等途径调控甲状腺癌的进展[6]。
LIU等[7]研究报道,LINC00900在多种人类恶性肿瘤中异常表达,并与预后相关,且LINC00900作为Toll样受体(TLR)相关的lncRNA,是食管癌的风险因子。在胶质瘤中LINC00900是EMT和N6-甲基腺苷甲基化(m6A)及坏死相关的lncRNA,其表达水平随肿瘤分级的增加而升高,与肿瘤的恶性程度呈正相关,对胶质瘤具有良好的预后评估价值[8-10]。然而,在前列腺癌中,LINC00900在癌组织中高表达,生存分析显示高表达患者生存率较高,是前列腺癌的保护性因子[11]。在甲状腺癌中,LINC00900也被报道是自噬相关的lncRNA,被筛选出作为判断预后的指标之一[12-16]。因此笔者推断LINC00900在肿瘤中的作用可能是双重的,既可作为抑癌因子也可成为促癌因子,这取决于特定的组织及癌症进展的特定阶段。影响甲状腺癌预后主要因素有病理组织学类型、肿瘤大小、是否淋巴结转移、是否远处转移、癌基因、年龄、性别、治疗相关因素、肿瘤分期等[17-18]。患者年龄一直是PTC临床分期和评估预后的重要指标之一。相对于<55岁的患者,≥55岁的PTC患者肿瘤侵袭性增强、肿瘤增大及肿瘤切除不完整等风险增加,且生存时间更短[19-20]。本研究结果显示,LINC00900在PTC癌组织中的表达水平高于癌旁正常甲状腺组织(P<0.05);TCGA数据集分析结果显示,不同年龄、病理T分期、组织学类型的PTC患者LINC00900表达水平比较,差异均有统计学意义(P<0.05),而这些临床特征均是影响PTC预后的关键因素,提示LINC00900表达水平可作为判断PTC预后的指标之一。
本研究结果显示,≥55岁的PTC患者LINC00900表达水平明显低于<55岁患者(P<0.01),病理分期T3~T4期PTC患者的LINC00900表达水平明显低于T1~T2期(P<0.001);高细胞亚型PTC患者LINC00900表达水平低于经典型、滤泡型和其他型(P<0.01)。据研究报道,高年龄和高病理T分期的PTC患者预后相对于低年龄组和低T分期的患者较差,高细胞亚型PTC相对于另外经典型和滤泡型PTC具有更强的侵袭性和较高的淋巴结转移率、复发率,患者预后相对较差[21-23]。这与本研究结果一致。本研究生存分析结果显示,LINC00900高表达组PTC患者的生存率明显长于低表达组。以上结果均提示LINC00900可能是PTC患者的保护性预后相关因子。
为了进一步探讨LINC00900在PTC发生、发展中的可能机制,基于LINC00900的表达数据,对与其表达相关的蛋白编码基因进行功能富集分析。GO分析显示,相关的PCGs参与的生物进程主要包括核小体装配、进行mRNA的剪接、组蛋白H3甲基化的修饰、鞘氨醇代谢、铁-硫簇转移的蛋白质成熟、去磷酸化等;执行的分子功能主要包括调节蛋白结合,组蛋白结合及染色体绑定,组蛋白乙酰转移酶调节因子活性调节,鞘氨醇-1-磷酸磷酸酶活性调节;参与了细胞核中染色质、剪接体等细胞组分。KEGG通路分析显示,相关的PCGs富集在黏蛋白型O-聚糖生物合成通路。其中鞘氨醇-1-磷酸(S1P)是高等生物中高度保守的活性鞘脂类代谢物,调节多种细胞过程,S1P信号异常会导致包括癌症在内的多种疾病发生[24]。组蛋白修饰失衡可导致肿瘤发生、发展,且组蛋白H3甲基化的丧失已被证实是肿瘤细胞的标志物[25]。在肿瘤中常伴随着黏蛋白型O-聚糖结构和数量上的改变,形成肿瘤特异聚糖结构。肿瘤特异聚糖使肿瘤细胞的抗原性和黏附能力发生改变,促进肿瘤细胞的恶性增生与转移[26]。而目前对于以上通路在PTC中的表达研究甚少,故本研究的基因功能富集结果提示LINC00900可能通过以上通路介导肿瘤的发生、发展,并影响预后,为进一步探索LINC00900影响PTC预后的可能机制提供新的线索。
综上所述,LINC00900表达水平与PTC患者年龄、病理学T分期、组织学类型有关。在PTC中,LINC00900高表达是一种预后保护因素,可作为辅助判断PTC预后的有效生物标志物之一。