山姜素调节VEGF/SphK1/S1P信号通路对膝骨关节炎大鼠血管生成的影响
2024-05-13罗锟王智王柯
罗锟 王智 王柯

基金項目:武汉市中医药科研项目(WZ22C62)
作者单位:武汉市中医医院骨伤科(邮编430014)
作者简介:罗锟(1984),男,主治医师,主要从事中医骨伤方面研究。E-mail:350644108@qq.com
△通信作者 E-mail:826969050@qq.com
摘要:目的 探讨山姜素(APT)调节血管内皮生长因子/鞘氨醇激酶1/1磷酸鞘氨醇(VEGF/SphK1/S1P)信号通路对膝骨关节炎(KOA)大鼠血管生成的影响。方法 采用改良的Videman法构建KOA大鼠模型,将90只大鼠分为对照组(Control组)、模型组(Model组)、山姜素低剂量组(L-APT组)、山姜素高剂量组(H-APT组)、山姜素高剂量组+慢病毒阴性对照组(APT+NC组)、山姜素高剂量组+过表达SphK1慢病毒组(APT+SphK1组),每组15只。HE染色观察大鼠软骨组织病理变化;酶联免疫吸附试验测定软骨组织白细胞介素(IL)-1β、肿瘤坏死因子α(TNF-α)、IL-6、基质金属蛋白酶-13(MMP-13)水平;TUNEL检测软骨组织细胞凋亡情况;免疫组化检测血管内皮生长因子(VEGF)、CD31蛋白表达情况;Western blot检测血管内皮生长因子受体2(VEGFR2)、磷酸化VEGFR2(p-VEGFR2)、SphK1、S1P蛋白水平。结果 与Control组比较,Model组大鼠出现病理损伤,细胞凋亡率、IL-1β、TNF-α、IL-6、MMP-13、VEGF阳性表达、CD31阳性表达和p-VEGFR2、SphK1、S1P蛋白表达水平增加(P<0.05);与Model组比较,L-APT组、H-APT组病理损伤明显减轻,细胞凋亡率、IL-1β、TNF-α、IL-6、MMP-13、VEGF阳性表达、CD31阳性表达和p-VEGFR2、SphK1、S1P蛋白表达水平降低(P<0.05);与APT+NC组比较,APT+SphK1组软骨组织病理损伤加重,细胞凋亡率、IL-1β、TNF-α、IL-6、MMP-13、VEGF阳性表达、CD31阳性表达和p-VEGFR2、SphK1、S1P蛋白表达水平增加(P<0.05)。结论 APT通过抑制VEGF/SphK1/S1P信号通路抑制KOA大鼠血管生成。
关键词:骨关节炎,膝;新生血管化,病理性;血管内皮生长因子类;山姜素;鞘氨醇激酶1;1磷酸鞘氨醇
中图分类号:R684.3文献标志码:ADOI:10.11958/20230892
Impacts of alpinetin on angiogenesis in knee osteoarthritis rats by regulating the
VEGF/SphK1/S1P signaling pathway
LUO Kun, WANG Zhi, WANG Ke△
Department of Orthopedics and Traumatology, Wuhan Hospital of Traditional Chinese Medicine, Wuhan 430014, China
△Corresponding Author E-mail: 826969050@qq.com
Abstract: Objective To investigate effects of alpinetin (APT) on angiogenesis in knee osteoarthritis (KOA) rats by regulating vascular endothelial growth factor/sphingosine kinase 1/sphingosine 1 phosphate (VEGF/SphK1/S1P) signaling pathway. Methods The KOA rat model was established by Videman method. Ninety rats were grouped into the control group, the model group, the low-dose kaempferol group (L-APT group), the high-dose kaempferol group (H-APT group), the high-dose kaempferol group+lentivirus negative control group (APT+NC group) and high-dose kaempferol+overexpression of SphK1 lentivirus group (APT+SphK1 group), with 15 rats in each group. Pathological changes of cartilage tissue in rats were observed by HE staining. Contents of IL-1β, TNF-α, IL-6 and MMP-13 in cartilage tissue were measured by enzyme linked immunosorbent assay. Chondrocyte apoptosis of cartilage tissue cells was detected by TUNEL. VEGF and CD31 protein positive expression levels were detected by immunohistochemistry assay. The p-VEGFR2, VEGFR2, SphK1 and S1P protein levels were detected by Western blot assay. Results Rats in the model group showed pathological damage. Compared with the control group, the apoptosis rate, IL-1b, TNF-a, IL-6, MMP-13 levels, VEGF positive expression, CD31 positive expression, p-VEGFR2, SphK1 and S1P protein expression levels were increased in the model group (P<0.05). Compared with the model group, the pathological damage was obviously reduced in the L-APT group and the M-APT group, and cell apoptosis rate, IL-1β, TNF-α, IL-6, MMP-13 levels, VEGF positive expression, CD31 positive expression, p-VEGFR2, SphK1 and S1P protein expression levels were obviously reduced (P<0.05). Compared with the APT+NC group, the pathological injury of cartilage tissue increased in the APT+SphK1 group, cell apoptosis rate, IL-1β, TNF-α, IL-6, MMP-13 levels, VEGF positive expression, CD31 positive expression, p-VEGFR2, SphK1 and S1P protein expression levels were obviously increased (P<0.05). Conclusion APT inhibits angiogenesis in knee osteoarthritis rats by inhibiting the VEGF/SphK1/S1P signaling pathway.
Key words: osteoarthritis, knee; neovascularization, pathologic; vascular endothelial growth factors; alpinetin; sphingosine kinase 1; sphingosine 1 phosphate
膝骨关节炎(knee osteoarthritis,KOA)是一种膝关节退行性疾病,以软骨退变为主要病理特征[1]。KOA主要表现为关节疼痛、肿胀、僵硬,伴功能障碍及血管生成因子增多,严重影响患者的生活质量[2]。目前,KOA早期治疗以非甾体类抗炎药为主,但其临床效果不佳,易复发[3]。由于KOA是一种慢性病,需要长期治疗,因此寻找安全有效的药物至关重要。山姜素(APT)是一种天然类黄酮,是传统药用植物草豆蔻的主要活性成分,具有抗肿瘤、抗氧化、抗风湿、镇痛和利胆等作用[4]。研究表明,APT可改善冠心病大鼠血管内皮功能[5]。在四氯化碳(CCl4)诱导的肝纤维化中,APT可通过激活核因子E2相关因子2(nuclear factor erythroid-2-related factor 2,Nrf2)通路和抑制Nod样受体蛋白3(Nod-like receptor pyrin domain3,NLRP3)通路发挥抗炎、抗氧化和抗血管生成作用[6]。APT还可通过减轻骨关节炎的核转录因子κB(nuclear transciption factor kappa B,NF-κB)/胞外信号调控激酶(extracellular signal-regulated kinase,ERK)途径保护软骨细胞并表现出抗炎作用[7]。血管内皮生长因子(vascular endothelial growth factor,VEGF)主要由成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)分泌,在KOA的软骨中大量表达[8]。1磷酸鞘氨醇(sphingosine 1 phosphate,S1P)是体内主要的鞘脂分子,是鞘氨醇激酶1(sphingosine kinase 1,SphK1)活化的产物,具有广泛的生物活性[9]。据报道,VEGF可通过Ser 225磷酸化激活SphK1[10],而抑制VEGF/SphK1/S1P途径能减轻类风湿关节炎中体内和体外血管生成[11]。然而,APT对KOA大鼠抗血管生成的作用是否由VEGF/SphK1/S1P信号通路介导尚不清楚。本研究旨在构建KOA大鼠模型,探讨APT对KOA大鼠血管生成和VEGF/SphK1/S1P信号通路的影响。
1 材料与方法
1.1 主要仪器与试剂 APT(纯度≥98%)购自成都乐美天医药科技有限公司;白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子α(tumor necrosis fctor-alpha,TNF-α)、基质金属蛋白酶-13(matrix metalloproteinase-13,MMP-13)酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒均购自南京建成生物工程研究所;苏木素伊红(hematoxylin eosin,HE)染色试剂盒、原位末端标记(TdT- mediated dUTP nick and labeling,TUNEL)染色试剂盒购自上海碧云天生物技术有限公司;VEGF、血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule,CD31)购自Santa Cruz Biotechnology;兔源抗大鼠血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)、磷酸化VEGFR2(p-VEGFR2)一抗购自英国Abcam公司;兔源抗SphK1、S1P一抗购自上海赛信通生物试剂有限公司。光学显微镜、荧光倒置显微镜(日本Nikon公司),多功能酶标仪(赛默飞世尔科技)。
1.2 实验动物 无特定病原体(SPF)级雄性SD大鼠90只,6~7周龄,体质量(200±20) g,购自华中科技大学同济医学院实验动物中心,动物生产许可证号:SYXK(鄂)2019—0106。所有大鼠在本院动物中心按SPF级标准饲养于温度(22±2)℃、光照/黑暗交替12 h环境(动物使用许可证号:22031524),期间自由饮水和进食。遵循中华人民共和国科学技术部颁行的《关于善待实验动物的指导性意见》处置动物。本研究得到本院伦理委员会的批准(批号:2022-0916)。
1.3 研究方法
1.3.1 KOA大鼠模型建立 将大鼠分为对照(Control)组、模型(Model)組、山姜素低剂量(L-APT)组、山姜素高剂量(H-APT)组、山姜素高剂量组+慢病毒阴性对照(APT+NC)组、山姜素高剂量组+过表达SphK1慢病毒(APT+SphK1)组,每组15只。除Control组外,采用改良的Videman法构建KOA大鼠模型[12],大鼠均造模成功。L-APT组、H-APT组膝关节内分别注射10、20 mmol/L山姜素[7],1次/周,持续3周;APT+NC组膝关节内注射200 mL慢病毒空载体(1×109 TU/mL)和20 mmol/L的APT;APT+SphK1组膝关节内注射200 mL过表达SphK1慢病毒载体(1×109 TU/mL)和20 mmol/L的APT;Control组和Model组常规饲养,不进行任何干预处理。
1.3.2 取材 干预后3周,各组大鼠3%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉并处死,剪断股骨、胫骨1/2处骨干,取大鼠完整左膝关节,除去关节囊外多余软组织后,用4%多聚甲醛固定,制作石蜡切片。
1.3.3 HE染色观察大鼠KOA软骨组织病理变化 各组取出5只大鼠的膝骨关节软骨组织,石蜡包埋,5 μm切片,HE染色,显微镜下观察各软骨组织病理变化。
1.3.4 TUNEL法检测细胞凋亡 取各组5只大鼠的软骨组织,石蜡包埋,5 μm切片,用3% H2O2和蛋白酶K处理后,加入TUNEL试剂,室温下处理1 h,DAB显色,苏木精反染。凋亡阳性细胞为细胞核被染成棕黄色颗粒,随机读取5个视野观察TUNEL阳性细胞;TUNEL阳性细胞(%)=阳性细胞/DAPI个数×100%。
1.3.5 ELISA检测软骨组织中炎性因子表达 参照ELISA试剂盒说明书,测定各组大鼠软骨组织中IL-1β、TNF-α、IL-6、MMP-13水平,酶标仪检测450 nm波长处光密度(OD)值,参照试剂盒说明书做标准曲线并计算各炎性因子表达水平。
1.3.6 免疫组化染色实验检测VEGF和CD31阳性表达 取1.3.3中大鼠软骨组织石蜡切片,经二甲苯脱蜡,乙醇水化后在10 nmol/L柠檬酸缓冲液中热修复10 min,3% H2O2阻断内源性过氧化物酶,加入VEGF(1∶250)、CD31(1∶50)抗体,4 ℃孵育过夜,加入HRP偶联的IgG二抗(1∶1 000),室温孵育2 h后用DAB检测,各组随机读取5个视野,显微镜观察拍照。VEGF和CD31阳性表达为细胞质被染成黄色或棕黄色,Image J 1.8.0软件计算VEGF和CD31阳性表达。阳性表达百分比=目的蛋白阳性表达面积/视野面积×100%。
1.3.7 Western blot检测p-VEGFR2、VEGFR2、SphK1、S1P蛋白表达 从各组软骨组织中提取总蛋白,BCA试剂盒测定蛋白浓度,SDS-PAGE转至PVDF膜上,5%脱脂奶粉阻断2 h,加入一抗p-VEGFR2(1∶1 000)、VEGFR2(1∶1 000)、SphK1(1∶1 000)、S1P(1∶2 000),4 ℃过夜,TBST冲洗,加入HRP偶联的二抗(1∶2 000),室温下静置1.5 h,ECL反应,凝胶成像,以β-actin为内参,Image J软件计算各蛋白相对表达水平。
1.4 统计学方法 采用SPSS 22.0软件进行数据分析。符合正态分布的计量资料以[x] ±s表示,多组间比较采用单因素方差分析,组间多重比较采用LSD-t法。P<0.05为差异有统计学意义。
2 结果
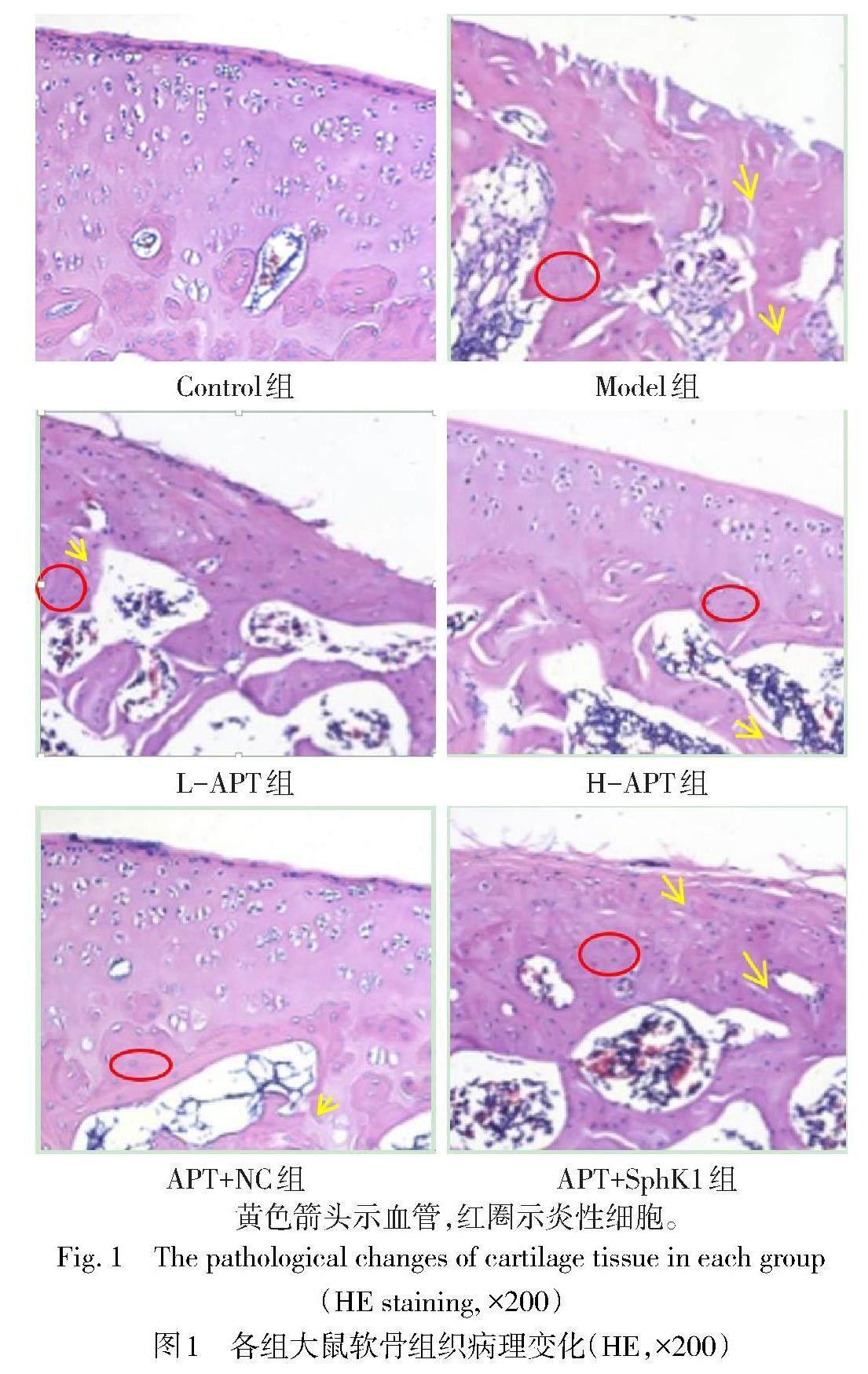
2.1 各组大鼠KOA软骨组织病理变化 Control组大鼠软骨组织结构正常,层次分明,软骨细胞排列整齐;Model组大鼠软骨组织结构被破坏,软骨层变薄且粗糙,软骨细胞排列紊乱,有大量炎性细胞浸润,小血管增多;与Model组比较,L-APT、H-APT组大鼠软骨组织结构相对完整清晰,软骨细胞排列相对整齐,血管生成和炎性细胞浸润明显减少;与APT+NC组比较,APT+SphK1组软骨组织病理损伤加重,见图1。
2.2 各组大鼠软骨细胞凋亡水平比较 Control组、Model组、L-APT组、H-APT组、APT+NC组、APT+SphK1组的软骨细胞凋亡率(%)分别为3.37±0.35、45.10±3.69、36.23±2.33、24.47±1.85、22.60±1.64、32.53±2.12,差异有统计学意义(n=5,F=206.887,P<0.01)。与Control组比较,Model组软骨组织细胞凋亡增加(P<0.05);与Model组比较,L-APT、H-APT组软骨组织细胞凋亡降低,H-APT组降低效果更明显(P<0.05);与APT+NC组比较,APT+SphK1组软骨组织细胞凋亡增加(P<0.05),见图2。
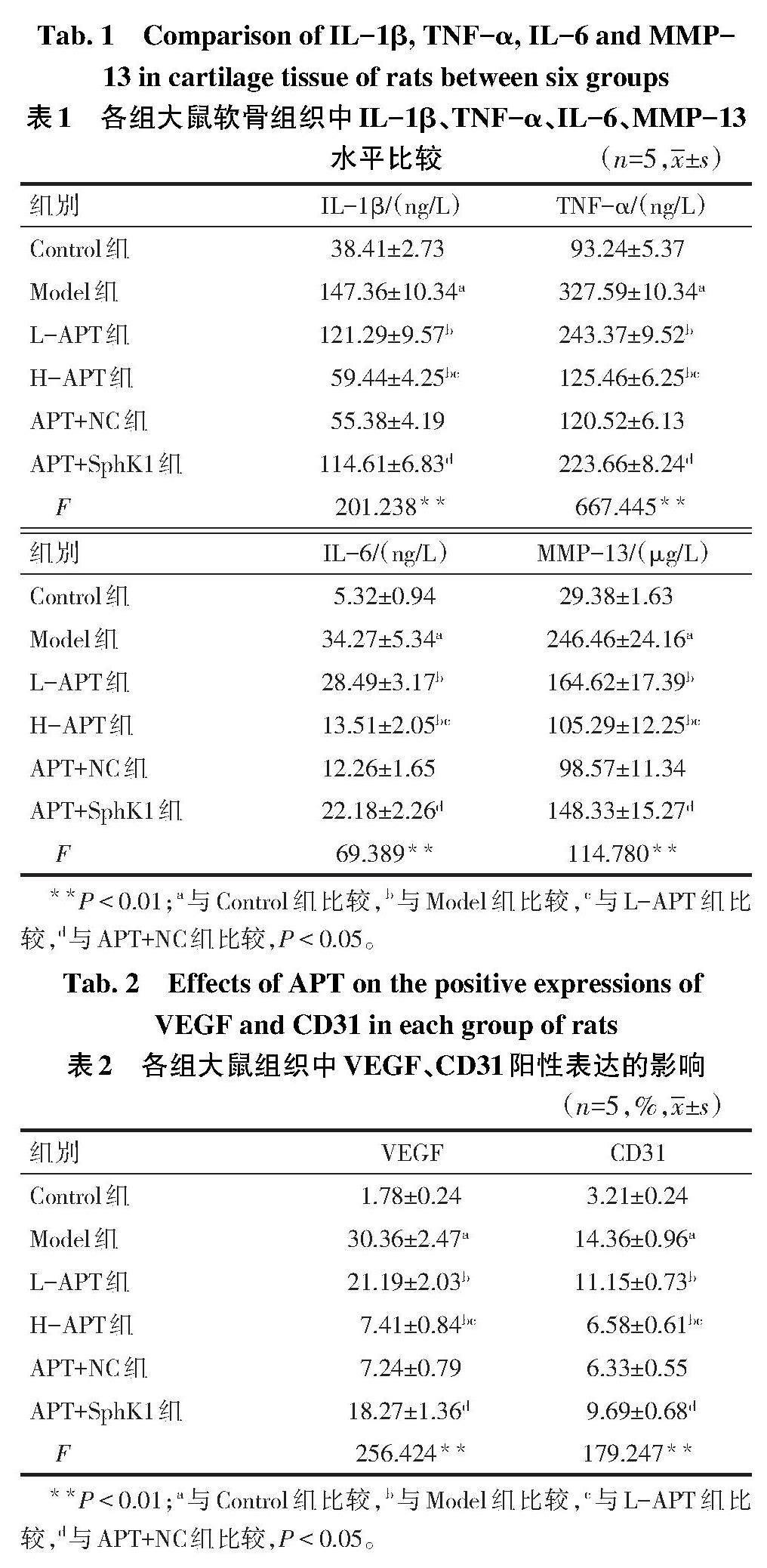
2.3 各组大鼠软骨组织中炎性因子比较 与Control组比较,Model组大鼠软骨组织中IL-1β、TNF-α、IL-6和MMP-13水平增加(P<0.05);与Model组比较,L-APT、H-APT组大鼠IL-1β、TNF-α、IL-6和MMP-13水平降低,H-APT组降低效果更明显(P<0.05);與APT+NC组比较,APT+SphK1组大鼠IL-1β、TNF-α、IL-6和MMP-13水平增加(P<0.05),见表1。
2.4 各组大鼠滑膜组织中VEGF、CD31阳性表达比较 与Control组比较,Model组大鼠VEGF、CD31阳性表达增加(P<0.05);与Model组比较,L-APT、H-APT组大鼠VEGF、CD31阳性表达降低,且H-APT组降低效果更明显(P<0.05);与APT+NC组比较,APT+SphK1组大鼠VEGF、CD31阳性表达增加(P<0.05),见表2、图3。
2.5 各组大鼠软骨组织中相关蛋白表达 与Control组比较,Model组大鼠p-VEGFR2、SphK1、S1P表达水平增加(P<0.05);与Model组比较,L-APT、H-APT组p-VEGFR2、SphK1、S1P表达水平降低,且H-APT组降低效果更明显(P<0.05);与APT+NC组比较,APT+SphK1组p-VEGFR2、SphK1、S1P表达水平增加(P<0.05),见图4、表3。
3 讨论
临床上治疗KOA的方法多以缓解症状、改善关节功能为主,但KOA的发病机制和病因尚不明确,各治疗方案的疗效有限。因此,明确KOA的病理机制对寻找治疗KOA途径具有重要意义。
血管生成是指从原有的血管结构中产生的新血管,在KOA进程中主要表现为滑膜、软骨和软骨下骨病变[13]。相关研究表明,正常软骨中没有血管存在,而发生KOA时,血管生成数明显增多[14]。炎症反应是KOA的病理特征之一,软骨组织中MMP-13的分泌及炎性因子的释放可引起软骨损伤,刺激血管生成,而新生血管又反过来促进炎症发生,抑制KOA大鼠血管生成的同时,可抑制IL-1β、TNF-α、IL-6等炎性因子的释放[15-16]。本研究结果显示,Model组软骨组织中大量炎性细胞浸润和小血管较Control组增多,炎性因子IL-1β、TNF-α、IL-6、MMP-13水平升高,血管因子VEGF、CD31阳性表达增加,提示炎症和血管形成与KOA有关。
APT具有缓解骨关节炎的作用。在LPS诱导的软骨细胞损伤中,APT能减轻软骨細胞炎症损伤,促进软骨细胞增殖[17]。另有研究显示,山姜素可用作类风湿关节炎治疗的候选药物[18]。因而,笔者推测APT有助于缓解KOA。本研究结果亦显示,与Model组比较,L-APT组和H-APT组大鼠软骨组织病理变化明显减轻,软骨组织中IL-1β、TNF-α、IL-6、MMP-13水平和细胞凋亡率明显降低,提示APT可通过抑制软骨组织炎性因子释放和细胞凋亡来缓解KOA。VEGF是血管生成的标志性调节因子。相关研究表明,KOA患者软骨细胞中VEGF高度表达,并与KOA严重程度相关,抑制VEGF表达可延缓KOA进展[19]。此外,VEGFR2是VEGF的受体之一,参与血管生成的整个过程,激活VEGF/VEGFR2可诱导血管内皮细胞的增殖、迁移,以及血管的形成和通透性增加,进而加速关节炎进展[20]。本研究结果表明,APT可抑制促血管生成因子VEGF、CD31阳性表达及p-VEGFR2蛋白表达,提示APT可抑制KOA大鼠血管生成,减轻KOA,在KOA缓解中具有很好的前景。
S1P是一种生物活性鞘脂,具有通过激活细胞表面受体或细胞内介质来传递多种功能的作用,如细胞增殖、迁移、炎性细胞浸润、血管生成和自身免疫[21]。SphK1是体内催化鞘氨醇转化为血管生成因子S1P的关键酶,其表达水平与KOA的发生密切相关[22]。研究表明,抑制SphK1/S1P途径可抑制细胞增殖活性、迁移能力和管生成能力[23]。激活SphK1/S1P会增加炎性细胞因子产生,敲低SphK1表达可减少胶原诱导性关节炎小鼠踝关节的血管生成、关节肿胀和软骨侵蚀[24]。本研究结果显示,Model组大鼠较Control组SphK1、S1P表达水平升高,表明KOA大鼠SphK1/S1P通路被激活;给予APT干预后,KOA大鼠软骨组织中SphK1/S1P相关蛋白表达水平降低,且在使用APT的基础上,加用SphK1过表达慢病毒转染可促进VEGF/SphK1/S1P信号通路,加重KOA大鼠软骨病理损伤,表明APT可能通过抑制VEGF/SphK1/S1P信号通路活化,从而抑制KOA大鼠血管形成,缓解病情进展。
综上所述,APT通过抑制VEGF/SphK1/S1P信号通路活化,从而抑制KOA大鼠血管形成,但本研究未能加入阳性药分析APT对膝骨关节炎大鼠的药效学,且未能深入分析VEGF/SphK1/S1P信号通路在APT抑制膝骨关节炎大鼠血管形成中的具体作用机制,后续有待进一步深入研究。
参考文献
[1] 中华中医药学会风湿病分会. 骨关节炎病证结合诊疗指南[J]. 中华中医药杂志,2021,36(2):929-933. Branch Committee of Rheumatology of China Association of Chinese Medicine. Guidelines for treatment of osteoarthritis basing on the integration of diagnosis and syndrome differentiation[J]. American Journal of Chinese Medicine,2021,36(2):929-933.
[2] HUANG Z,MAO X,CHEN J,et al. Sinomenine hydrochloride injection for knee osteoarthritis: a protocol for systematic review and meta-analysis[J]. Medicine (Baltimore),2022,101(2):1-12. doi:10.1097/MD.0000000000028503.
[3] ZHOU Y,WANG W,TIAN K,et al. Efficacy and safety of Biqi capsule in the treatment of knee osteoarthritis:a protocol of a randomized controlled trial[J]. Medicine(Baltimore),2021,100(16):e25476. doi:10.1097/MD.0000000000025476.
[4] ZHAO G,TONG Y,LUAN F,et al. Alpinetin:a review of its pharmacology and pharmacokinetics[J]. Front Pharmacol,2022,13(1):814370-814381. doi:10.3389/fphar.2022.814370.
[5] 戴华,林建珍,王彦蕊. 山姜素对冠心病大鼠心功能、血脂和血管内皮功能的影响[J]. 中国临床药理学杂志,2021,37(20):2813-2817. DAI H,LIN J Z,WANG Y R. Effect of alpinia on heart function,blood lipid and vascular endothelial function in rats with coronary heart disease[J]. Chin J Clin Pharmacol,2021,37(20):2813-2817. doi:10.13699/j.cnki.1001-6821.2021.20.024.
[6] ZHU Z,HU R,LI J,et al. Alpinetin exerts anti-inflammatory,anti-oxidative and anti-angiogenic effects through activating the Nrf2 pathway and inhibiting NLRP3 pathway in carbon tetrachloride-induced liver fibrosis[J]. Int Immunopharmacol,2021,96(1):1-11. doi:10.1016/j.intimp.2021.107660.
[7] GAO Y,WANG S,HE L,et al. Alpinetin protects chondrocytes and exhibits anti-inflammatory effects via the NF-κB/ERK pathway for alleviating osteoarthritis[J]. Inflammation,2020,43(5):1742-1750. doi:10.1007/s10753-020-01248-3.
[8] QIAN J J,XU Q,XU W M,et al. Expression of VEGF-A signaling pathway in cartilage of ACLT-induced osteoarthritis mouse model[J]. J Orthop Surg Res,2021,16(1):379-392. doi:10.1186/s13018-021-02528-w.
[9] OBINATA H,HLA T. Sphingosine 1-phosphate and inflammation[J]. Int Immunol,2019,31(9):617-625. doi:10.1093/intimm/dxz037.
[10] PULKOSKI-GROSS M J,OBEID L M. Molecular mechanisms of regulation of sphingosine kinase 1[J]. Biochim Biophys Acta Mol Cell Biol Lipids,2018,1863(11):1413-1422. doi:10.1016/j.bbalip.2018.08.015.
[11] WANG Y,WU H,DENG R,et al. Geniposide downregulates the VEGF/SphK1/S1P pathway and alleviates angiogenesis in rheumatoid arthritis in vivo and in vitro[J]. Phytother Res,2021,35(8):4347-4362. doi:10.1002/ptr.7130.
[12] 萬超,朱小虎,程宇核,等. 内热针疗法对膝骨关节炎大鼠软骨细胞凋亡及Caspase-3和Caspase-9表达的影响[J]. 中国针灸,2019,39(4):409-416. WAN C,ZHU X H,CHENG Y H,et al. Effects of inner-heating acupuncture on apoptosis of chondrocytes and expression of Caspase-3 and Caspase-9 in rats with knee osteoarthritis[J]. Chinese Acupuncture & Moxibustion,2019,39(4):409-416. doi:10.13703/j.0255-2930.2019.04.017.
[13] ZHAO X,MENG F,HU S,et al. The synovium attenuates cartilage degeneration in KOA through activation of the Smad2/3-Runx1 cascade and chondrogenesis-related miRNAs[J]. Mol Ther Nucleic Acids,2020,22(1):832-845. doi:10.1016/j.omtn.2020.10.004.
[14] DENG B,CHEN C,GONG X,et al. Chondromodulin?I expression and correlation with angiogenesis in human osteoarthritic cartilage[J]. Mol Med Rep,2017,16(2):2142-2148. doi:10.3892/mmr.2017.6775.
[15] CHEN Y,JIANG W,YONG H,et al. Macrophages in osteoarthritis: pathophysiology and therapeutics[J]. Am J Transl Res,2020,12(1):261-268.
[16] FENG Y,HU S,LIU L,et al. HMGB1 contributes to osteoarthritis of temporomandibular joint by inducing synovial angiogenesis[J]. J Oral Rehabil,2021,48(5):551-559. doi:10.1111/joor.13129.
[17] 代万武,黄祖权,张波,等. 山姜素对脂多糖诱导的软骨细胞损伤的保护作用研究[J]. 天津医药,2020,48(12):1137-1141. DAI W W,HUANG Z Q,ZHANG B,et al. The protective effect of alpinetin on chondrocyte damage induced by lipopolysaccharide[J]. Tianjin Med J,2020,48(12):1137-1141. doi:10.11958/20201496.
[18] ERUSAPPAN T,KONDAPURAM S K,EKAMBARAM S P,et al. Investigation of Alpinia calcarata constituent interactions with molecular targets of rheumatoid arthritis:docking,molecular dynamics,and network approach[J]. J Mol Model,2021,27(1):14-26. doi:10.1007/s00894-020-04651-7.
[19] KO J Y,LEE M S,LIAN W S,et al. MicroRNA-29a counteracts synovitis in knee osteoarthritis pathogenesis by targeting VEGF[J]. Sci Rep,2017,7(1):3584-3597. doi:10.1038/s41598-017-03616-w.
[20] YAMAGUCHI K,SUDO H,IMAI K. Vascular endothelial growth factor signaling in VE-cadherin expression and tube-like formation by rheumatoid arthritic synovial fibroblast-like cells[J]. Biochem Biophys Res Commun,2019,508(2):405-409. doi:10.1016/j.bbrc.2018.11.116.
[21] GURGUL-CONVEY E. To be or not to be:the divergent action and metabolism of sphingosine-1 phosphate in pancreatic beta-cells in response to cytokines and fatty acids[J]. Int J Mol Sci,2022,23(3):1-10. doi:10.3390/ijms23031638.
[22] CHERIFI C,LATOURTE A,VETTORAZZI S,et al. Inhibition of sphingosine 1-phosphate protects mice against chondrocyte catabolism and osteoarthritis[J]. Osteoarthritis Cartilage,2021,29(9):1335-1345. doi:10.1016/j.joca.2021.06.001.
[23] GAO Z,WANG H,XIAO F J,et al. SIRT1 mediates Sphk1/S1P-induced proliferation and migration of endothelial cells[J]. Int J Biochem Cell Biol,2016,74(1):152-160. doi:10.1016/j.biocel.2016.02.018.
[24] HUANG C C,TSENG T T,LIU S C,et al. S1P increases VEGF production in osteoblasts and facilitates endothelial progenitor Cell angiogenesis by inhibiting miR-16-5p expression via the c-Src/FAK signaling pathway in rheumatoid arthritis[J]. Cells,2021,10(8):1-12. doi:10.3390/cells10082168.
(2023-06-13收稿 2023-08-31修回)
(本文編辑 陆荣展)
