黄芪甲苷抑制Fas/FasL信号通路减轻创伤性脑损伤大鼠神经功能缺损和神经元凋亡
2024-05-13陈惠刚池小锋封娣米娅莉
陈惠刚 池小锋 封娣 米娅莉
基金項目:河北省医学科学研究课题计划项目(20220572)
作者单位:张家口学院护理学院临床护理教研室(邮编075061)
作者简介:陈惠刚(1980),男,副教授,主要从事解剖学和组织胚胎学方面研究。E-mail:chenhuigang627@163.com
△通信作者 E-mail:876794652@qq.com
摘要:目的 探究黄芪甲苷通过Fas/FasL信号通路对创伤性脑损伤(TBI)大鼠神经功能缺损和神经元凋亡的影响。方法 将大鼠随机分为5组:假手术组、模型组、黄芪甲苷组(20 mg/kg)、Fas沉默组[4 μg Fas小干扰RNA(siRNA)慢病毒载体]、黄芪甲苷+Fas沉默组(20 mg/kg黄芪甲苷+4 μg Fas siRNA慢病毒载体),每组10只。除假手术组外,其余各组大鼠制作TBI模型。各组按照对应剂量进行给药干预,每日1次,持续7 d。水迷宫实验检测大鼠神经功能缺损;荧光定量PCR法检测脑组织Fas、FasL mRNA表达;苏木精-伊红、β-微管蛋白Ⅲ(Tuj1)免疫荧光、TUNEL染色分别观察脑组织病理变化、神经元活性及神经元凋亡;Western blot法检测脑组织中Fas/FasL通路、胱天蛋白酶-3(Caspase-3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)表达。结果 与假手术组比较,模型组大鼠脑组织细胞间隙增加、变性明显,第1~5天大鼠逃避潜伏期,神经元凋亡率,Caspase-3、Bax蛋白,Fas、FasL mRNA和蛋白水平升高,穿越平台次数、Tuj1阳性细胞数目、Bcl-2蛋白水平降低(P<0.05)。与模型组比较,黄芪甲苷组、Fas沉默组大鼠脑组织细胞间隙缩小,变性减轻,第1~5天大鼠逃避潜伏期,神经元凋亡率,Caspase-3、Bax蛋白,Fas、FasL mRNA和蛋白水平降低,穿越平台次数、Tuj1阳性细胞数目、Bcl-2蛋白水平升高(P<0.05)。黄芪甲苷组和Fas沉默组大鼠脑组织病理变化和上述指标差异无统计学意义(P>0.05)。与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组大鼠脑组织病理损伤进一步降低,神经元凋亡率,Caspase-3、Bax蛋白,Fas、FasL mRNA和蛋白水平降低,Tuj1阳性细胞数目、Bcl-2蛋白水平升高(P<0.05)。结论 黄芪甲苷通过抑制Fas/FasL信号通路介导的凋亡途径减轻TBI大鼠神经功能缺损和神经元凋亡。
关键词:脑损伤,创伤性;黄芪甲苷;Fas受体;神经元
中图分类号:R651.15,R286.1文献标志码:ADOI:10.11958/20231226
Astragaloside inhibits Fas/FasL signaling pathway to reduce neural dysfunction and neuronal apoptosis in traumatic brain injury of rats
CHEN Huigang, CHI Xiaofeng, FENG Di, MI Yali△
Clinical Nursing Teaching and Research Office of the School of Nursing at Zhangjiakou University,
Zhangjiakou 075061, China
△Corresponding Author E-mail: 876794652@qq.com
Abstract: Objective To explore the effects of astragaloside on neural dysfunction and neuronal apoptosis of traumatic brain injury (TBI) in rats through Fas/FasL signaling pathway. Methods Fifty rats were randomly divided into 5 groups: the sham operation group, the model group, the astragaloside group (20 mg/kg), the Fas silencing group [4 μg Fas small interfering RNA (siRNA) lentiviral vector] and the astragaloside+Fas silencing group (20 mg/kg astragaloside+4 μg Fas siRNA lentiviral vector). Each group consisted of 10 rats. Except the sham operation group, the other groups of rats were established TBI rat model. Each group was received medication intervention according to the corresponding dosage, once a day, for 7 days. Water maze test was used to detect the nerve function defect in rats. Fluorescence quantitative PCR was used to detect expression levels of Fas and FasL messenger RNA (mRNA) in brain tissue. Hematoxylin-eosin, β-tubulin III (Tuj1) immunofluorescence and TUNEL staining were used to observe pathological changes, neuronal activity and apoptosis of brain tissue, respectively. Western blot assay was used to detect expression levels of Fas/FasL pathway, Caspase-3, Bcl-2 associated X protein (Bax) and B lymphoblastoma-2 (Bcl-2) protein in brain tissue. Results Compared with the sham operation group, the cell gap was increased and degeneration was obvious in brain tissue in the model group. The escape latency of rats on days 1-5, neuronal apoptosis rate, Caspase-3, Bax protein, Fas, FasL mRNA and protein levels were increased (P<0.05). The number of times crossing platforms, the number of Tuj1 positive cells and Bcl-2 protein were decreased (P<0.05). Compared with the model group, in the astragaloside group and the Fas silencing group, the cell gap in brain tissue was narrowed and degeneration was reduced, the escape latency of rats on days 1-5, neuronal apoptosis rate, Caspase-3, Bax protein, Fas, FasL mRNA and protein levels were decreased, and the number of crossing platforms, the number of Tuj1 positive cells and Bcl-2 protein level were increased (P<0.05). There were no significant differences in pathological changes of brain and the above indexes between the astragaloside group and the Fas silencing group (P>0.05). Compared with the astragaloside group and the Fas silencing group, the pathological damage of brain tissue of rats was further reduced in the astragaloside+Fas silencing group, neuronal apoptosis rate, Caspase-3, Bax protein, Fas, FasL mRNA and protein levels were decreased, and the number of Tuj1 positive cells and Bcl-2 protein were increased (P<0.05). Conclusion Astragaloside may reduce nerve function deficit and neuronal apoptosis in TBI rats by inhibiting Fas/FasL signaling pathway mediated apoptosis pathway.
Key words: brain injuries, traumatic; astragaloside Ⅳ; Fas receptor; neurons
创伤性脑损伤(traumatic brain injury,TBI)是一种严重的颅脑损伤疾病,通常因外力作用于头部引发,常继发运动和言语功能障碍、肌张力改变、智力障碍、继发性癫痫、神经源性肺水肿等并发症[1-2]。TBI发生后,一系列神经炎性、氧化应激损伤等均会导致神经元的凋亡,增加了神经退行性疾病的发生风险[3]。目前,临床常用的神经节苷脂、脑活素、胞磷胆碱等神经保护剂仅具有短期疗效,且不良反应较大。因此,寻找一种疗效持久且安全的神经保护剂对脑创伤后的治疗具有重要价值。黄芪甲苷是黄芪的活性成分之一,具有抗炎、抗病毒、抗应激、抗衰老、增强免疫力等功能[4]。研究显示,黄芪甲苷可通过改善感觉运动功能障碍和神经元凋亡,从而减轻脑缺血再灌注大鼠脑损伤[5]。目前,鲜见黄芪甲苷对TBI的治疗效果研究。有研究表明,Fas/Fas配体(Fas ligand,FasL)介导的死亡受体通路在阿尔茨海默病的神经炎症反应及神经元凋亡中发挥重要作用[6-7]。本研究旨在观察黄芪甲苷对TBI大鼠脑组织神经元凋亡和Fas/FasL通路的影响,为TBI的神经元保护提供参考。
1 材料与方法
1.1 动物 SPF级9周龄雄性SD大鼠50只,体质量(316±10)g,购自太原康宝瑞实验动物技术公司,生产许可证号:SCXK(晋)2019-0002。大鼠12 h明暗循环、(26±2)℃环境下适应性喂养1周。
1.2 主要试剂与仪器 黄芪甲苷(原料药,纯度≥99.75%,批号SA8671)购自成都格利普生物科技公司;Fas小干扰RNA(small interfering RNA,siRNA)慢病毒载体由重庆威斯腾生物科技有限公司构建;苏木精-伊红(HE)染色试剂盒、鼠源β-微管蛋白Ⅲ(Tuj1)一抗、TUNEL染色试剂盒均购自佛山市博新生物技术公司;PCR試剂盒、羊抗鼠二抗、4',6-二脒基-2-苯基吲哚(DAPI)染色试剂、鼠源Fas、FasL、胱天蛋白酶-3(Caspase-3)、B淋巴细胞瘤-2(Bcl-2)、Bcl-2相关X蛋白(Bax)、甘油醛-3-磷酸脱氢酶(GAPDH)一抗均购自美国GeneTex公司。实时荧光定量聚合酶链式反应(qRT-PCR)仪(型号Esan-Gene 696)购自深圳环亚生物科技有限公司;荧光显微镜(型号MF53-N)、凝胶成像仪(型号Quantum CX5)均购自北京盛鸿程科技公司。
1.3 研究方法
1.3.1 TBI模型制作与分组 参照文献[8]制作大鼠TBI模型,大鼠出现短暂性呼吸暂停、肢体痉挛和无意识为TBI造模成功。将造模成功的40只TBI大鼠按随机数字表法分为模型组、黄芪甲苷组、Fas沉默组、黄芪甲苷+Fas沉默组,每组10只。另取10只健康大鼠(仅切开头皮,暴露左顶骨不进行坠落打击)为假手术组。黄芪甲苷组大鼠尾静脉注射20 mg/kg的黄芪甲苷[9];Fas沉默组大鼠尾静脉注射4 μg的Fas siRNA慢病毒载体;黄芪甲苷+Fas沉默组大鼠尾静脉注射20 mg/kg的黄芪甲苷和4 μg的Fas siRNA慢病毒载体;模型组和假手术组大鼠尾静脉注射20 mg/kg的生理盐水。各处理组均每日1次,持续7 d,给药期间均末出现大鼠死亡。
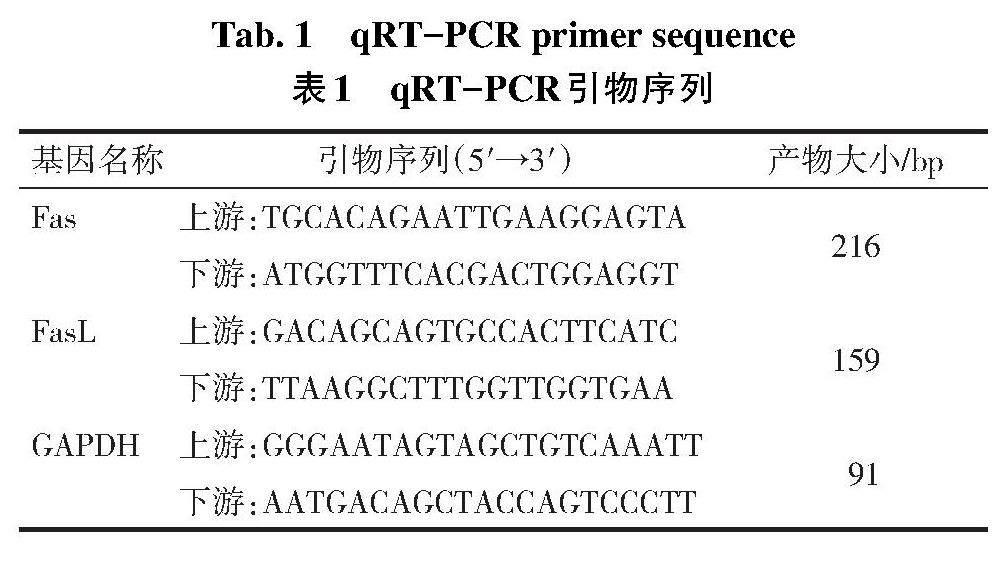
1.3.2 水迷宫试验检测大鼠神经功能缺损 末次给药后,各组大鼠行Morris水迷宫实验,第1~5天做定位航行,记录大鼠找到平台所需时间(逃避潜伏期)。第6天做空间探索观测大鼠2 min内穿越平台次数。
1.3.3 qRT-PCR法检测脑组织Fas、FasL mRNA表达 断头处死各组大鼠,取创伤部位周围脑组织,分成3份,第一部分于-80 ℃冷冻保存;第二部分用4%多聚甲醛固定;第三部分脑组织用于Fas、FasL mRNA水平检测。RNA提取试剂分离脑组织总RNA,反转录(2 μg RNA)合成cDNA。采用PCR试剂盒检测Fas、FasL mRNA表达水平。反应体系(20 ?L):2 ?L cDNA(200 μg/L)、10 ?L PCR试剂、0.8 ?L上游引物、0.8 ?L下游引物和6.4 ?L无菌水。引物序列见表1。PCR反应条件:95 ℃预变性4 min;95 ℃ 18 s、58℃ 22 s、72℃ 27 s,40个循环。Fas、FasL均以GAPDH为内参基因,采用2-ΔΔCt算法计算Fas、FasL mRNA相对表达量。实验重复3次,取平均值。
1.3.4 HE染色观察脑组织病理变化 取4%多聚甲醛固定的脑组织,常规操作制成5 μm石蜡切片,经脱蜡、复水、苏木精染色、盐酸乙醇分色、伊红染色、脱水、透明和封片等操作后,使用显微镜观察脑组织病理变化,将脑组织细胞萎缩死亡定义为变性。
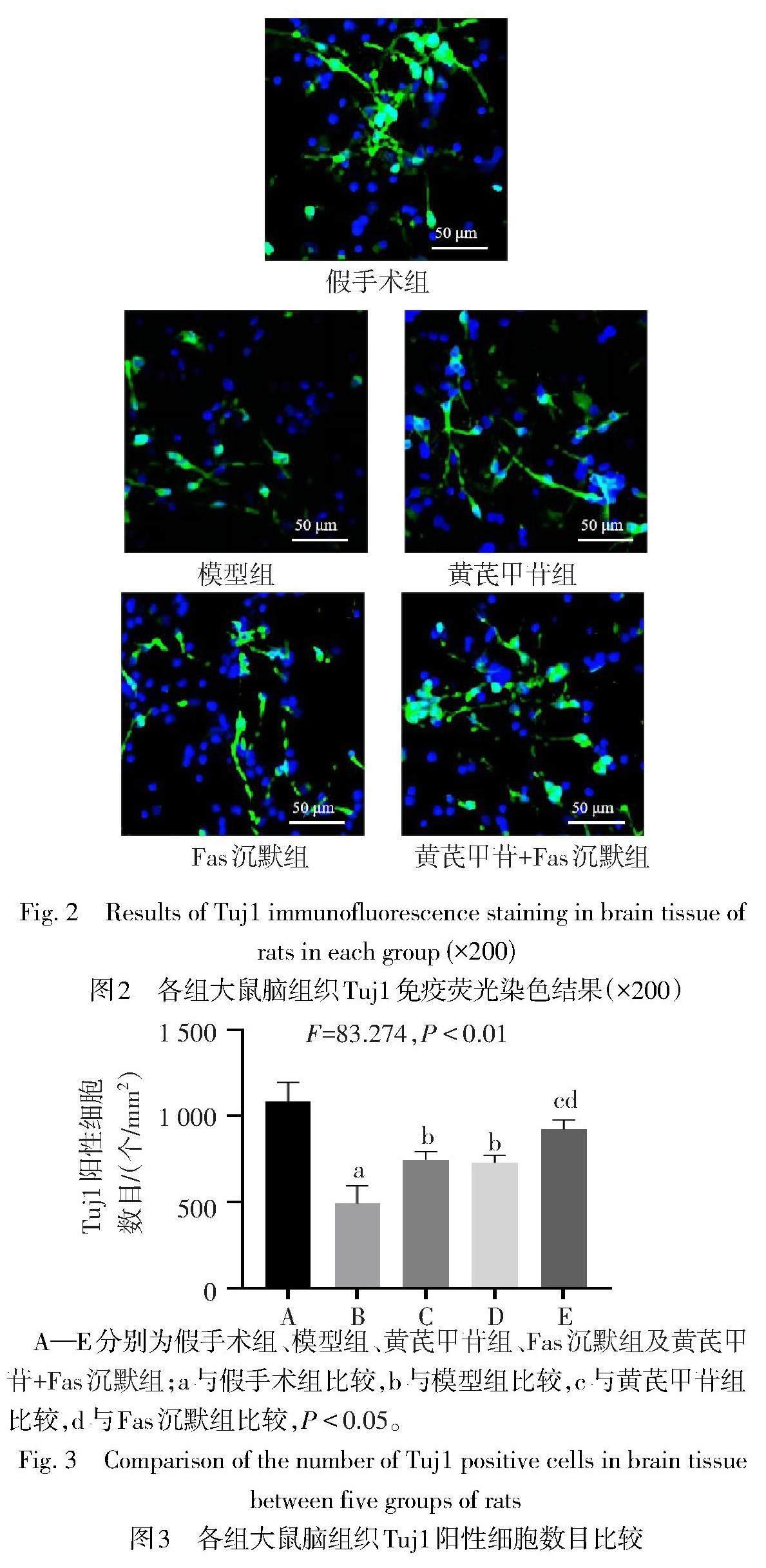
1.3.5 Tuj1免疫荧光染色观察脑组织神经元活性 将1.3.4中石蜡切片常规脱蜡、水化后,磷酸盐缓冲液洗涤3次(每次5 min)进行抗原修复;封闭后添加鼠源Tuj1(神经元特异性标志物)一抗(1∶470)后4 ℃孵育过夜,滴加羊抗鼠二抗(1∶1 000)室温孵育2 h;以DAPI对细胞核进行染色,滴加抗荧光衰减封片剂封片。荧光显微镜下观察,绿色荧光即为Tuj1阳性细胞。用Image J处理图像,结果以Tuj1阳性细胞数目/mm2表示其表达水平,水平越高表示神经元活性越强。
1.3.6 TUNEL染色观察脑组织神经元凋亡 取1.3.4中的石蜡切片,常规脱蜡、水化,通过TUNEL试剂盒进行神经元凋亡检测,以DAPI进行核染。显微镜下观测,红色荧光为TUNEL阳性,Image J处理图像。神经元凋亡率(%)=阳性细胞/视野总细胞×100%。
1.3.7 Western blot法检测脑组织中Fas/FasL通路、Caspase-3、Bax、Bcl-2蛋白表达 取1.3.3中冻存的脑组织剪碎,匀浆处理,加入蛋白分离试剂,30 min后,4 ℃下9 100 r/min离心11 min,收集上清液,参照BCA试剂盒测定脑组织蛋白总浓度。取一定量蛋白质,行凝胶电泳,结束后将蛋白条带分离并转膜(PVDF膜),脱脂奶粉封闭后Tris缓冲盐溶液(TBS)清洗,加入鼠源Fas(1∶610)、FasL(1∶610)、Caspase-3(1∶730)、Bax(1∶740)、Bcl-2(1∶530)、GAPDH(1∶1 030)一抗,4 ℃过夜。TBS清洗后加羊抗鼠二抗(1∶2 150),洗膜,加入ECL发光液避光显影,于凝胶成像仪中观察各组蛋白表达情况。
1.4 统计学方法 采用SPSS 26.0进行数据分析。符合正态分布的计量数据采用均数±标准差([[x] ±s
])表示,多组间比较采用单因素方差分析,组间多重比较用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组神经功能缺损情况比较 与假手术组比较,模型组大鼠第1~5天逃避潜伏期增加,穿越平台次数减少(P<0.05);与模型组比较,黄芪甲苷组、Fas沉默组第1~5天大鼠逃避潜伏期均减少,穿越平台次数均增加(P<0.05);黄芪甲苷组和Fas沉默组第1~5天大鼠逃避潜伏期及穿越平台次数差异无统计学意义(P>0.05);与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组第1~5天2指标差异无统计学意义(P>0.05),见表2。
2.2 各组大鼠脑组织病理变化 与假手术组比较,模型组大鼠脑组织细胞间隙增加、变性明显;与模型组比较,黄芪甲苷组、Fas沉默组大鼠脑组织细胞间隙缩小,变性减轻;黄芪甲苷组和Fas沉默组大鼠脑组织损伤程度相似;与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组大鼠脑组织病理损伤进一步减轻,见图1。
2.3 各组大鼠脑组织Tuj1表达水平比较 与假手术组比较,模型组大鼠脑组织中Tuj1阳性细胞数目下降(P<0.05);与模型组比较,黄芪甲苷组、Fas沉默组大鼠脑组织中Tuj1阳性细胞数目升高(P<0.05);黄芪甲苷组和Fas沉默组大鼠脑组织中Tuj1阳性细胞数目差异无统计学意义(P>0.05);与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组大鼠脑组织中Tuj1阳性细胞数目升高(P<0.05),见图2、3。
2.4 各组大鼠脑组织神经元凋亡率和凋亡相关蛋白表达比较 与假手术组比较,模型组大鼠脑组织神经元凋亡率及Caspase-3、Bax蛋白水平升高,Bcl-2蛋白水平降低(P<0.05);与模型组比较,黄芪甲苷组、Fas沉默组大鼠脑组织细胞凋亡率及Caspase-3、Bax蛋白水平降低,Bcl-2蛋白水平升高(P<0.05);黄芪甲苷组和Fas沉默组大鼠脑组织细胞凋亡率及Caspase-3、Bax、Bcl-2蛋白水平差异无统计学意义(P>0.05);与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组大鼠脑组织细胞凋亡率及Caspase-3、Bax蛋白水平进一步降低,Bcl-2蛋白水平进一步升高(P<0.05),见图4、5,表3。
2.5 各组大鼠脑组织Fas、FasL mRNA和蛋白表达比较 与假手术组比较,模型组大鼠脑组织Fas、FasL mRNA和蛋白水平均升高(P<0.05);与模型组比较,黄芪甲苷组、Fas沉默组大鼠脑组织Fas、FasL mRNA和蛋白水平均降低(P<0.05);黄芪甲苷组和Fas沉默组大鼠脑组织Fas、FasL mRNA和蛋白水平差异无统计学意义(P>0.05);与黄芪甲苷组和Fas沉默组比较,黄芪甲苷+Fas沉默组大鼠脑组织Fas、FasL mRNA和蛋白水平进一步降低(P<0.05),见图6、表4。
3 讨论
TBI常因外力直接或间接损伤颅脑引起,可导致多种严重并发症,有较高致残率与致死率,且随着社会发展,TBI发病率呈增加趋势,已成为公共健康问题[10-11]。原发性TBI多不可逆,随时间进展,会诱发一系列可修复的继发损伤(氧化应激、细胞凋亡等),若不及时采取干预措施会导致损伤病灶扩大且不可逆[12]。
黄芪甲苷即黄芪苷Ⅳ,是从中药黄芪中提取的天然化合物,是黄芪的主要活性成分,药效强度是黄芪多糖的2倍多,具有抗炎、抗病毒、抗氧化、增强人体免疫力等功效[13-14]。研究显示,黄芪甲苷可通过抑制线粒体中Caspase-3的表达、上调Bcl-2的表达,抑制线粒体途径关键因子的激活,从而减轻缺血再灌注诱导的大鼠脑细胞凋亡[15]。Wang等[16]研究显示,黄芪甲苷可改善线粒体功能障碍,从而减轻阿尔茨海默病大鼠海马神经元损伤和凋亡。神经元凋亡是TBI损伤中的关键环节,Tuj1是神經元特异性分化的微管蛋白,可作为神经元标志物。本研究显示,与假手术组比较,TBI大鼠神经元凋亡率,Caspase-3、Bax蛋白水平升高,Bcl-2蛋白水平降低,表明神经元凋亡加剧,而逃避潜伏期升高,Tuj1阳性细胞数目(神经元活性)和穿越平台次数降低,表明大鼠脑组织细胞间隙增加、变性明显,提示TBI大鼠存在明显的神经功能损伤和神经元凋亡。经黄芪甲苷处理后,TBI大鼠脑组织神经细胞变性现象明显改善,逃避潜伏期,神经元凋亡率,Caspase-3、Bax蛋白水平降低,穿越平台次数、Tuj1阳性细胞数(神经元活性)、Bcl-2蛋白水平升高,与Yin等[15-16]研究结果相似,提示黄芪甲苷可发挥改善TBI大鼠神经功能损伤和保护神经元的作用。
神经元凋亡是由基因控制的程序性细胞死亡,Fas/FasL通路是死亡受体介导通路,Fas是肿瘤坏死因子受体之一,与其配体FasL结合后与Caspase-8形成死亡诱导信号复合体,激活Caspase-8及下游Caspase家族,诱导细胞凋亡[17-18]。Sun等[19]研究发现,Fas/FasL通路在砷致大鼠神经细胞凋亡中处于激活状态。Wen等[20]研究显示,抑制大鼠大脑皮质神经元中的Fas/FasL通路活性可减轻镉诱导的神经元凋亡和氧化应激。本研究发现,TBI大鼠脑组织中Fas、FasL mRNA和蛋白水平较假手术组升高,表明Fas/FasL通路被激活,采用黄芪甲苷处理TBI大鼠后,脑组织中Fas、FasL mRNA和蛋白水平降低,提示黄芪甲苷对TBI大鼠神经功能损伤的改善和神经元的保护可能与Fas/FasL信号通路有关。采用Fas siRNA慢病毒载体沉默Fas/FasL信号通路后,黄芪甲苷组和Fas沉默组大鼠脑组织病理变化和上述指标无显著差异,而黄芪甲苷和Fas沉默共同干预TBI大鼠后各指标优于黄芪甲苷或Fas沉默单一作用,表明黄芪甲苷可通过抑制Fas/FasL信号通路,改善TBI大鼠神经功能缺损,降低神经元凋亡。
综上所述,黄芪甲苷可能通过抑制Fas/FasL信号通路改善TBI引起的的神经细胞变性和神经功能缺损现象,抑制神经元凋亡,有望成为治疗TBI的新药物。本研究不足之处在于未探究黄芪甲苷的不良反应,后续将通过动物实验进一步开展。
参考文献
[1] CENTE M,MATYASOVA K,CSICSATKOVA N,et al. Traumatic microRNAs:deconvolving the signal after severe traumatic brain injury[J]. Cell Mol Neurobiol,2023,43(3):1061-1075. doi:10.1007/s10571-022-01254-z.
[2] ZHANG C,CHEN S. Role of TREM2 in the development of neurodegenerative diseases after traumatic brain injury[J]. Mol Neurobiol,2023,60(1):342-354. doi:10.1007/s12035-022-03094-w.
[3] MI L,MIN X,SHI M,et al. Neutrophil extracellular traps aggravate neuronal endoplasmic reticulum stress and apoptosis via TLR9 after traumatic brain injury[J]. Cell Death Dis,2023,14(6):374-385. doi:10.1038/s41419-023-05898-7.
[4] 李沅洋,周湘忠,雷向红,等. 黄芪甲苷调控线粒体自噬减轻5-Fu诱导老龄大鼠心肌毒性的实验研究[J]. 天津医药,2021,49(4):378-384. LI Y Y,ZHOU X Z,LEI X H,et al. The experimental study on astragaloside Ⅳ regulating mitochondrial autophagy to reduce myocardial toxicity induced by 5-Fu in aging rats[J]. Tianjin Med J,2021,49(4):378-384. doi:10.11958/20202229.
[5] WANG L,LIU C,WANG L,et al. Astragaloside IV mitigates cerebral ischaemia-reperfusion injury via inhibition of P62/Keap1/Nrf2 pathway-mediated ferroptosis[J]. Eur J Pharmacol,2023,944:175516. doi:10.1016/j.ejphar.2023.175516.
[6] LAGUNAS-RANGEL F A. Fas (CD95)/FasL (CD178) system during ageing[J]. Cell Biol Int,2023,47(8):1295-1313. doi:10.1002/cbin.12032.
[7] RUAN S,ZHAI L,WU S,et al. SCFAs promote intestinal double-negative T cells to regulate the inflammatory response mediated by NLRP3 inflammasome[J]. Aging (Albany NY),2021,13(17):21470-21482. doi:10.18632/aging.203487.
[8] 杨琪,安鹏飞,王瑞辉,等. 不同时期电针对创伤性颅脑损伤大鼠脑组织Fas/FasL表达的影响[J]. 针刺研究,2020,45(9):714-719. YANG Q,AN P F,WANG R H,et al. Effect of electroacupuncture at different stages on the expression of Fas and FasL in brain tissue of rats with traumatic brain injury[J]. Acupuncture Research,2020,45(9):714-719. doi:10.13702/j.1000-0607.190863.
[9] 張怡,张彐宁,周晓红,等. 黄芪甲苷缓解大脑中动脉阻塞/再灌注大鼠脑组织损伤的作用及机制[J]. 时珍国医国药,2021,32(11):2636-2639. ZHANG Y,Zhang J N,ZHOU X H,et al. Effect and mechanism of astragaloside on brain tissue injury induced by middle cerebral artery occlusion/reperfusion in rats[J]. Lishizhen Medicine and Materia Medica Research,2021,32(11):2636-2639. doi:10.3969/j.issn.1008-0805.2021.11.18.
[10] 邹婷婷,马莉,潘文静,等. 重型颅脑创伤并发颅内感染危险因素分析及列线图预测模型构建[J]. 中国现代神经疾病杂志, 2023,23(6):496-502. ZOU T T,MA L, PAN W J,et al. Analysis of risk factors of secondary intracranial infection in patients with severe traumatic brain injury and construction of a nomogram prediction model[J]. Chinese Journal of Contemporary Neurology and Neurosurgery,2023,23(6):496-502. doi:10.3969/j.issn.1672-6731.2023.06.005.
[11] SHRESTHA A,PAUDEL N,ADHIKARI G,et al. Traumatic brain injury among patients admitted in neurosurgical unit in a tertiary care centre:a descriptive cross-sectional study[J]. JNMA J Nepal Med Assoc,2023,61(262):514-518. doi:10.31729/jnma.8197.
[12] KIM M S,KIM Y H,KIM M S,et al. Efficacy and safety of early anti-inflammatory drug therapy for secondary injury in traumatic brain injury[J]. World Neurosurg,2023,172(1):646-654. doi:0.1016/j.wneu.2023.01.110.
[13] TANG X,LI X,ZHANG D,et al. Astragaloside-IV alleviates high glucose-induced ferroptosis in retinal pigment epithelial cells by disrupting the expression of miR-138-5p/Sirt1/Nrf2[J]. Bioengineered,2022,13(4):8240-8254. doi:10.1080/21655979.2022.2049471.
[14] ZHANG D,LI Z,GAO Y,et al. Astragaloside IV improves renal function and alleviates renal damage and inflammation in rats with chronic glomerulonephritis[J]. Turk J Biol,2022,47(1):61-73. doi:10.55730/1300-0152.2641.
[15] YIN F,ZHOU H F,FANG Y C,et al. Astragaloside IV alleviates ischemia reperfusion-induced apoptosis by inhibiting the activation of key factors in death receptor pathway and mitochondrial pathway[J]. J Ethnopharmacolo,2020,248:112319. doi:10.1016/j.jep.2019.112319.
[16] WANG Y L,CHIO C C,KUO S C,et al. Exercise rehabilitation and/or Astragaloside attenuate amyloid-beta pathology by reversing BDNF/TrkB signaling deficits and mitochondrial dysfunction[J]. Mol Neurobiol,2022,59(5):3091-3109. doi:10.1007/s12035-022-02728-3.
[17] ABOU SHOUSHA S,BAHEEG S,GHONEIM H,et al. The effect of Fas/FasL pathway blocking on apoptosis and stemness within breast cancer tumor microenvironment (preclinical study)[J]. Breast Dis,2023,42(1):163-176. doi:10.3233/BD-220077.
[18] PIETRZAK B A,WNUK A,PRZEPI?RSKA K,et al. Posttreatment with ospemifene attenuates hypoxia- and ischemia-induced apoptosis in primary neuronal cells via selective modulation of estrogen receptors[J]. Neurotox Res,2023,41(4):362-379. doi:10.1007/s12640-023-00644-5.
[19] SUN H,YANG Y,GU M,et al. The role of Fas-FasL-FADD signaling pathway in arsenic-mediated neuronal apoptosis in vivo and in vitro[J]. Toxicol Lett,2022,356(1):143-150. doi:10.1016/j.toxlet.2021.11.012.
[20] WEN S,WANG L,ZOU H,et al. Puerarin attenuates cadmium-induced neuronal injury via stimulating cadmium excretion, inhibiting oxidative stress and apoptosis[J]. Biomolecules,2021,11(7):978. doi:10.3390/biom11070978.
(2023-08-14收稿 2023-10-31修回)
(本文編辑 陆荣展)
