鰤鱼诺卡氏菌疫苗对石斑鱼免疫效果研究
2024-05-12高浩峰邵蓬武尊吴雅婷汪笑宇
高浩峰 邵蓬 武尊 吴雅婷 汪笑宇


摘要:为探究鰤鱼诺卡氏菌灭活疫苗对石斑鱼的免疫效果,通过免疫基因表达量分析疫苗对石斑鱼的免疫保护。利用鰤鱼诺卡氏菌制备福尔马林灭活全菌疫苗,通过腹腔注射法对珍珠龙胆石斑鱼进行免疫,利用荧光定量法检测免疫后该鱼的肾脏、肝脏和脾3个器官中TLR2、MyD88、TNF-α、IL-1β 免疫基因表达量的变化。结果显示,注射灭活疫苗后,TNF-α、IL-1β 基因表达量在肾脏组织中较高,MyD88 基因表达量在脾组织中较高,TLR2 基因表达量在肝脏组织中较高;除脾组织中的TNF-α 基因相对表达量出现下降趋势外,其余基因的表达量在所有器官中都呈现出上调的趋势。研究结果为探索珍珠龙胆石斑鱼与诺卡氏菌的相互作用提供理论基础,为渔业疫苗开发和应用奠定基础。
关键词:鰤鱼诺卡氏菌;石斑鱼;灭活疫苗;TLR2;MyD88;TNF-α;IL-1β
doi:10.13304/j.nykjdb.2022.0653
中图分类号:S941.51+6 文献标志码:A 文章编号:10080864(2024)02014508
鰤鱼诺卡氏菌(Nocardia seriolae)引起的“结节病”是影响我国淡海水鱼类养殖的重要疾病,近年来由于全球气候变暖,其发病率呈上升趋势,因此研究鱼类免疫系统的特性对抗病鱼类、疫苗和免疫刺激剂的开发非常重要[1]。鰤诺卡氏菌是一种革兰氏阳性好氧菌,在初期通常是隐性的,不易被发现,感染和发病过程漫长,通常在成鱼期才出现典型症状和显著性危害[2],从发病到死亡需要2 周左右,明显发病时已较难治疗。病鱼肝、脾、肾等出现大量肉眼可见的白色结节,自然发病率为35%~60%,由于缺乏有效的治疗方案,死亡率较高[3],本研究制备鰤鱼诺卡氏菌疫苗,通过免疫基因相对表达量的变化探讨其免疫效果。
灭活疫苗是通过物理加热、化学试剂等方法将微生物灭活后制成的疫苗。化学灭活剂主要有甲醛、苯酚、氯仿等,其中,甲醛溶液(福尔马林)在同等条件下灭活效果更具优势[4]。福尔马林全菌灭活疫苗作为抵御传染性疾病的生物制品,其 病原体失去致病能力而免疫原性未失效,可使接种对象获得良好的免疫保护效果,刺激免疫系统以增强其非特异性和特异性免疫,有效避免病原体对养殖动物的危害,且不会在产品或环境中留下残留物,还会降低动物体内产生耐药菌株[5]。
根据免疫相关基因在免疫过程中发挥的不同作用,免疫基因的表达情况被作为疫苗效果的评价指标。本研究通过对珍珠龙胆石斑鱼(♀ Epinephelus fuscoguttatus× ♂ Epinephelus lanceolatus)注射鰤魚诺卡氏菌全菌灭活疫苗,根据Ⅰ型跨膜蛋白(toll-like receptors,TLR)信号通路及细胞因子中部分免疫基因变化来观察免疫效果。TLR2能够识别革兰氏阳性菌的磷壁酸、脂蛋白等并介导细胞活化和宿主炎症反应,TLR存在2种信号途径,分别为MyD88依赖途径和非MyD88依赖途径,分别参与炎症反应和抗病毒反应,同时TLR也可以向参与适应性免疫的T 细胞呈递抗原[6]。由免疫细胞分泌的IL-1β和TNF-α是抵御外部病原攻击引发炎症反应的第一介质,其主要生理作用是诱导分化各种免疫细胞及产生各种趋化因子,并移至感染部位发挥免疫作用[7]。本研究使用灭活的鰤鱼诺卡氏菌疫苗注射珍珠龙胆石斑鱼,并分析免疫后的珍珠龙胆石斑鱼组织中TLR2、MyD88、IL-1β、TNF-α 共4个基因相对表达量,探究珍珠龙胆石斑鱼对鰤鱼诺卡氏菌的免疫应答。
1 材料与方法
1.1 试验材料
1.1.1 菌种 鰤鱼诺卡氏菌202011201菌株由本实验室分离保存。
1.1.2 试验用鱼 在天津市滨海新区某渔场中捕捞,体长7 cm左右,体质量30 g左右。
1.1.3 试剂 福尔马林购自天津渤化化学试剂有限公司;液氮购自天津泰亚气体销售有限公司;BHI浸液肉汤和BHI浸液琼脂购自北京陆桥技术有限公司;RNA提取试剂盒购自上海普洛麦格生物产品有限公司;cDNA逆转录试剂和荧光定量PCR试剂盒购自大连宝生物工程有限公司;96孔V型血凝板购自北京索莱宝科技有限公司。
1.1.4 主要仪器 电子天平,型号AS 220.X2,购自RADWAG;超低温冰箱,型号HYCD-205,购自青岛海尔特种电器有限公司;恒温培养箱,型号DHP 9272,购自上海一恒科学仪器有限公司;恒温震荡培养箱,型号IS-RSV1,购自CRYSTAL;高压灭菌锅,型号GI-54TW,购自ZEALWAY;低温离心机,型号3K15,购自Sigma;PCR 仪,型号T100,购自Bio-Rad;荧光定量PCR 仪,型号IQ5,购自Bio-Rad;微量核酸测定仪,型号NanoPhotometerPClass,购自德国Implen;麦氏比浊仪,型号17025,购自珠海贝索生物技术有限公司。
1.2 试验方法
1.2.1 灭活疫苗的安全性试验 活化鰤鱼诺卡氏菌,于BHI液体培养基中培养7 d,吸取1 mL鰤鱼诺卡氏菌菌液加至1.5 mL 无菌无酶离心管中,3 000 r·min-1离心5 min,去除上清液,加入生理盐水振荡形成菌液,通过麦氏比浊仪将鰤鱼诺卡氏菌灭活疫苗配置为1.0×108 CFU· mL-1,将配制好的菌液分成5 份,按照菌液体积的0.1%、0.2%、0.3%、0.4%、0.5% 加入福尔马林,灭活时间设置30 min和1、2、4、8、12、24 h共7个时间点,在每个时间点吸取100 μL涂布在BHI固体培养基中,观察每个时间点福尔马林对鰤鱼诺卡氏菌的灭活效果。
1.2.2 鰤鱼诺卡氏菌灭活疫苗的制备 根据1.2.1的方法制备鰤鱼诺卡氏菌灭活疫苗,将灭活疫苗3 000 r·min-1 离心5 min,用生理盐水冲洗3次,洗去福尔马林,然后加入生理盐水与灭活的鰤鱼诺卡氏菌震荡混匀,将配置好的灭活疫苗放置冰箱4 ℃保存备用。
1.2.3 疫苗的注射,组织的取样及保存 将健康的珍珠龙胆石斑鱼在实验室饲养7 d,随机选择80条用于试验。每条鱼腹腔注射200 μL灭活疫苗,对照组注射生理盐水;在注射后的12 h和1、3、7、14、21、28 d的7个时间点,分别取10条珍珠龙胆石斑鱼的肝脏、肾脏和脾3种组织样品,将取好的样品在生理盐水中涮掉杂质残留,放置保菌管中于液氮中冻存48 h;然后将样品置于冰箱-80 ℃保存。
1.2.4 组织RNA的提取 采用RNA试剂盒提取组织总RNA,使用超微量分光光度计检测RNA的质量浓度及纯度。A260/A280 值在2.0~2.6 之间,RNA纯度达到要求标准。
1.2.5 cDNA 逆转录 用反转录试剂盒PrimeScript? RT Reagent Kit(TaKaRa)合成cDNA。反转录反应体系为:5× PrimeScript Buffer 4 μL,PrimeScript RT Enzyme Mix I 1 μL,Oligo dTPrimer 1 μL,Random 6 mers 1 μL,RNA模板2 μL,加无菌无酶水至20 μL。反应条件为:37 ℃ 15min,85 ℃ 5 s。转录完成后,将cDNA 模板置于-80℃冰箱保存。
1.2.6 免疫基因的选择及引物设计 从NCBI网站获得珍珠龙胆石斑鱼管家基因β-actin 及免疫基因TLR2、MyD88、TNF- α、IL-1β 的序列,利用Premier 6.0 设计RT-qPCR 所用引物(表1),以肝脏、肾脏和脾的cDNA为模板进行荧光定量PCR。
1.2.7 荧光定量 PCR β-actin 作为内部参考基因,利用TBGreen?Premix Ex Taq?Ⅱ试剂盒在实时荧光定量PCR仪上进行扩增。扩增体系为:TB Green Premix Ex Taq Ⅱ 12.5 μL,PCR forwardPremix 和PCR Reverse Premix 各1 μL,ROXReference Dye 0.5 μL,cDNA 2 μL,无菌无酶水8μL。反应条件为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃延伸30 s,40 个循环;95 ℃变性5 s,60 ℃延伸1 min,95 ℃。
1.2.8 数据统计 以对照基因β-actin 归一化处理试验数据,采用2-△△Ct法分析4种免疫基因在肾脏、肝脏和脾中相对表达量的变化,运用SPSS 23和GraphPad Prism 8.0软件對试验数据进行统计学分析和制图。
1.2.9 血清抗体效价的测定 对免疫12 h和1、3、7、14、21、28 d的珍珠龙胆石斑鱼进行取血,将抽出的血加入离心管中,于4 ℃冰箱倾斜静置30 min,将自然析出的血清加入离心管在4 ℃冰箱暂存。使用96孔V型血凝板测定免疫血清抗体效价,每孔加入100 μL PBS,将血清加入第1个孔与PBS吹打混匀,再吸出100 μL与下个孔的PBS混匀,以此类推达到2倍稀释的效果,最后加入1×108 CFU·mL-1的鰤鱼诺卡氏菌菌液与血清充分混匀,用血凝板专用膜密封,放置37 ℃恒温培养箱孵育1 d后观察。
2 结果与分析
2.1 安全性试验结果分析
不同含量的福尔马林在各个时间的灭活情况如表2所示,福尔马林含量为0.1%~0.2%,24 h依旧未能达到灭活效果;福尔马林含量为0.5%,30 min就可以达到灭活。采用灭活时间较短、福尔马林占菌液体积较少的作为试验灭活疫苗,最终选用福尔马林含量0.4%、灭活4 h的作为试验用疫苗。
2.2 血清抗体凝集效价的测定结果分析
由图1可知,免疫组的抗体效价明显升高,且免疫组比对照组变化显著(P<0.05),免疫3 d后可以检测到抗体,抗体效价为1∶16,在免疫21 d时达到高峰,抗体效价最高可达到1∶256,抗体水平在21 d内呈上升趋势,21 d后开始下降。
2.3 免疫基因在组织中的表达分析
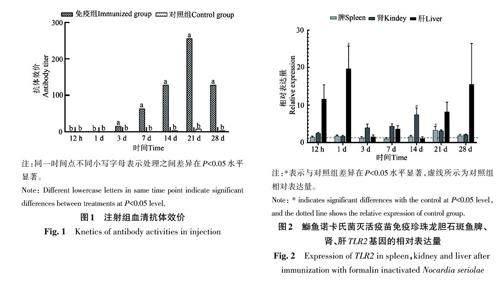
2.3.1 TLR2 免疫基因在肾脏、肝脏和脾中的表达 由图2可知,免疫期间,TLR2 基因的表达量在脾、肾脏和肝脏中均上升。肝脏中,TLR2 基因的表达量从12 h开始出现较大幅度的上调,到1 d时达到最高峰,是对照组的19.64倍,在7 d达到第2个峰值,是对照组的3.64倍,在21~28 d出现较大幅度的上调,在28 d时达到第3个峰值,是对照组的15.53 倍。在脾中,TLR2 基因的表达量在12 h至21 d之间变化不明显,在21 d时达到峰值,是对照组的3.32倍,21 d后表达量下降,但28 d时的表达量仍高于对照组,是对照组的1.8倍,基因相对表达量呈现上升-下降的趋势。肾脏中,TLR2 基因的表达量在12 h时达到第1个峰值,是对照组的2.45倍,在14 d时达到最高峰,是对照组的7.39倍,随后表达量下降,28 d时的表达量是对照组的2.07倍。以上结果表明,通过注射的方式进行免疫,在不同的组织中TLR2 基因都有明显的升高,并且肝组织中的TLR2 基因上调量要高于其他组织。
2.3.2 MyD88 免疫基因在肾脏、肝脏和脾中的表达 由图3可知,免疫期间,脾中MyD88 基因的表达量在1 d时达到最高峰,是对照组的5.69倍,在21 d时达到第2个峰值,是对照组的2.16倍, 在其他时间段基因上调、下调趋势不明显。肾脏中,MyD88 基因的表达量在1 d时达到第1个峰值,是对照组的2.79倍,从1 d开始基因表达量都比较高,在21 d时达到最高峰,是对照组的3.60倍。肝脏中,MyD88 基因的表达量在12 h时达到第1个峰值,是对照组的1.89倍,在7 d时达到第2个峰值,是对照组的2.77倍,在21 d时达到最高峰,是对照组的5.91倍,在其他时间点的MyD88 表达量均出现增长。以上结果说明,通过注射的方式进行免疫,在脾、肾脏和肝脏组织中MyD88 基因的表达量都有明显的升高,并且脾和肝脏组织的基因表达量上调的比较高。
2.3.3 IL-1β 免疫基因在肾脏、肝脏和脾中的表达 由图4可知,免疫期间,脾中IL-1β 基因表达量从1 d开始出现上调,到3 d时达到第1个峰值,是对照组的2.42倍,到21 d时达到最高峰,是对照组的5.69倍,在28 d时基因表达量对比对照组无明显上调。肾脏中,IL-1β 基因的表达量在7 d之前未出现明显上调或下调,在7 d时达到峰值,是对照组的6.34倍,随后基因表达量减少,在21 d时出现第2 个峰值,是对照组的1.85 倍。肝脏中,IL-1β 基因的表达量在1 d时出现第1个峰值,是对照组的2.06倍,基因表达量呈上调的趋势,到7 d时达到最高峰,是对照组的4.90倍,21、28 d基因的相对表达量开始出现下调的趋势,分别是对照组的0.24、0.15倍。以上结果说明,通过注射的方式免疫,IL-1β 基因表达量在各个组织都出现上调,肾脏和肝脏的IL-1β 基因表达量均高于脾。
2.3.4 TNF-α 免疫基因在肾脏、肝脏和脾中的表达 由图5可知,免疫期间,脾中TNF-α 的基因表达量在12 h出现第1个峰值,是对照组的0.45倍,在3 d时基因表达量下降到最低峰,是对照组的0.2倍,28 d时基因表达回归正常水平。肾脏中,TNF-α 基因的表达量在1 d时达到第1个峰值,是对照组的12.39倍,在28 d时达到最高峰,是对照组的12.41倍,其余时间段基因表达均上调,并且都是对照组基因表达量的2 倍以上。肝脏中,TNF-α 基因的表达量在12 h时出现下调,是对照组的0.29 倍,在3 d 时达到最高峰,是对照组的5 倍,在28 d 时达到第2 个峰值,是对照组的2.45倍。以上结果说明,通过注射的方式进行免疫,TNF-α 基因的表达量在肾脏中都出现上调,在脾中TNF-α 基因的表达量出现了下调,在肝脏中基因表达量先下调后上调。
3 讨 论
3.1 疫苗的免疫效果分析
本研究制备了鰤鱼诺卡氏菌福尔马林灭活疫苗,为防止鰤鱼诺卡氏菌抱团生长导致细菌逃离灭活,对福尔马林灭活时间、加入量进行调整,最终确定0.4%的福尔马林灭活4 h后的疫苗具有安全性;将鰤鱼诺卡氏菌灭活疫苗使用腹腔注射的方式接种珍珠龙胆石斑鱼,通过血清抗体效价发现,免疫3 d后鱼体内开始生成抗体,免疫21 d时抗体达到高峰,随后呈下降趋势,说明本试验中的灭活疫苗可对珍珠龙胆石斑鱼提供较好的保护性,与解俊等[8]研究结果一致。
灭活疫苗由于制备工艺简单、廉价、效果明显等特性,近年来得到广泛的研究,腹腔注射是灭活疫苗接种的主要方式,并已得到证实接种效果优于口服、浸泡等方式[9]。本研究通过注射福尔马林灭活疫苗,分析肾、脾和肝脏3个组织中免疫基因的实时表达量,发现均有上调,说明该疫苗对珍珠龙胆石斑鱼免疫系统增强及实现良好免疫保护具有重要作用,能提升珍珠龙胆石斑鱼的免疫保护,有效抵御鰤鱼诺卡氏菌感染。本研究中开发的针对鰤鱼诺卡氏菌的福尔马林灭活疫苗可在珍珠龙胆石斑鱼中诱发免疫应答。
3.2 TLR 通路中2 种免疫基因的表达分析
硬骨鱼通过TLR2 识别人工合成的脂肽、微生物源的PGN和脂蛋白后,通过MyD88 信号传导途径,诱导NF-kB 活化并产生各种炎症因子,如IL-1β、TNF-α等。在炎症反应中,最先产生TNF-α,随后产生的是IL-1β,接着它们调节各种趋化因子的产生,诱导中性粒细胞和巨噬细胞迁移到感染的部位[6]。有学者使用爱德华氏菌感染牙鲆,发现TLR2 在肾脏、肝脏和脾的基因表达量都有提高,肝脏的TLR2 表达量在所有组织中最高[10]。本研究中,试验组的肾脏、肝脏和脾中基因在12 h时表达量都上调,肝脏中TLR2 基因在12 h至1 d时表达量上调较高,但在肾脏和脾上却未出现显著的变化,随后才出现显著上调,在珍珠龙胆石斑鱼的肝脏、肾脏和脾的基因表达量显著升高,表明当鱼体内出现较高数量的革兰氏阳性菌时,会刺激鱼体内免疫基因TLR2 的上调,从而引发鱼体内巨噬细胞的增加。本研究发现,TLR2 基因表达量在肝脏组织的细胞密度明显高于肾脏和脾,表达量的上调诱发巨噬细胞的产生,吞噬灭活的鰤鱼诺卡氏菌,产生抗体。TLR2 免疫基因在肝脏12 h至1d时表达量上调较高,肾脏和脾分别是在3 和21 d表达量上调较高,可能是鰤鱼诺卡细菌首先作用于鱼的肝脏,再作用其他组织,由肝脏的巨噬细胞随着血液转移到了肾脏和脾,导致肾脏和脾的TLR2 免疫基因数量变化不明显。
MyD88 基因的表达可能受所涉及的刺激物和物种的调控而有所不同,TLR引起的所有信号途径大多都涉及到MyD88,MyD88在TLR引起的信号途径中发挥着重要的作用。在配体结合到TLRs之后,TLRs二聚化后构象发生变化有利于招募胞內TIR结构域的接头分子,依赖MyD88的信号传导通路或依赖TRIF 的信号传导通路,在MyD88的信号传导通路,MyD88是第1个被发现的接头分子,导致下游信号级联的触发和促炎细胞因子和趋化因子的产生[6]。薛洁等[11]研究发现,鳗弧菌灭活疫苗免疫后牙鲆后其脾中MyD88 基因在1 d时表达量达到最高,是对照组的5.52倍,而后逐渐下降;韦光本[12]用哈维氏弧菌灭活疫苗注射珍珠龙胆石斑鱼发现,免疫基因MyD88 在肝脏组织中第21 d相对表达量达到峰值,在肾脏中第28 d相对表达量达到峰值。本研究中,MyD88基因在肝脏中12 h时表达量开始上调,上调量并没有免疫基因TLR2 上调量高,可能是大量免疫TLR2通过TRIF的信号传导通路与TLR6形成异源二聚体。在肾脏和脾中,MyD88 基因在1 d后开始上调,与上述学者[1112]研究结果相似。脾中的MyD88 基因在1 d时表达量达到最高,肾脏的MyD88 基因在1~21 d时基因表达量都较高,在肾脏和脾中MyD88 基因表达量的增长与TLR2 不同,可能是由于在MyD88通路中,接种鰤鱼诺卡氏菌疫苗后相对应的TLR1、TLR4、TLR5 等基因也出现上调,由于MyD88 基因也是TLR1、TLR4、TLR5 等基因的接头基因,导致MyD88 基因上调。
3.3 细胞因子基因的表达分析
IL-1β已经在许多鱼类中被发现,但其功能主要集中在炎症反应中,IL-1β及其受体作为先天免疫和炎症的中心媒介,在细菌感染中发挥重要作用。抗原攻击会导致IL-1β 的转录水平快速上调,因此常被认为是免疫激活的发生信号[13]。Huang等[14]研究发现,通过灭鲑气单胞菌感染斜带石斑鱼,通过ahr1a 和ahr1b 的表达,与巨噬细胞ROS产生相关的基因(IL-1β)被下调,表明灭鲑气单胞菌利用其毒力机制控制和阻止巨噬细胞的产生(说明IL-1β是由ahr1a和ahr1b介导的);Ho等[15]研究注射鰤鱼诺卡氏菌的大口黑鲈发现,在细菌感染的3~5 d,脾脏和肾脏中IL-1β 的表达显著升高;也有研究表明,IL-1β 基因在肾脏、肝脏和脾有較高的表达,用鰤鱼诺卡氏菌对乌鳢进行免疫试验,脾组织中的IL-1β 基因表达在1 d 时达到峰值[16]。本研究中,在免疫过程中IL-1β 基因在脾组织中上调,在3、21 d达到峰值,肾脏中在7 d时达到峰值,说明接种疫苗后珍珠龙胆石斑鱼出现了炎症反应,通过腹腔注射鰤鱼诺卡氏菌,肝脏和脾中IL-1β 基因表达量在1 d时开始上调,IL-1β通过激活多种反应发挥其对感染的保护作用,使中性粒细胞快速募集到肝脏和脾的炎症部位,内皮粘附分子的激活,细胞因子和趋化因子的诱导,发热反应的诱导,以及刺激适应性免疫,组织肝脏中在14 d过后出现下调,可能是由于在7~14 d的中性粒细胞高度募集,致使鱼体内出现抑制IL-1β 基因的表达,以此保护鱼体组织,防止出现损伤,与Ho等[15]等研究结果一致。
TGF-β 在胸腺、头肾和脾脏中高度表达,可以促进鱼类淋巴细胞的增殖[17]。TNF-α是一种重要的细胞因子,调控细胞因子的合成及释放,在鱼的免疫过程中起的重要作用,TNF-α在免疫反应中的作用具有双面性,当其表达适量时,能够施展正向的免疫功能,抵御外部物质的入侵,参与炎症反应,但当其转录水平过高时,发挥的免疫功能会对机体形成损伤,从而致使发生病理反应[18]。在本研究中,肾脏中TNF-α 基因的相对表达量在1、28 d时较高,与韦光本[12]的研究结果一致;在脾组织中7 d时TNF-α 基因出现明显下调,可能该时间点出现降解,导致表达量的下降,通过整体分析,在注射疫苗后,宿主免疫系统可以维持在高水平状态。
参 考 文 献
[1] TANEKHY M, MATSUDA S, ITANO T, et al .. Expression of
cytokine genes in head kidney and spleen cells of Japanese
flounder (Paralichthys olivaceus) infected with Nocardia
seriolae [J]. Vet. Immunol. Immunop., 2010, 134(3-4): 178-183.
[2] ELKESH A, KANTHAM K, SHINN A P, et al .. Systemic
nocardiosis in a Mediterranean population of cultured meagre,
Argyrosomus regius Asso (Perciformes: Sciaenidae) [J]. J. Fish
Dis., 2013,36(2): 141-149.
[3] 袁思平,王国良,金珊.海水网箱养殖大黄鱼诺卡氏菌病及防
治[J].水产科学,2005,24(9):35-36.
YUAN S P, WANG G L, JIN S. Nocardiosis in large yellow
croakers Pseudosciaena crocea cultivated in net cages [J]. Fish.
Sci., 2005,24(9):35-36.
[4] 肖慧,李军,王祥红,等.鲈鱼鳗弧菌病疫苗的制备及免疫防
治效果[J].青岛海洋大学学报, 2003,33(2):226-232.
XIAO H, LI J, WANG X H, et al .. Preparation of vaccine
against vibriosis of sea perch (Lateolabrax japonicus) and its
immune efficiency evaluation [J]. J. Ocean Univ. Qingdao,
2003,33(2):226-232.
[5] ROSS A J, KLONTZ G W. Oral immunization of rainbow trout
(Salmo gairdneri) against an etiologic agent of “redmouth
disease” [J]. J. Fish. Board Canada, 1965, 22(3): 713-719.
[6] 韦友传. 斜带石斑鱼TLR1、TLR2 和MyD88 基因的克隆与
免疫应答研究[D]. 南宁:广西大学, 2011.
WEI Y C. Molecular cloning and immunoresponse of TLR1,
TLR2 and MyD88 genes in Epinephelus coioides [D]. Nanning:
Guangxi University, 2011.
[7] PARK K C, OSBORNE J A, TSOI S C M, et al .. Expressed
sequence tags analysis of Atlantic halibut (Hippoglossus
hippoglossus) liver, kidney and spleen tissues following
vaccination against Vibrio anguillarum and Aeromonas
salmonicida [J]. Fish Shellfish Immun., 2005, 18(5): 393-415.
[8] 解俊,彭程遠,金珊,等.灭活鱼诺卡氏菌对乌醴非特异性免
疫指标的影响[J].渔业科学进展,2013,34(4):71-76.
XIE J, PENG C Y, JIN S, et al .. Effects of inactivated Nocardia
seriolae on the nonspecific immune indexes of Channa argus [J].
Progress Fish. Sci.,2013,34(4):71-76.
[9] 姚欢,黄郁葱,蔡双虎,等. 眼斑拟石首鱼烂尾病病原菌的分
离鉴定及灭活疫苗的免疫效果[J]. 广东海洋大学学报,2016,
36(4):37-44.
YAO H, HUANG Y C, CAI S H, et al .. Isolation and
identification of bacterial pathogens from Sciaenops ocellatus
with tail-rotted disease and evaluation of immune efficacy of
inactived vaccine [J]. J. Guangdong Ocean Univ.,2016,36(4):
37-44.
[10] ZHU Y, LI S, SU B F, et al .. Genome-wide identification,
characterization, and expression of the Toll-like receptors in
Japanese flounder (Paralichthys olivaceus) [J/OL]. Aquaculture,
2021, 545: 737127 [2022-07-10]. https://doi.org/10.1016/j.
aquaculture.2021.737127.
[11] 薛洁,宋晓青,邢婧,等. 牙鲆注射免疫鳗弧菌灭活疫苗后13
种免疫相关基因表达的变化[J]. 中国海洋大学学报,2016,
46(2):42-53.
XUE J, SONG X Q, XING J, et al ..Expression analysis of thirteen
immune related genes of flounder (Paralichthys olivaceus)
vaccinated with formalin-inactivated Vibrio anquillarum [J].
Periodical Ocean Univ. China, 2016,46(2):42-53.
[12] 韦光本. 哈维氏弧菌灭活疫苗糖类佐剂的筛选及其对珍珠
龙胆石斑鱼免疫保护的研究[D]. 湛江:广东海洋大学,2020.
WEI G B. Screening for saccharide adjuvants of Vibrio Harveyi
inactivated vaccine and its immunological protection on pear
gentian grouper [D]. Zhanjiang: Guangdong Ocean University,
2020.
[13] 于燕. 半滑舌鳎(Cynoglossus semilaevis)TLR9 及其信号传导
相关基因的克隆与表达[D].青岛:中国海洋大学, 2009.
YU Y. Isolation and characterization of TLR9,MyD88,IRAK4
and IL-1β in half-smooth tongue sole Cynoglossus semilaevis
[D]. Qingdao: Ocean University of China,2009.
[14] HUANG L X, QI W L, ZUO Y F, et al .. The immune response
of a warm water fish orange-spotted grouper (Epinephelus
coioides) infected with a typical cold water bacterial pathogen
Aeromonas salmonicida is AhR dependent [J/OL]. Dev. Comp.
Immunol., 2020, 113: 103779 [2022-07-10]. https://doi.org/
10.1016/j.dci.2020.103779.
[15] HO P Y, BYADGI O, WANG P C, et al .. Identification,
molecular cloning of IL-1β and its expression profile during
Nocardia seriolae infection in largemouth bass, Micropterus
salmoides [J/OL]. Int. J. Mol. Sci., 2016, 17(10): 1670[2022-07-
10]. https://doi.org/10.3390/ijms17101670.
[16] CUI Z W, KONG L L, ZHAO F, et al .. Bacteria-induced IL-1β
and its receptors in snakehead (Channa argus): evidence for
their involvement in antibacterial innate immunity [J]. Fish
Shellfish Immun., 2020, 100: 309-316.
[17] ITANO T, KAWAKAMI H. Drug susceptibility of recent
isolates of Nocardia seriolae from cultured fish [J]. Fish
Pathol., 2002, 37(3): 152-153.
[18] TRACEY K J, LANE F, HILKENS C M. Introduction of
tolerance by TNF-treated dentritic cells [J]. Lancet, 1990, 8648(1):
1721-1728.
(責任编辑:胡立霞)
