慢性阻塞性肺疾病相关影响因素及炎症因子表达
2024-05-10刘惟优高艳芳毛霜霜周兴业李晨薇张小康
黄 磊,刘惟优,高艳芳,林 芬,毛霜霜,周兴业,李晨薇,张小康
(1.赣南医科大学公共卫生与健康管理学院;2.赣南医科大学第一附属医院呼吸内科,江西 赣州 341000)
慢性阻塞性肺疾病诊治指南(2021年修订版)指出慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是一种常见的、可预防和可治疗的慢性呼吸道疾病,其病理变化主要表现为气道和肺泡异常[1]。我国COPD患病率普遍高,40岁以上人群COPD患病率高达13.7%,是严重的疾病负担和人群健康威胁[2]。目前已知COPD发病因素众多,其中环境因素发挥着重要作用,主要包括吸烟、接触职业粉尘和化学物质、空气污染、社会经济状况等,且区域间发病率存在显著差异[3-4]。不同区域慢性阻塞性肺疾病发病率的差异可能与生活习惯、经济条件、环境污染、人口结构、遗传、文化水平等因素有关。为降低COPD的发病率,需正确认识COPD的各种危险因素,并加以防治[2,5]。
研究证实炎症参与了COPD的发生、发展及恶化,COPD患者肺部有炎症细胞的激活,并释放炎症细胞因子,促进气道炎症的发展,最终造成机体肺血管、肺实质与气道等部位出现慢性炎症[6-8];白介素8(Interleukin 8, IL-8)、白介素10(Interleukin 10,IL-10)及肿瘤坏死因子α(Tumor necrosis factor α, TNF-α)等多种炎症因子可能参与了COPD病情发展[9]。且炎症反应并不仅局限于患者肺部,也可经血液循环引起全身炎症反应[10-11]。
基于上述情况,本研究采用病例对照研究方法探讨赣州市COPD的危险因素,为制定个性化临床COPD的预防及治疗方案提供思路。
1 对象与方法
1.1 研究对象选取赣南医科大学第一附属医院呼吸内科2020年6月至2020年12月住院的COPD患者作为病例组,共计67例,其中男47例,女20例,年龄22~86岁,平均(57.28±14.93)岁;选择同期在医院体检中心检测且无呼吸系统疾病体检者作为对照组,共计72例,其中男30例,女42例,年龄40~79岁,平均(54.35±9.00)岁。纳入标准:①符合2021年COPD诊断标准;②男女不限;③精神状态正常;④近期无手术或外伤;⑤签署知情同意书。排除标准:①恶性肿瘤患者;②其他呼吸系统疾病患者;③有其他重大疾病患者;④严重精神疾病患者;⑤依从性差者。本研究经学校及医院伦理委员会批准。
1.2 调查问卷本研究小组通过编制COPD危险因素调查表,首先对小部分人进行预调查,根据结果对问卷进行修改,最后对目标人群进行了全面调查。该问卷主要包括3个方面:①一般人口学资料:姓名、性别、年龄、婚姻状况、教育程度、家庭月平均收入等;②职业史:目前职业状况、当前每日工作时间、所从事工作是否进行户外劳作、粉尘接触史、化学物接触史等;③生活方式:吸烟史、被动吸烟、饮酒史、肉蛋食用频率、锻炼、睡眠质量、室内空气污染物接触情况等。
1.3 炎症指标测定随机从病例组和对照组分别抽取58、18例研究对象采集血清标本。病例组采集住院后未治疗首次抽取的空腹静脉血5 mL,对照组于体检科抽取空腹静脉血5 mL,所有标本在室温下静置30 min,离心10 min(3 500 rpm·min-1),取上清液放在-80 ℃冰箱中保存。用酶联免疫法(ELISA)检测TNF-α、IL-8、IL-10、GM-CSF、MCP-1等指标。
1.4 个人信息的资料收集和质量控制正式调查前对调查员进行统一培训,根据纳入与排除标准,选定目标人群,由专业调查员向研究对象介绍本次调查研究目的和填写问卷所需注意事项。问卷采用面访调查法,调查者逐一阅读并解释每个问题,由调查员填写患者的答案。现场派发调查表,现场核查,确认无误后再收回保存,调查结束后对不合格问卷尽可能补差。
1.5 统计学处理采用Epidata 3.1进行问卷数据双录入与核对,运用SPSS 26.0软件进行统计分析。对于符合正态分布的定量资料,使用均数±标准差表示,两组间比较采用t检验,等级资料、不符合正态分布的采用Mann-Whitney U检验;对于定性资料,使用n(%)进行描述,两组间比较采用χ2检验。以是否患COPD(是=1,否=0)为因变量,将P<0.05的因素作为自变量纳入多因素Logistic回归分析。检验水准α=0.05。
2 结果
2.1 2组一般人口学特征比较与对照组相比,病例组男性占比更高、家庭月平均收入<2 000元比例更多、职业状况以未就业为主,差异有统计学意义(P<0.05),但2组年龄和教育程度方面差异无统计学意义(P>0.05)(表1)。

表1 2组一般人口学资料比较
2.2 COPD影响因素的单因素分析在所有调查对象中,总吸烟率为31.7%,其中病例组吸烟率为40.30%,对照组吸烟率为23.61%,差异有统计学意义(P<0.05)。病例组中被动吸烟率高于对照组被动吸烟率,但差异无统计学意义(P>0.05)。病例组中锻炼人数占比低于对照组,居住在公路旁人数占比高于对照组,差异有统计学意义(P<0.05)。2组肉蛋食用频率、睡眠时间和睡眠质量比较差异均有统计学意义(P<0.001),而接触有害物差异无统计学意义(P>0.05)(表2)。

表2 影响COPD患病的单因素比较/n
2.3 COPD影响因素的多因素Logistic回归分析将P<0.05的变量纳入多因素Logistic回归模型,模型筛选采用逐步回归法。家庭月平均收入低(OR=5.126,95%CI:2.113~12.435)、吸 烟(OR=4.103,95%CI:1.113~15.122)和睡眠时间短(OR=27.279,95%CI:7.486~99.409)是COPD患病的独立危险因素,睡眠质量好(OR=0.128,95%CI:0.042~0.395)为COPD患病的独立保护因素(表3)。
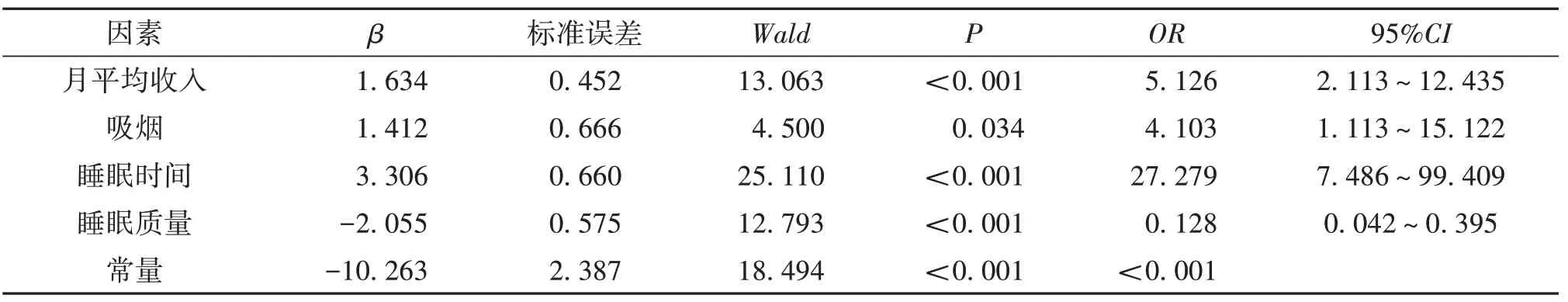
表3 影响COPD患病的多因素Logistic回归分析
2.4 炎症因子比较病例组外周血血清中TNF-α、IL-8、MCP-1水平明显高于对照组,差异均有统计学意义(P<0.05);病例组IL-10、GM-CSF水平高于对 照组,但差异无统计学意义(P>0.05)(表4)。
表4 2组血清炎症因子水平比较/ng·m L-1,±s

表4 2组血清炎症因子水平比较/ng·m L-1,±s
注:Z样本不全满足正态性,使用Mann-Whitney U检验。
组别病例组对照组ZP n 58 18 TNF-α 79.21±18.56 68.95±12.15-2.053 0.040 IL-8 15.69±11.33 9.93±6.10-2.629 0.009 IL-10 6.23±6.52 4.56±3.42-1.035 0.301 GM-CSF 2.70±2.57 1.83±1.10-0.851 0.395 MCP-1 28.41±16.59 19.61±8.07-2.114 0.035
3 讨论
慢性阻塞性肺疾病是我国人群死亡的第3大原因,对人体健康造成巨大危害。COPD患者常表现为咳嗽、咳痰、呼吸困难等症状,生活质量严重下降。全球COPD患病率及死亡率均呈上升趋势,40岁以上人群具有较高的患病风险,且随着年龄增加患病率也增加[2]。COPD的病因复杂,且每个地区影响COPD的危险因素不完全相同。为了有效地预防和治疗COPD,在赣州地区进行科学细致的流行病学调查,收集可靠的数据进行分析,可为今后的防治工作提供参考。
本次研究共纳入67例COPD患者,病情均处于临床发病期,值得注意的是有2例属于年轻群体,仅22岁,其他65例均在37岁以上。调查研究提示40岁以上患病率更高,但年轻群体也不能忽视。2018年研究显示年轻群体中20岁及以上人群的患病率也达到8.6%[2]。因此,年轻群体接触有关危险因素亦可导致COPD的发生。
对问卷数据进行整理分析发现,病例组和对照组人群在性别、家庭人月平均收入、职业情况、吸烟、锻炼、肉蛋食用频率、睡眠时间、睡眠质量等方面差异有统计学意义(P<0.05)。将以上因素进一步行多因素Logistic回归分析发现家庭月平均收入低、吸烟、睡眠时间短是COPD的危险因素,而睡眠质量好是COPD的保护因素。
2021年COPD防治指南中表明,COPD最重要的危险因素是吸烟,70%~80%的COPD发生都与吸烟有关[1]。香烟含有焦油、尼古丁、氢氰酸等化学物质,会引起上气道上皮细胞和纤毛活动受影响,从而增加支气管黏膜的杯状细胞增生,清除能力降低,同时也会增加自由基,破坏肺部弹性纤维,最终引起肺气肿,导致COPD[11]。本研究结果也表明,吸烟与COPD患病密切相关,吸烟与不吸烟者的患病率存在显著差异,吸烟人群患COPD的概率远高于不吸烟人群。吸烟开始年龄越早、吸烟越多、吸烟时间越长,COPD患病率越高,戒烟后肺功能下降减慢、病情发展减慢,COPD急性加重次数减少,死亡率也下降[12]。张小娥等[13]研究发现,男性COPD患病率高于女性,但两性间比较,女性吸烟的危害性远大于男性,孕妇吸烟或被动吸烟都可导致胎儿发育障碍、畸形或其他健康问题,因此戒烟显得尤为重要。
本研究显示,家庭月平均收入高可能是COPD的保护因素。张森等[14]研究发现低经济水平是COPD发病的独立危险因素。经济状况在影响COPD发病风险方面扮演着重要角色。国内流行病研究发现,COPD患病的危险性高低可能与家庭收入水平的高低呈负相关,收入较低的个体患COPD的危险性越高[15]。目前COPD与较差的经济状况二者之间的关系尚不明确,但是与较差的经济状况和贫困相关因素,如人均居住面积过小、居住环境空气质量差、空气污染、医疗保健水平低、营养不良、免疫功能低下等在一定程度上可能和COPD的发生有关[13,16]。
COPD患者中超过60%都存在营养不良,营养不良会引起肺表面活性物质和肺弹性纤维减少,使肺的顺应性下降,从而使空气流通受到限制,加速COPD的发生和发展[17]。由于食欲不振,导致患者各方面饮食摄入少,进而导致体重下降。研究显示,营养不良可使患者的运动耐力下降,住院时间延长,患者的营养状况与COPD的发病关系密切[18]。本研究病例组与对照组之间肉蛋食用频率差异有统计学意义(P<0.05)。可能是患者在患病后更主动地摄入营养物质,以提高机体免疫水平。
良好的睡眠质量可以较好地提高身体免疫力,维持机体正常的生理活动,有益于机体健康。而睡眠质量差、睡眠障碍等影响COPD患者的精神状态和身体免疫力[19]。因呼吸困难,COPD患者有缺氧症状,患者夜间苏醒次数增多,导致患者睡眠质量不佳[20]。本研究结果显示,病例组与对照组间睡眠时间和睡眠质量有差异,睡眠时间短、睡眠质量差可能是COPD的危险因素。这说明提高睡眠质量对于COPD防治有一定的积极作用。
炎症反应贯穿整个COPD的疾病过程,在COPD发生发展的过程中起重要作用。患者接触一些有害因素刺激气道和肺部,肺部炎症细胞活化,释放出中性粒细胞、T细胞、巨噬细胞等多种炎症细胞因子。TNF-α是人体重要免疫反应和炎症反应的介质,与感染密切相关,具有局部杀伤、浸润、吞噬病原体、诱导中性粒细胞趋化等作用,引发炎症反应。IL-8是由巨噬细胞和上皮细胞分泌的一种细胞因子,可趋化、活化中性粒细胞并释放炎症递质,对支气管造成损害,加剧炎症反应[21]。GM-CSF是一种重要的抗炎指标,其主要功能是维持单核-巨噬细胞的生长、增殖和分化。COPD患者血清GM-CSF水平高于健康体检者,其主要原因可能是机体免疫应激时激活淋巴细胞,使GM-CSF的表达增加[22]。MCP-1是CC趋化因子家族中一种细胞因子,同时是巨噬细胞的特异性趋化因子,它与COPD气道炎症反应有一定关联。本研究结果显示病例组血清中TNF-α、IL-8、MCP-1水平均高于对照组,这与大多数研究结果相同[21,23]。TNF-α、IL-8、GM-CSF和MCP-1都是与炎症反应密切相关的生物学分子,在免疫系统中发挥重要作用,促进炎症过程中的细胞招募、增殖和活化。高水平的这些因子可能会导致免疫细胞在气道内聚集和活化,从而引发炎症反应,对肺有一定的损伤作用,因此检测COPD患者炎症因子TNF-α、IL-8、GM-CSF、MCP-1等指标对疾病发病机制和进展有一定的参考价值,可以根据这些炎症指标进行临床治疗研究。
本次研究旨在研究赣州市慢性阻塞性肺疾病患者的患病危险因素以及其血清炎症因子水平的表达情况。通过开展调查问卷和收集血样收集数据并进行分析,为本地区COPD的防治和干预提供参考依据。然而,需要注意的是,本研究的样本容量有限,可能无法涵盖所有可能的情境。因此,结果可能不具备广泛的代表性,而应谨慎解释和推广,未来还需要开展更大规模的研究来进一步检验本研究结果。
