常州地区水产养殖中地西泮残留检测及来源分析
2024-05-10殷雪琰王洁琼王雨晴刘笑来青继翟云忠
殷雪琰,王洁琼,王雨晴,刘笑,来青继,翟云忠
(1.常州市农产品质量安全中心,江苏 常州 213002;2. 常州大学环境科学与工程学院,江苏 常州 213002)
地西泮(Diazepam,DZP)俗称安定,是苯二氮卓类药物之一,是临床中比较常用的镇静催眠和抗焦虑药物[1-2],主要用于改善病人睡眠、对抗焦虑、缓解抑郁等[3-4],人体长期服用会产生药物依赖性和耐药性[5]。DZP在动物体内残留后通过食物链富集转移到人体,残留周期长[6],最终危害人体健康[7-8]。GB 31650—2019《食品安全国家标准 食品中兽药最大残留限量》[9]中规定,DZP允许作治疗用、不得在动物性食品中检出。中国规定DZP在水产养殖过程中不得使用[10]。
农业农村部《2022年国家产地水产品兽药残留监控计划》新增了DZP在水产品中残留监测指标,标志着国家对水产品质量监管的进一步加强。2022年7月农业农村部发布《关于监督抽查发现的27批次问题农产品情况的通告》[11],有18批次问题样品属于水产品,16批次问题水产样品中检出DZP残留,涉及青鱼(Mylopharyngodonpiceus)、鳊(Parabramispekinensis)、草鱼(Ctenopharyngodonidella)、鲫(Carassiusauratus)等淡水鱼品种。
目前,DZP的检测方法主要有高效液相色谱法(HPLC)[4]、高效液相色谱-串联质谱法(HPLC-MS/MS)[5]和气相色谱-串联质谱法(GC-MS/MS)[12]等。其中 HPLC-MS/MS因其灵敏度高、选择性强及定量准确,成为分析方法的首选。DZP在水产品中检出频次较高[13-15],但对于水产品中DZP残留是来源于水产养殖、水产运输、休闲垂钓或是养殖水体污染等没有明确的相关研究报道。为摸清常州地区水产品中DZP的来源,本研究建立了在线净化-液相色谱串联质谱法,对本地水产养殖中使用的饲料,垂钓中饵料、窝料和诱鱼剂,养殖水体和相应水体中水产品进行DZP的残留检测。在关注水产品中DZP残留量的同时,探讨DZP的可能来源,从源头排查隐患来保障水产品的质量安全。
1 材料与方法
1.1 材料与仪器
TSQ Quantum Ultra三重四极杆液质联用仪(美国ThermoFisher公司),Turboflow在线样品前处理设备(美国ThermoFisher公司),5804R冷冻离心机(德国Eppendorf公司),涡旋混合器(美国Talboys公司),纯水仪(美国Millipore公司),氮吹仪(美国Organomation公司),KS501 振荡器(德国IKA公司)。
甲醇和乙腈(色谱纯,美国Supelco公司),实验用水为超纯水,PTFE滤膜(0.22 μm,上海安谱试验科技股份有限公司),HLB固相萃取柱(500 mg,10 mL,上海安谱试验科技股份有限公司)。
DZP(100 μg/mL,纯度99.5%,南京钝肯科学器材有限公司)和DZP-D5(100 μg/mL,纯度98.7%,南京钝肯科学器材有限公司),以甲醇为溶剂,将DZP和DZP-D5标准品分别配制成浓度为10 μg/mL的标准储备液,在-20 ℃条件下储存。用50%甲醇水溶液将DZP标准储备液逐级稀释成适当浓度的标准工作液使用。用50%甲醇水溶液将DZP-D5标准储备液稀释成适当浓度的工作液,按一定体积加入不同浓度DZP工作液中作内标,现用现配。
1.2 样品采集
在常州不同养殖场采集养殖用饲料7份,形状为颗粒状,将其研磨成粉状备用;从本市不同休闲垂钓场收集垂钓者垂钓中使用窝料和饵料,种类适用于各种淡水鱼类的垂钓,形态主要有颗粒、干粉、湿粉等共18份(窝料5份,饵料13份),均研磨成粉状备用。从渔具店购买垂钓中搭配窝料或饵料使用诱鱼剂10份,均为液体状溶液;养殖水样的采集按照HJ 494—2009《水质采样技术指导》[15]进行,在本市水产运输车和垂钓场共采集水样27份;在本市水产养殖场和垂钓场采集淡水鱼类(鳊、鲫、草鱼和青鱼等)共71份。窝料、饵料及诱鱼剂样品信息见表1。
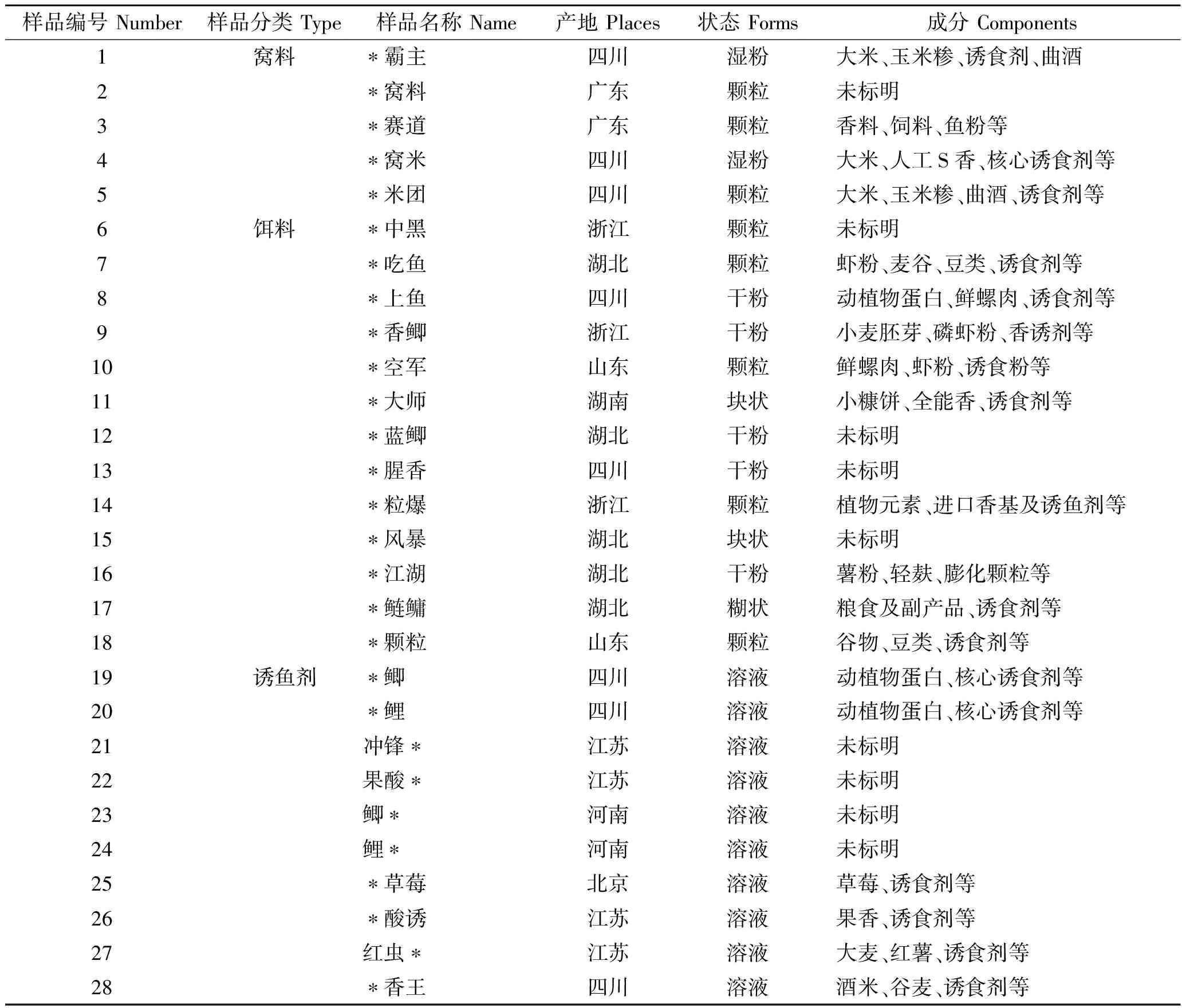
表1 窝料、饵料及诱鱼剂样品信息表Tab.1 Information of nest material, fish bait, and fish attractants
1.3 样品前处理
1.3.1 饲料、窝料及饵料
称取试样2.00 g,置于50 mL具塞离心管中,加入浓度为0.5 μg/mL DZP-D5内标20 μL,涡旋混匀后加入乙腈10 mL,置于振荡器以250 r/min 振荡提取10 min,然后 8 500 r/min离心5 min,将上清液转移至离心管中,在剩余的样品中再加10 mL提取液提取一次,合并提取液至离心管中。将离心管中上清液置于60 ℃的水浴中氮吹至近干,用1 mL 50%甲醇水溶液复溶,涡旋混匀后过 0.22 μm滤膜,收集于进样小瓶中待Turboflow在线净化后上机测定。
1.3.2 水样
取水样1.0 L用布氏漏斗和快速定性滤纸进行真空抽滤,除去水样中泥沙、悬浮物等杂质。依次用5 mL甲醇、5 mL的超纯水活化HLB 固相萃取柱,量取过滤后的水样100 mL,加入浓度为0.5 μg/mL DZP-D5内标20 μL,混合均匀后过柱上样,富集后用6 mL水进行淋洗,5 mL乙腈洗脱后置于60 ℃的水浴中氮吹至近干,用1 mL 50%甲醇水溶液复溶,涡旋混匀后过 0.22 μm滤膜,收集于进样小瓶中待Turboflow在线净化后上机测定(液体状溶液参考水样作前处理)。
1.3.3 鱼样
称取试样2.00 g,置于50 mL具塞离心管中,加入浓度为0.5 μg/mL DZP-D5内标20 μL涡旋混匀30 s,加入10 mL 1%的乙酸乙腈涡旋混匀至肉完全散开,然后在4 ℃ 8 500 r/min离心5 min,将上清液转移至离心管中。将离心管中上清液置于60 ℃的水浴中氮吹至近干,用1 mL 50%甲醇水溶液复溶,涡旋混匀后过 0.22 μm滤膜,收集于进样小瓶中待Turboflow在线净化后上机测定。
1.4 液相色谱-串联质谱方法
1.4.1 在线净化条件
在线净化系统包含净化和分离两部分,其中净化主要在Loading泵中进行,实现样品在净化柱上的净化和富集,分离在Eluting泵中进行,使净化后的化合物在分析柱上实现洗脱分离并经质谱进行分析。在线净化柱:Cyclone-P柱(0.5 mm×50 mm);流动相A为0.4%甲酸水溶液,B为乙腈,C为乙腈-异丙醇-丙酮(v/v/v=45∶45∶10);进样体积:50 μL。
1.4.2 液相条件
色谱柱:Hypersil GOLD柱(100 mm×2.1 mm,3 μm);流动相A为0.1%甲酸水溶液,B为甲醇,柱温:30 ℃;进样体积:10 μL。在线净化和梯度洗脱程序见表2。

表2 在线净化和梯度洗脱程序Tab.2 Online purification and gradient elution program

表3 DZP和DZP-D5的多重反应监测参数Tab.3 Multiple reaction monitoring (MRM) parameters for detection of DZP and DZP-D5
1.4.3 质谱条件
电喷雾离子源(ESI),正离子扫描模式,多反应监测(MRM),电喷雾电压:3 500 V,离子源温度:350 ℃,鞘气压力:40 Arb,辅助气压力:10 Arb,毛细管温度:400 ℃。
2 结果与分析
2.1 方法的建立及优化选择
DZP属于苯二氮卓类药物,由于其化学性质在乙腈、丙酮和乙酸乙酯中均有较好的溶解性。因此选择其作为提取溶剂,比较提取效果。结果发现,丙酮和乙酸乙酯除目标物外会提取出较多的杂质,干扰目标物检测。而乙腈作为提取溶剂,可以沉淀样品中蛋白质同时获得较好的提取效率,因此选择乙腈作为提取溶剂。乙腈提取目标物的同时,样品中大量的脂肪酸和磷脂类物质也被提取,通过HLB小柱和在线净化,进一步去除杂质降低干扰净化提取液。
通过比较水-甲醇、水-乙腈、0.1%甲酸水-甲醇和0.1%甲酸水-乙腈 4种流动相体系对不同基质中地西泮响应的影响。结果发现当流动相为0.1%甲酸水溶液-甲醇时地西泮的响应较好,同时也与在线净化处理后的样品溶解更好。因此选择0.1%甲酸水-甲醇作为检测的流动相。在ESI和MRM模式下,通过优化喷雾电压、离子源温度、鞘气压力、毛细管温度等质谱参数,选择离子丰度比高和干扰较小的碎片离子作为DZP的定量离子和定性离子。图3为DZP及DZP-D5优化后参数,图1为阳性样品中DZP及DZP-D5提取离子流色谱图。

图1 阳性样品中DZP(A)及DZP-D5(B)提取离子流色谱图Fig.1 Extraction ion flow chromatograms of DZP (A) and DZP-D5 (B) in samples
2.2 基质效应及方法有效性评价
基质效应(Matrix effect,ME)是指样品分析液中和目标物共流出的其他组分改变了目标物的响应值,对分析方法的重现性、准确度、灵敏度等产生影响,通常表现为基质抑制或增强效应。基质效应的计算公式是:ME=以基质匹配校准曲线斜率/纯溶剂标准曲线斜率。ME在0.8~1.2之间则认为基本无基质效应,ME在0.7以下存在基质抑制效应,在1.2以上存在基质增强效应[17]。经计算DZP在投入品、水样和水产品中基质效应均在0.8~1.2范围内(表4),可以看出DZP的基质效应不明显,在样品测定中采用溶剂曲线加内标校正的方法进行定量。

表4 饵料、水样和水产品中DZP的方法学评价Tab.4 Methodological evaluation of diazepam in fish bait, water samples, and aquatic products n=6
经方法优化后,采用50%甲醇水溶液配制 0.5、1.0、2.0、5.0、10.0、20.0 μg/L质量浓度的标准溶液,再准确加入DZP-D5内标定量,考察回收率、线性相关性、相对标准偏差(RSD)、定量限(LOQ)等方法学指标。结果表明,DZP在0.5~20.0 μg/L内线性良好,化合物的相关系数(r2)均大于 0.999;DZP在饵料、水样和水产品中的 LOQ 分别为1.0 μg/kg、0.5 μg/L、1.0 μg/kg;对DZP在空白饵料、水样和水产品中分别进行1.0 μg/kg、5.0 μg/kg和10.0 μg/kg 3个水平的加标回收实验,平行测定6次,测得待测化合物在上述3种基质中的回收率分别为 85.2%~106.5%、82.3%~108.0%、90.7%~116.0%,RSD分别为≤ 5.1%、≤4.3%、≤ 2.6%,表明该方法具有较好的准确度和精密度,满足检测方法的相关要求,具体结果见表4。
2.3 不同样品检测结果分析
对7份不同厂家生产的饲料进行DZP检测,饲料中均未检出DZP;对18份垂钓用窝料和饵料进行检测,其中12份有检出,检出率66.7%,其残留为2.2~213 090.0 μg/kg。在所有检出DZP的窝饵料中,DZP含量在1.0~100.0 μg/kg 内样品占比为41.7%;含量在100.0~1 000.0 μg/kg内样品占比为8.3%;其中50%的样品中DZP的含量超过1 000.0 μg/kg。对10份诱鱼剂(主要通过拌入窝料或饵料使用)进行检测,其100%有检出,检出浓度为637 000.0~3 471 000.0 μg/kg。对本市水产运输和垂钓塘水体共采集样品27份进行DZP检测,其中水产运输中采集水样4份,均未检出DZP,垂钓场养殖水体采样23份,100%检出DZP,浓度为0.4~9.8 μg/L。在本市4家纯水产养殖场、8家纯垂钓场及2家养殖和垂钓兼有的渔场共采集淡水鱼(鳊、鲫、草鱼和青鱼等)样品71份,其中4家纯水产养殖场采集样品13个,均未检出DZP;2家养殖和垂钓兼具的渔场(部分塘口纯养殖,部分塘口对外垂钓)共采样15份,从养殖塘采集样品11个,均未检出DZP;垂钓塘采4个样品,均检出DZP,浓度范围0.5~2.6 μg/kg;从8家纯垂钓塘采集样品43个,其中35个样品检出DZP,检出率81.2%,检出浓度为0.6~21.8 μg/kg,具体结果见表5。

表5 不同样品中DZP的检测情况Tab.5 Detection of DZP in different samples
2.4 样品中DZP残留来源分析
目前,经常出现有关水产品中DZP残留超标的相关报道,但对于DZP残留来源却一直未明确。DZP是γ-氨基丁酸激动剂受体,其主要的作用是产生神经抑制信号,从而产生镇静、催眠和抗惊厥等作用,根据DZP的作用机理,如在养殖中使用会使水产品产生行动迟缓、摄食减少、生长缓慢等不良后果,同时也没有提高抗病力或净化水环境作用,因此水产养殖中基本没有添加或使用的必要性[18],从饲料样品的检测情况也发现正规饲料厂生产的饲料中并未有DZP检出。有研究认为水产品运输过程中可能存在非法使用DZP来降低其对环境的应激反应,提高水产品成活率的情况[19],抽取了部分在水产品运输过程中常用的镇静剂检测发现,该类镇静剂主要成分为间氨基苯甲酸乙酯甲烷磺酸盐(MS-222)和丁香酚等。MS-222在水溶液中经鳃和皮肤等部位传导至鱼脑感受中枢,抑制鱼的反射和活动能力,使鱼行动迟缓、代谢降低而进入类休眠状态[20],而丁香酚是通过抑制鱼的脑皮质作用于基底神经节和小脑,最终作用于脊髓达到麻醉效果[21]。根据使用浓度的不同,在运输中使鱼达到不同的麻醉时效,适合长短途运输[22]。同时研究发现,丁香酚使用后易于从鱼体排出[23],几乎无残留且安全性较高,目前两种镇静剂在国外均被批准作为水产镇静剂使用[24]。通过添加该类镇静剂可有效降低鱼体新陈代谢活动,提高运输成活率,但其主要成分并非DZP;同时对常州地区部分运输水采样检测也未发现DZP,说明在运输过程中添加的镇静剂主要成分并非DZP。
近年来淡水鱼中关于DZP检出阳性相关报道多与休闲渔业相关[25-27],休闲垂钓中窝料和饵料的使用可能会是DZP来源的主要途径之一,检测结果表明窝料和饵料中DZP的检出率达到66.7%,从表1中可以看出,抽取的部分窝料、饵料的主要成分中含有诱食剂。而为提高垂钓效果增加垂钓者的捕鱼成功率,会在窝料和饵料中拌入诱鱼剂,对10瓶诱鱼剂检测发现100%含有DZP,且浓度均达到了mg/kg级,10瓶诱鱼剂中除了4瓶未标明成分外,其余诱鱼剂的成分中也均含有诱食剂。可见诱食剂很可能是窝料、饵料和诱鱼剂中DZP的重要来源。目前有研究发现斑马鱼(Brachydanioreriovar)在高浓度DZP的水环境中会发生群聚效应,且更倾向于停留在该区域,将含DZP的窝料或饵料抛入水中会在短时间内形成一个高浓度DZP的环境,促使周边的鱼聚集和进食[28-29],从而达到快速捕鱼的效果[7]。特别是黑坑、竞技垂钓的存在,使得掺入DZP的窝料、饵料或诱鱼剂使用范围中更广,更受垂钓者的青睐。休闲垂钓中窝料和饵料的使用,使养殖水体和水产品处于DZP污染中,加之DZP本身代谢周期较长,给养殖环境及水产品安全造成影响。
3 结论
DZP作为一种禁用药物,近年来在水产品中频繁检出,为弄清水产品中DZP残留的来源,对常州地区水产养殖中使用的饲料、垂钓中的饵料、窝料和诱鱼剂、养殖水体和相应水体的水产品中DZP残留情况进行分析,同时建立了在线净化-液相色谱串联质谱法测定DZP的方法。经验证该方法具有灵敏度高、选择性强及定量结果准确等特点,满足实际样品中DZP的检测分析需求。经调查发现垂钓中使用的窝料、饵料及诱鱼剂中DZP的检出率高、残留量大,这可能是目前养殖水体和水产品中DZP频繁检出的重要因素之一。窝料、饵料及诱鱼剂作为垂钓中重要的投入品,亟需对其来源与主要成分进行分析,并将其纳入水产养殖投入品的监管范围。养殖过程中禁用或限用药物的不规范生产和使用,导致其在水产品中残留超标,影响养殖水产品质量安全,有必要对养殖中投入品及其主要成分开展进一步调查分析,对其安全隐患等进行跟踪评估。
