白桦脂醇纳米乳的制备及其在S180荷瘤小鼠体内分布研究
2024-05-10王立鑫李鑫蒙天琛杨波
王立鑫 李鑫 蒙天琛 杨波

本文引用: 王立鑫, 李 鑫, 蒙天琛, 杨 波. 白桦脂醇纳米乳的制备及其在S180荷瘤小鼠体内分布研究[J]. 湖南中医药大学学报, 2024, 44(4): 587-591.
〔摘要〕 目的 制备白桦脂醇纳米乳,研究其在S180荷瘤小鼠体内的分布情况。方法 通过相转变法制备白桦脂醇纳米乳,腹腔注射白桦脂醇纳米乳和白桦脂醇注射液,采用HPLC方法测定小鼠各组织中的药物浓度并计算药动学参数,分析比较两种制剂在小鼠體内组织分布情况。结果 白桦脂醇纳米乳在各组织中Cmax和AUC依次为:肿瘤组织>肝>肾>脾>肺>心脏,且均高于白桦脂醇注射液组(P<0.05);肿瘤组织和肝脏的峰浓度比Ce分别为1.53和1.54;肿瘤的靶向效率Te值最大。结论 与白桦脂醇注射液相比,白桦脂醇纳米乳在肿瘤组织和肝脏中的分布显著增加(P<0.01),白桦脂醇纳米乳对肿瘤组织具有明显的靶向性。
〔关键词〕 白桦脂醇;纳米乳;体内分布;靶向性
〔中图分类号〕R 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2024.04.009
Preparation of betulin nanoemulsion and its distribution in S180 tumor-bearing mice
WANG Lixin, LI Xin*, MENG Tianchen, YANG Bo
School of Pharmacy, Harbin University of Commerce, Harbin, Heilongjiang 150028, China
〔Abstract〕 Objective To prepare betulin nanoemulsion and study its distribution in S180 tumor-bearing mice. Methods Betulin nanoemulsion was prepared by phase transition method. After intraperitoneal injection of betulin nanoemulsion and betulin injection, HPLC method was used to determine the drug concentration in various tissues of mice and calculate the pharmacokinetic parameters. The tissue distribution of the two preparations in mice was analyzed and compared. Results The Cmax and AUC of betulin nanoemulsion in each tissue were as follows: tumor tissue>liver>kidney>spleen>lung>heart, all higher than those in betulin injection group (P<0.05); the peak concentration ratios (Ce) in tumor tissue and liver were 1.53 and 1.54, respectively; the tumor targeting efficiency (Te) value was the highest. Conclusion Compared with betulin injection, betulin nanoemulsion significantly increased distribution in tumor tissues and liver (P<0.01), and betulin nanoemulsion exhibited obvious targeting towards tumor tissues.
〔Keywords〕 betulin; nanoemulsion; in vivo distribution; targeting
白桦脂醇(betulin)广泛存在于酸枣仁、石榴树皮、白桦树皮等物质中[1],属于羽扇豆烷型的天然五环三萜化合物(pentacyclic triterpenoids,PTs)[2],其在保护心肌细胞、抗辐射、抗疲劳、耐缺氧、抗炎以及抗癌方面均有具有良好的药理作用[3-7]。白桦脂醇可作为潜在的抗肿瘤药物,但由于其水溶性差、生物利用度低,限制了其临床应用。
纳米乳(nano emulsion)是由油相、水相和表面活性剂组成的热力学稳定体系,其平均粒径为1~100 nm。近年来,纳米乳应用发展迅速,涉及制药、食品等多个领域[8]。
为研究白桦脂醇对肿瘤组织的靶向性,本文采用肉豆蔻酸异丙酯(IPM)作为油相;吐温-80和丙三醇作为表面活性剂,通过小鼠体内组织分布实验,比较白桦脂醇纳米乳和白桦脂醇注射液在荷瘤小鼠体内的分布特性。
1 材料
1.1 实验仪器
SW-CJ-ID单人净化工作台(苏州净化设备有限公司);TDL-60B台式低速离心机(上海安亭科学仪器厂);QL-861涡旋器(海门市其林贝尔仪器制造有限公司);MCO-15AC CO2培养箱(日本SANYO公司);高效液相色谱仪(美国Dionex公司);Welchrom C18色谱柱(上海月旭科技有限公司);UltiMate3000紫外检测器(美国Dionex公司);DF-101S集热恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);LitesizerTM 500纳米粒度电位仪(奥地利Anton Paar公司);JEM-2100F透射电镜(日本电子株式会社)。
1.2 药品与试剂
白桦脂醇(西安西海生物科技有限公司,质量分数98%,批号:20231101);甲醇(天津市科密欧化学试剂有限公司,色谱纯);甲酸(天津市科密欧化学试剂有限公司,色谱纯);肉豆蔻酸异丙酯(上海阿拉丁试剂有限公司,分析纯);吐温-80(天津百伦斯生物技术有限公司,分析纯);丙三醇(天津市天力化学试剂有限公司,分析纯);纯净水(娃哈哈集团有限公司)。
1.3 动物來源
健康的SPF级昆明小鼠,雄性,5~6周,体质量18~20 g,由长春亿斯实验动物技术有限责任公司提供,动物合格证号:SCXK(吉)2023-0003。该实验经哈尔滨商业大学伦理委员会批准,编号为:HSDYXY-2022028。
1.4 细胞来源
S180肿瘤细胞:由中国医学科学院基础医学研究所基础医学细胞中心提供。
2 方法
2.1 白桦脂醇样品的制备
白桦脂醇纳米乳的制备:取处方量白桦脂醇加入到15%肉豆蔻酸异丙酯(IPM)混合,涡旋5 min,37 ℃、100 r/min震荡48 h。取出后以5 000 r/min离心5 min,离心半径为40 cm,吸取上清液,加入23%吐温-80与41%丙三醇,在53 ℃下,1 050 r/min转速,磁力搅拌6 min,逐滴加入23%蒸馏水,得到5 mg·mL-1带有淡蓝色乳光的淡黄色白桦脂醇纳米乳。
白桦脂醇注射液的制备:取处方量白桦脂醇、吐温-80加入生理盐水中分散均匀,制成浓度为5 mg·mL-1的注射液[9]。
2.2 白桦脂醇纳米乳的评价
通过投射电镜观察白桦脂醇纳米乳的状态;通过粒度仪考察其粒径、多分散指数和Zeta电位;考察包封率。
2.3 体外释药考察
2.3.1 HPLC方法线性试验及其方法学考察 精密吸取白桦脂醇对照品加甲醇定容,超声5 min溶解,配制成4、60、100、120、160、200 μg·mL-1系列浓度的对照液。以色谱峰峰面积平均值Y为纵坐标,白桦脂醇标准溶液浓度X(mg·mL-1)为横坐标进行线性回归,得到白桦脂醇对照品回归方程。配制浓度为100、120、160 μg·mL-1的白桦脂醇对照品溶液,分别在一天内进行重复测量3次,重复测量3 d,并计算日内和日间精密度。精密量取白桦脂醇纳米乳1.0 mL 9份,分别精密加入100、120、160 μg·mL-1浓度的标准品溶液1.0 mL,分别进样,记录峰面积,代入标准曲线,计算回收率。配制浓度为100、120、160 μg·mL-1的白桦脂醇对照品溶液,分别于0、2、4、6、8 h测定,考察重复性。于室温避光防放置24 h后测定,考察稳定性。
2.3.2 体外释放方法 精密量取2 mL白桦脂醇纳米乳置于处理后的透析袋中,排尽气泡后将两端扎紧,置于100 mL的pH 7.4的PBS缓冲液中。在37 ℃条件下,100 r/min水浴振荡,分别于15 min、30 min、1 h、2 h、3 h、4 h、5 h、6 h、8 h、10 h、12 h、24 h取样1 mL,同时补加同温等量介质。根据标准曲线计算累积释放度,绘制释放曲线。
2.4 S180荷瘤小鼠模型的建立
S180肿瘤细胞经体外复苏传代后[10-12],在小鼠腹腔内传代5 d,无菌抽取小鼠腹腔内乳白色腹水,用无菌生理盐水按1∶3.5稀释,用无菌注射器吹打搅拌均匀。吸取0.2 mL肿瘤细胞悬液,接种于小鼠的右侧前肢腋下,生长1周后备用[13]。
2.5 白桦脂醇体内测定方法的建立
2.5.1 溶液的配制 标准溶液的配制:精密称取适量白桦脂醇标准品于25 mL容量瓶中,加入甲醇定容,超声波震荡5 min,即得浓度为400 μg·mL-1的标准储备液,保存在4 ℃冰箱中备用。
内标物溶液的配制:精密称取适量齐墩果酸标准品于25 mL容量瓶中,加入甲醇定容,超声波震荡5 min,即得浓度为400 μg·mL-1的内标物溶液,保存在4 ℃冰箱中备用[9]。
2.5.2 色谱条件 色谱柱:Welchrom C18色谱柱(4.6 mm×250 mm,5 μL);流动相∶甲醇∶0.2%甲酸(80∶20);流速:1 mL/min;检测波长:210 nm;柱温:30 ℃;进样量:20 μL。
2.6 组织样品的处理
精密称定小鼠的心、肝、脾、肺、肾和肿瘤组织,加入生理盐水制备为0.1 g·mL-1的匀浆液。精密移取各组织匀浆液200 μL,加入20 μg·mL-1的内标齐墩果酸溶液20 μL,加入磷酸20 μL,漩涡混匀,静置10 min后加入1 mL乙酸乙酯,涡旋混匀后以3 500 r/min离心15 min,离心半径40 cm,取上层溶液于35 ℃水浴吹干,加入甲醇50 μL复溶,离心[14-15]。按“2.5.2”项下色谱条件进样检测。
2.7 S180荷瘤小鼠组织分布实验
取S180荷瘤小鼠42只,随机分成两组,分别给予白桦脂醇注射液(5 mg·mL-1)和白桦脂醇纳米乳(5 mg·mL-1),以50 mg/kg单剂量腹腔注射给药一次后,分别于给药0.25、0.5、1、2、4、6、8 h后,脱颈处死小鼠。每个时间点处死3只小鼠,取心、肝、脾、肺、肾和肿瘤组织,清洗组织表面血液,滤纸吸干,精密称量后放入EP管中备用,再按照“2.6”项下方法处理。
比较给药后白桦脂醇纳米乳和白桦脂醇注射液在体内的分布情况。以峰浓度比(Ce)、相对摄取率(Re)和靶向效率(Te)为指标评价制剂靶向性[16]。
3 结果
3.1 白桦脂醇纳米乳的外观形态、粒径、PDI及Zeta电位
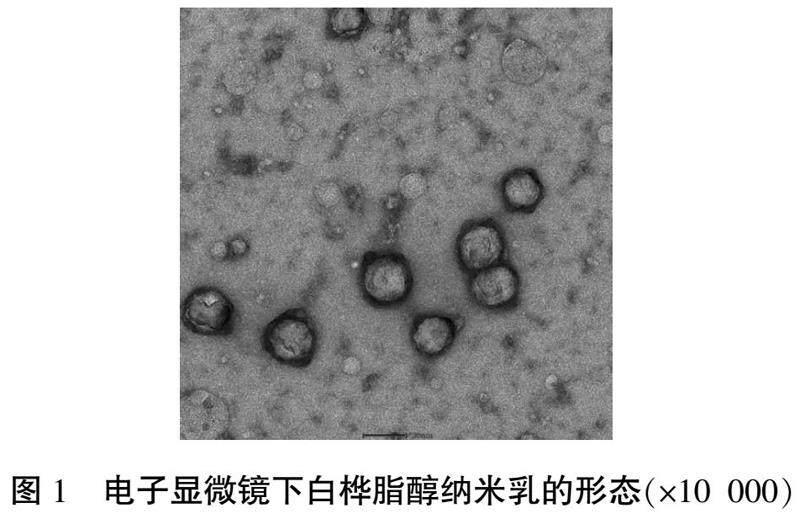
透过电镜观察白桦脂醇纳米乳见图1;白桦脂醇纳米乳平均粒径为(34.9±0.24) nm,PDI为8.93%±1.43%;平均Zeta电位值为(26.03±0.47) mV。
3.2 白桦脂醇纳米乳包封率的考察
精密量取0.5 mL白桦脂醇纳米乳于超滤离心管中,室温下10 000 r/min的速度离心15 min,取外管溶液20 μL,加入甲醇稀释至1 mL,检测游离的白桦脂醇含量。另取相同批次制备的白桦脂醇纳米乳取20 μL,加入甲醇稀释至1 mL,超声混匀,检测白桦脂醇纳米乳中药物的总含量。结果显示白桦脂醇纳米乳包封率平均值为99.0%,包封率较高。
3.3 体外释药考察
3.3.1 方法学考察 得到回归方程为Y=0.096 4X-1.296 3,R2=0.999 9,线性范围是40~200 μg·mL-1。结果显示日内和日间精密度RSD均小于2%,回收率为95%~105%,重复性和稳定性RSD均小于2%。该方法可以用来考察释放度。
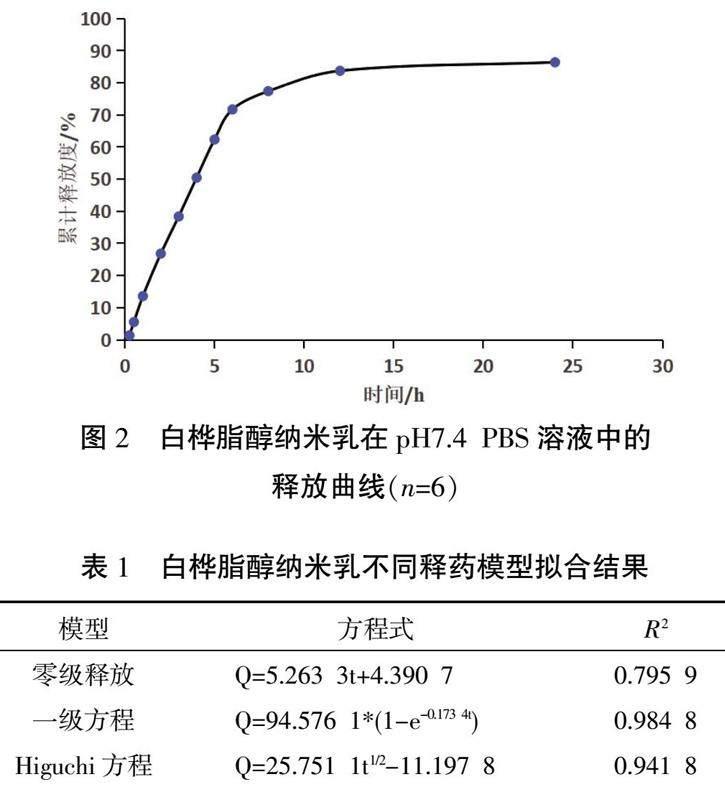
3.3.2 释放度方程的拟合 以累计释放度Q对时间t作图得到累计释放曲线,见图2。利用Orign 2021软件对白桦脂醇纳米乳的体外释放按照零级动力学方程、一级动力学方程、Higuchi方程进行拟合,记录相关系数,见表1。白桦脂醇纳米乳在一级释药模型的拟合度最高,说明白桦脂醇纳米乳释放速度主要受药物浓度的影响。
3.4 方法学考察
3.4.1 专属性考察 以肝组织为例,组织中内源性物质不干扰药物的测定,该方法专属性好。详见图3。
3.4.2 标准曲线的测定结果 取心、肝、脾、肺、肾、肿瘤组织匀浆液200 μL,加入白桦脂醇对照品,配制成10、20、40、80、160、240 μg·mL-1系列浓度对照品溶液[9]。按照“2.6”项下处理组织样品,按照“2.5.2”项下色谱条件,测定血浆和组织样品。以白桦脂醇峰面积与内标物齐墩果酸峰面积的比值(Y)对组织中的药物浓度(X)做线性回归,得各个组织样品的回归方程。详见表2。
3.4.3 精密度和回收率 分别取各空白组织匀浆液200 μL,配制白桦脂醇低(20 μg·mL-1)、中(60 μg·mL-1)、高浓度(100 μg·mL-1)的溶液,按照“2.6”項下处理组织样品后进样分析。分别在一天内进行重复测量3次,重复测量3天,并计算日内和日间精密度,计算方法回收率和提取回收率。结果显示日内精密度和日间精密度均小于8.7%;3种浓度的方法回收率为98%~104%;提取回收率为95%~103%,满足测试方法学要求。
3.4.4 重复性和稳定性 分别取各空白组织匀浆液200 μL,配制白桦脂醇低(20 μg·mL-1)、中(60 μg·mL-1)、高浓度(100 μg·mL-1)的溶液。分别于0、2、4、6、8 h,按照“2.6”项下处理组织样品后进样分析;分别取各空白组织匀浆液200 μL,配制白桦脂醇低(20 μg·mL-1)、中(60 μg·mL-1)、高浓度(100 μg·mL-1)的溶液各5份。分别于室温放置24 h,-20 ℃反复冻融2次,按照“2.6”项下方法处理组织样品后进样分析。结果显示,3种浓度的重复性RSD均小于9.1%;3种浓度的室温稳定性和冻融稳定性RSD均小于9.4%,满足测试方法学要求。
3.5 小鼠体内组织分布研究
与白桦脂醇注射液小鼠各组织AUC相比,白桦脂醇纳米乳组小鼠各组织的AUC均增加,差异均有统计学意义(P<0.05)。见表3。白桦脂醇纳米乳与白桦脂醇注射液在小鼠各组织中的药物分布见图4。
与白桦脂醇注射液小鼠各组织Cmax相比,白桦脂醇纳米乳组小鼠各组织的Cmax均增加,差异均有统计学意义(P<0.05)。肿瘤组织的Te值为1.16,说明白桦脂醇纳米乳对肿瘤有靶向选择性。详见表4—5。
4 结语
白桦脂醇纳米乳在小鼠体内的分布研究中,各组织中AUC和Cmax均比白桦脂醇注射液有所提高。将白桦脂醇制备为纳米乳后,提高了药物的溶解度,同时纳米乳的粒径较小,大幅度增加了溶出面积,加速药物溶出和吸收,从而提高了组织中药物浓度。白桦脂醇纳米乳在肝脏和肿瘤组织中的分布明显高于其他脏器组织,推测白桦脂醇纳米乳微粒被肝脏网状内皮系统吞噬而实现药物大量滞留。肿瘤细胞由于增殖速度较快,使得肿瘤组织内血管和淋巴管不完整,从而导致纳米乳容易从血管内渗漏到肿瘤组织内,且难以从淋巴管回流,因此,表现出肿瘤组织中药物的分布较高。但各组织的Te值中,只有肿瘤组织的Te值大于1,所以白桦脂醇纳米乳对肿瘤组织具有明显的靶向性。
参考文献
[1] 李 影, 李林夕, 张玉琦, 等. 一种高效的白桦树皮中白桦脂醇分离、纯化方法[J]. 植物研究, 2020, 40(3): 468-475.
[2] 陶 冉, 王成章, 张昌伟, 等. 桦木醇选择性氧化产物的合成及抗肿瘤活性研究[J]. 林产化学与工业, 2018, 38(4): 47-51.
[3] 宋添添, 牟 瑛, 张桂英. 白桦脂醇的体内抗肿瘤作用及机制[J]. 世界中医药, 2014, 9(7): 916-918, 922.
[4] 吴光健, 黄汝亮, 刘 军, 等. 白桦脂醇对酒精性肝损伤的治疗作用[J]. 预防医学论坛, 2010, 16(9): 825-827.
[5] 张 玉, 李延玲, 李书印, 等. 白桦脂醇对人胃癌MGC-803细胞增殖的抑制作用和凋亡诱导作用[J]. 中国免疫学杂志, 2020, 36(17): 2115-2119.
[6] 张思彦. 白桦脂醇对受损心肌细胞的保护作用[D]. 济南: 山东大学, 2014.
[7] 李志兴. 白桦脂醇对小鼠的抗疲劳及耐缺氧作用研究[D]. 长春: 吉林大学, 2011.
[8] 陈雯烨, 王志高, 鞠兴荣, 等. 纳米乳的研究进展与潜在局限性[J]. 粮食科技与经济, 2020, 45(3): 79-83.
[9] 黄曦漫. 白桦脂醇在肝损伤小鼠体内药动学及组织分布研究[D]. 延吉: 延边大学, 2016.
[10] 蒲帝宏, 葉姿妤, 周丽倩, 等. RPS6亚基肽段抑制S180肿瘤细胞的分子机制[J/OL]. 生物学杂志, 2023: 1-7[2023-12-10].http://kns.cnki.net/kcms/detail/34.1081.Q.20230627.1030.012.html.
[11] 赵倪慧, 蒋 琳, 张 丁, 等. 草黄口蘑多糖对S180荷瘤小鼠抗肿瘤活性分子机制研究[J/OL]. 食品与发酵工业,2023:1-14[2023-10-09]. https://doi.org/10.13995/j.cnki.11-1802/ts.035686.
[12] 陈冠铭, 杨丽姿, 庞定国, 等. 双黄连可溶性粉对S180荷瘤小鼠腹腔巨噬细胞C3b和Fc受体的影响[J]. 动物医学进展, 2023, 44(1): 90-96.
[13] 呼芳竹. 肠道菌群对蛋氨酸脑啡肽治疗小鼠S180肉瘤疗效的影响[D]. 沈阳: 中国医科大学, 2021.
[14] 任君刚, 许 可. 冰片修饰卡马西平PLGA纳米粒的制备及其在小鼠体内的组织分布[J]. 中国医药工业杂志, 2023, 54(8): 1224-1232.
[15] 李嫚琪, 许波华, 涂宏刚, 等. 125I标记戈氏梭菌芽孢的制备及其在荷瘤小鼠体内的组织分布[C]//中国毒理学会.中国毒理学会第十次全国毒理学大会论文集. 珠海: 中国医药工业研究总院上海益诺思生物技术股份有限公司,益诺思生物技术南通有限公司, 山东新创生物科技有限公司, 2023: 520.
[16] 郑转弟. 黄芩苷纳米乳小鼠体内组织分布及淋巴转运途径的初步研究[D]. 合肥: 安徽中医药大学, 2019.
〔基金项目〕中央支持地方高校改革发展资金人才培养项目。
〔通信作者〕*李 鑫,男,副教授,硕士研究生导师,E-mail:102105@hrbcu.edu.cn。
