江浙皖部分地区副鸡禽杆菌分离鉴定及生物学特性研究
2024-05-09毕海洋张燕茹李向臣何玉龙舒建洪武永淑
吴 娴,毕海洋,张燕茹,李向臣,何玉龙,舒建洪*,武永淑*
(1.浙江理工大学生命科学与医药学院,浙江杭州 310018;2.浙江理工大学绍兴生物医药研究院,浙江绍兴 312366;3.浙江农林大学动物科技学院 动物医学院,浙江省畜禽绿色生态健康养殖应用技术研究重点实验室,动物健康互联网检测技术浙江省工程实验室,动物医学与健康管理浙江省国际科技合作基地,中澳动物健康大数据分析联合实验室,浙江杭州 311300)
鸡传染性鼻炎(infectious coryza,IC)是鸡的一种细菌性急性上呼吸道传染病,其病原为副鸡禽杆菌(Avibacteriumparagallinarum,Apg)。该病主要在育成鸡和蛋鸡群中出现,导致蛋鸡繁殖停滞、淘汰率显著上升,产蛋量明显减少,发病高峰期产蛋可下降70%,发病鸡所产蛋品质下降,不能留作种用;育成鸡生长不良,采食量下降10%~50%,该病不易根治且易复发,给家禽养殖户造成严重的经济损失[1]。该病临床症状主要表现为鼻腔分泌黏液性液体、面部水肿、结膜炎以及泪液分泌增多。该病潜伏期短,发病迅速。发病率高,病死率虽较低,但可能与其他病原混合感染而升高。
鸡传染性鼻炎于1920年被Beach首次报道,1932年De Blieck首次分离到该细菌并为其命名为副鸡嗜血杆菌,2005年Blaclall重新将该菌命名为副鸡禽杆菌[2]。Page依据抗原结构首次将副鸡禽杆菌分为A、B和C共3个血清型[1]。
1986年我国首次报道该病,自1987年后,许多养鸡场都有该病发生,发病率逐年增加,目前在全国各地都有流行[3]。李秀娟等[3]研究表明,从2014-2019年,鸡传染性鼻炎的阳性检出率由3.8%增长到13.1%,呈逐年递增趋势。该病一年四季均发,冬春季多发。初产鸡及产蛋高峰期发病最多,其次是青年鸡。研究发现分离株对高达16种药物有不同程度的耐药性。另外,与大肠埃希氏菌、H9亚型禽流感病毒等混合感染的比重增加,占62%[4]。马国明等对2017-2019年我国部分规模养殖鸡场的感染现状分析,结果表明3年期间副鸡禽杆菌的阳性检出率分别为38.1%、45.7%和36.4%,其中A型菌株占47.1%,B型菌株占11.8%,C型菌株占41.2%,说明3种血清型副鸡禽杆菌在我国广泛流行,感染情况复杂,增加了防控难度[5]。印度尼西亚日惹市副鸡禽杆菌阳性检出率达80%[6],说明鸡传染鼻炎的流行在全世界都很严重。
我国养鸡业发展迅速,集约化养殖程度快速攀升,鸡场饲养密度大,面临细菌性疾病感染的压力加重。尤其是近年减抗政策的推行、食品药残监管和处罚力度增大,导致鸡传染性鼻炎的发病率升高,给规模化养鸡场的防控带来巨大挑战[7]。近年来,鸡传染性鼻炎发生率显著增加,其中免疫鸡群也有发生,这可能与现用疫苗菌株和大多数流行株血清型不匹配有关,鸡传染性鼻炎已成为困扰养鸡业发展的重要疫病[8]。因此,了解和研制针对目前国内流行株疫苗对防控鸡传染性鼻炎显得尤为重要。
本研究通过对2016年5月至2017年2月分别从浙江杭州、浙江金华、安徽宣城、安徽黄山、浙江舟山、杭州萧山、江苏常州和浙江宁波等8个养殖场分离到疑似鸡传染性鼻炎病鸡的眶下窦样品122份进行病原菌分离,对其中10个分离株进一步进行形态学、卫星现象试验、PCR鉴定和血清平板凝集试验,对分离株进行人工感染SPF鸡的动物回归试验,通过临床表现和组织病理学观察进一步探究分离株的毒力和致病性。通过以上试验,了解江浙皖地区鸡传染性鼻炎的流行情况和病菌致病力,为鸡传染性鼻炎三价疫苗研发和防控提供参考。
1 材料与方法
1.1 材料
1.1.1 病料 病鸡样品采集于2016年5月至2017年2月,分别从浙江杭州、浙江金华、安徽宣城、安徽黄山、浙江舟山、杭州萧山、江苏常州和浙江宁波等8个养鸡场发现的疑似鸡传染性鼻炎发病鸡采集病料122份。
1.1.2 实验动物 12~14周龄SPF鸡,购自北京梅里亚维通实验动物技术有限公司;SPF兔(成年),购自青岛康大生物科技有限公司。
1.1.3 标准菌株和阳性血清 标准副鸡禽杆菌血清A型菌株CVCC3007、B型菌株CVCC3006和C型菌株CVCC3008,购自中国兽医药品监察所;阳性血清,由以上菌株免疫兔获得高免兔血清。
1.1.4 主要试剂 TSA培养基(TB650),鸡血清(S9080),氧化型辅酶Ⅰ(NAD)(N8110),50×TAE缓冲液,北京索莱宝科技有限公司产品;TSB培养基(HB4114),葡萄糖琼脂(HB0135-2),乳糖发酵培养基(HB8420),蔗糖微量生化鉴定管(GB171),硝酸盐培养基(HB8460),硝酸盐还原试剂盒(HB8282),尿素酶琼脂基础(HB4095),快速硫化氢试验琼脂(HB0246),蛋白胨水(色氨酸肉汤)(GS001),青岛海博生物技术有限公司产品;革兰氏染色液,湖南比克曼生物科技有限公司产品;2×TaqPCR Master Mix,北京康为世纪生物科技有限公司产品;DL 2 000 DNA Maker,宝日医生物技术(北京)有限公司产品。
1.1.5 主要仪器 垂直层流洁净工作台(HCB-1300VS),青岛海尔特种电器有限公司产品;PCR仪(K960),杭州晶格科学仪器有限公司产品;生物显微镜(ECLIPSE E100),尼康仪器(上海)有限公司产品;恒温振荡器(HZ-9211K),太仓市科教仪器厂产品;二氧化碳培养箱(BC-J160),上海博迅医疗生物仪器股份有限公司产品;DNA凝胶成像系统(Tanon 2500),天能科技(上海)有限公司产品;台式高速离心机(Neofuge 1600R),力康发展有限公司产品;数显恒温水浴锅(HH-3),国华电器有限公司产品;电子天平(BSA124S),赛多利斯科学仪器(北京)有限公司产品;电泳仪(DYY-8C),北京六一生物科技有限公司产品。
1.2 方法
1.2.1 样品细菌分离 2016年5月至2017年2月在8个养殖场共采集122 份疑似样品,参考《鸡传染性鼻炎诊断技术》(NY/T538-2015)[9],合成副鸡禽杆菌鉴定引物序列F:5′-TGAGGGTAGTCTTGCACGCGAAT-3′;R:5′-CAAGGTATCGATCGT- CTCTCTACT-3′,扩增片段大小为464 bp。取分离菌株的纯培养物加入TSB肉汤(含100 mL/L鸡血清和0.1 mg/mL NAD),置于摇床200 r/min培养10 h后,所有分离株各取菌液1 mL于12 000 r/min离心10 min后取沉淀;分别向样品沉淀中加入灭菌TE缓冲液400 μL,吹打混匀,置于水浴锅100℃煮沸10 min后,冰浴10 min,再次12 000 r/min离心10 min取上清液,上清液即为样品DNA模板。PCR扩增反应体系为:2×TapPCR Master Mix酶15 μL,cDNA模板2 μL,上、下游引物各1 μL,灭菌双蒸水11 μL。PCR反应条件:95℃ 6 min;95℃ 30 s,55℃ 30 s,72℃ 90 s,共32个循环;72℃终延伸7 min。反应结束取扩增产物10 μL加入1%琼脂糖凝胶孔中,130 V恒压电泳20 min后,置于紫外成像仪观察。
1.2.2 病原分离与形态学观察 从PCR检测的Apg阳性样品随机抽取10个样品进行形态学鉴定。在无菌条件下,将病死鸡取头部并对眶下窦外表面进行消毒处理,使用灭菌手术剪打开眶下窦后直接灭菌棉拭子擦拭采集其内分泌物,接种于TSA(含100 mL/L鸡血清和0.1 mg/mL NAD)琼脂平板,将平板倒置于含5% CO2培养箱,37℃培养18~36 h,观察菌落形态。挑取可疑单菌落划线接种于含鸡血清和NAD的TSA琼脂平板,置于含5% CO2培养箱,37℃培养18~36 h后观察菌落形态并进行革兰氏染色镜检。
1.2.3 PCR鉴定 参考《鸡传染性鼻炎诊断技术》(NY/T538-2015)[9],对挑取的10株分离菌株样品再次进行PCR检测鉴定。
1.2.4 卫星试验 挑取TSA琼脂平板培养的可疑单菌落至TSB肉汤(含100 mL/L鸡血清和0.1 mg/mL NAD),于摇床200 r/min培养8~12 h。取适量菌液滴加于不含NAD的琼脂平板,取金黄色葡萄球菌纯培养物垂直交叉划线于平板,倒置于含5% CO2培养箱,37℃培养24~36 h后,观察菌落生长情况。
1.2.5 生化及培养特性鉴定 参考已发表文献[9-10],分别对10株Apg阳性单菌落进行生化鉴定,包括糖类发酵试验(葡萄糖、乳糖和蔗糖)、硝酸盐还原试验、靛基质试验、过氧化氢酶鉴定试验、尿素酶试验和硫化氢试验。将10株菌样分别加入含100 mL/L鸡血清和0.1 mg/mL NAD的试管培养基中进行培养,其中蔗糖发酵试验和靛基质试验在添加0.1 mg/mL NAD的生化鉴定管中进行,置于含5% CO2培养箱,37℃培养24~36 h后观察现象。接种环挑取菌样涂抹于载玻片后滴加3%过氧化氢溶液,观察是否产生气泡以鉴定该菌是否具有过氧化氢酶。
1.2.6 血清型鉴定 依据国家行业标准[9]制备血凝抑制试验所需抗原,并且通过鸡醛化红细胞对所制备抗原进行血凝效价(HA效价)测定。使用PBS配制抗原工作液为4 HA单位,并对副鸡禽杆菌A型、B型和C型阳性血清稀释不同倍数(200倍、400倍和800倍),进行血凝抑制试验。观察阳性血清能否抑制待检菌株抗原凝集红细胞的现象。
1.2.7 分离菌株的动物回归试验 对10株分离株进行动物回归试验,分别划线接种于TSA(含100 mL/L鸡血清和0.1 mg/mL NAD)平板,在5% CO2培养箱,37℃培养24~48 h,分别挑取3~5个典型菌落接种于含鸡血清和NAD的TSB培养基,于37℃摇床180 r/min培养10~12 h收获菌液,并进行活菌计数。选择55只12~14周龄SPF鸡进行动物回归试验,随机分为11组,每组5只,1~10组为试验组,分别对10个分离株进行攻毒试验,11组为对照组。试验组A、B和C 3个血清型的攻毒剂量分别为2×104CFU/0.2 mL、1×104CFU/0.2 mL和1×104CFU/0.2 mL,每只鸡接种0.2 mL菌液于眶下窦,对照组接种0.2 mL无菌PBS。将接种完成的鸡只于负压区隔离器中进行饲养并连续观察7 d,对出现典型临床症状的鸡只进行解剖和病理观察。同时,在无菌条件下,采集攻毒7 d和14 d试验鸡只的眶下窦、气管、肺、心、肝、脾和肾等组织,进行病理组织学观察。
2 结果
2.1 样品细菌分离结果
对2016年5月至2017年2月8个养殖场的122份疑似样品进行PCR 扩增,Apg阳性数为48个,阳性率为39.3%,8个养殖场的阳性率为36.8%~50%,具体见表1。
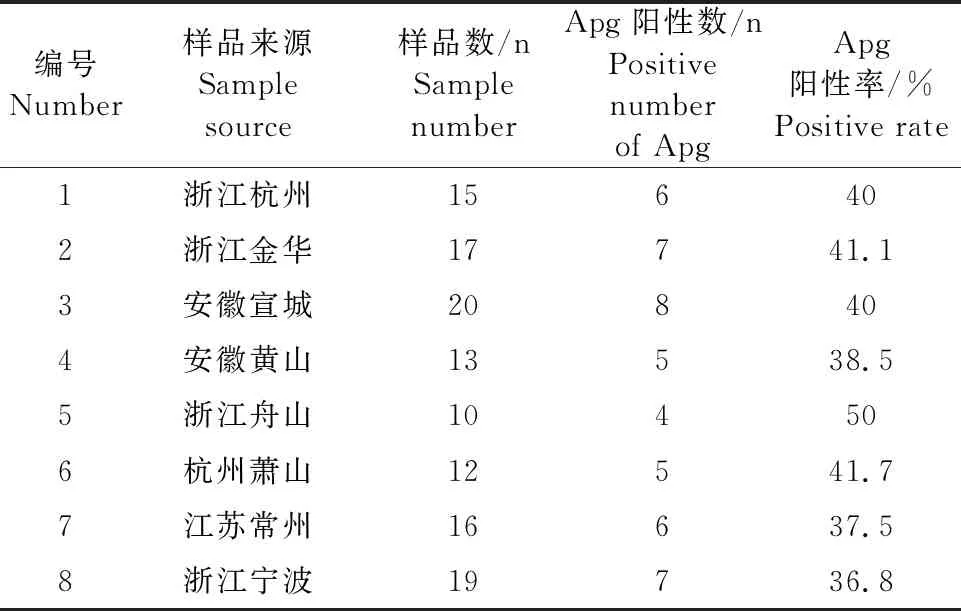
表1 8个养殖场副鸡禽杆菌PCR检测结果
2.2 细菌分离
采集的病鸡样品划线培养后,有形态大小各异的单菌落长出。对10株分离株进行纯培养后在TSA琼脂平板上初期呈现形态为针尖样大小、灰白色、圆形露珠样菌落。革兰氏染色镜检结果表明分离菌株为革兰氏阴性菌,其形态为短小杆状或球状。
2.3 细菌PCR鉴定结果
使用特异性引物对10株分离株样品的DNA进行扩增,对PCR产物进行琼脂糖凝胶电泳,结果如图1,扩增片段大小为464 bp,符合预期结果。
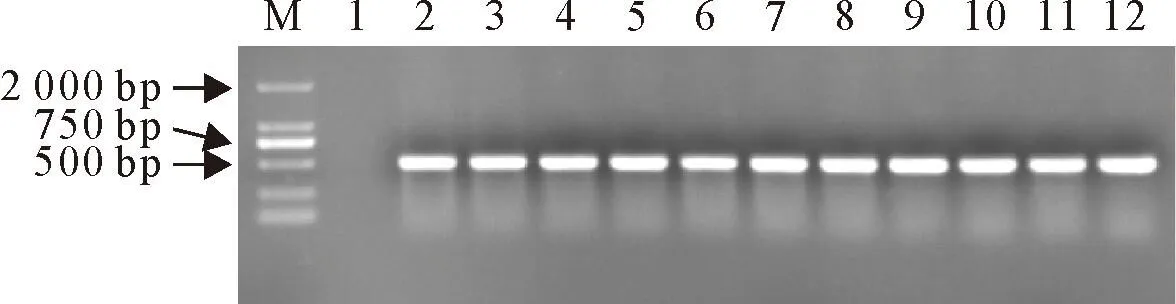
M.DNA标准;1.阴性对照;2.阳性对照;3~12.ZJ09,ZZ01,ZN07,HX05,ZH02,JC03,AX07,AX10,AH10,ZN02
2.4 卫星试验
将纯化培养的10株分离菌株分别涂布于不含NAD的琼脂平板上与金黄色葡萄球菌交叉划线处理培养后,均出现明显“卫星现象”,其中3个菌株的结果见图2。副鸡禽杆菌均在金黄色葡萄球菌周围生长,且随着距葡萄球菌距离越远,副鸡禽杆菌菌落越小。
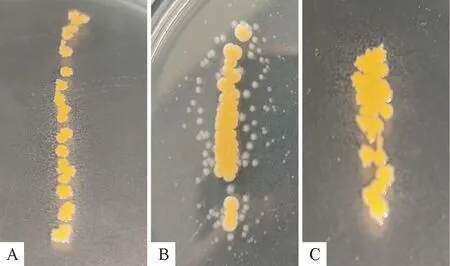
a.ZZ01株;B.HX05株;C.ZN02株A.ZZ01 strain; B.HX05 strain; C.ZN02 strain
2.5 生化及培养特性鉴定结果
对10株分离菌株进行生化及培养特性鉴定,结果显示10株分离菌株均能分解蔗糖和葡萄糖,不分解乳糖,硝酸盐还原试验阳性,过氧化氢酶试验、靛基质试验、尿素酶试验和硫化氢试验均为阴性。
2.6 血清型鉴定结果
10株分离株的血清型鉴定结果见表2。最终获得副鸡禽杆菌A型菌株3株,B型菌株4株,C型菌株3株,A型、B型和C型3个菌株的阳性率分别为30%、40%和30%。
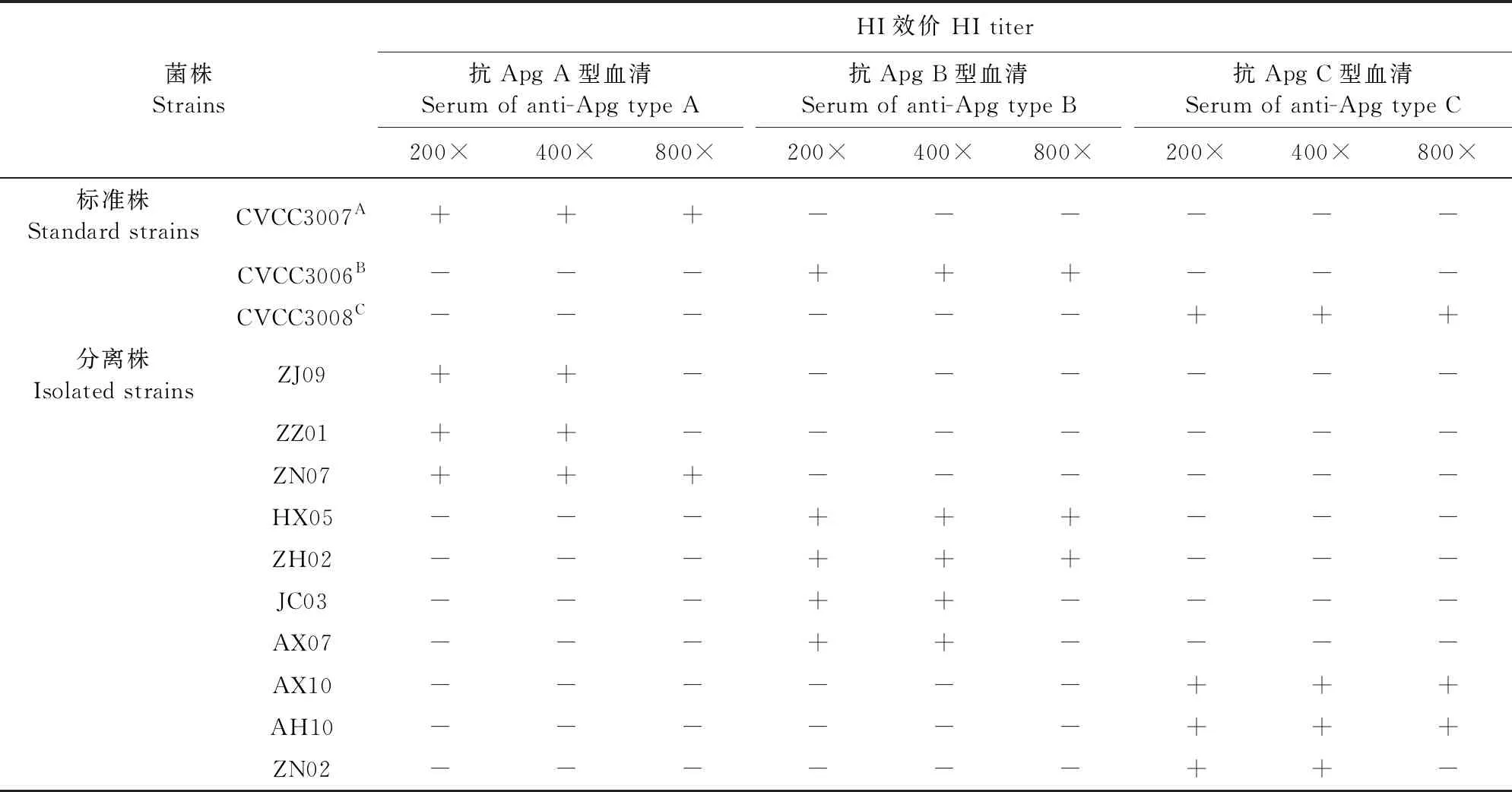
表2 10株分离株血清型鉴定结果
2.7 动物回归试验
A、B和C3个血清型毒株在攻毒后24 h,鸡只面部明显肿胀且精神沉郁;有的鸡只出现眼睛闭合、头下垂和缩脖子等嗜睡现象;粪便呈淡黄色或白色水样。攻毒后48 h,面部肿胀加重,甚至无法睁眼,鼻窦内有黄褐色干酪样渗出物。攻毒后72 h,面部肿胀减弱,鼻窦内渗出物增多。攻毒后96 h,鼻腔和口腔有大量深褐色干酪样渗出物,有的鸡只出现频繁的张口呼吸和呻吟等现象。攻毒后120 h,A血清型(ZZ01毒株)攻毒组1只鸡死亡,其余鸡只症状无明显加重。攻毒组鸡只的采食量和饮水量明显下降,攻毒144 h后症状再无加重现象,有的鸡只慢慢恢复正常。A、B和C 3个血清型的发病率为60%~100%,A血清型(ZZ01株)死亡率为20%,B和C血清型死亡率为0。另外,A血清型(ZZ01株)、B血清型(HX05株)和C血清型(ZN02株)表现出更强的毒力,结果见表3。
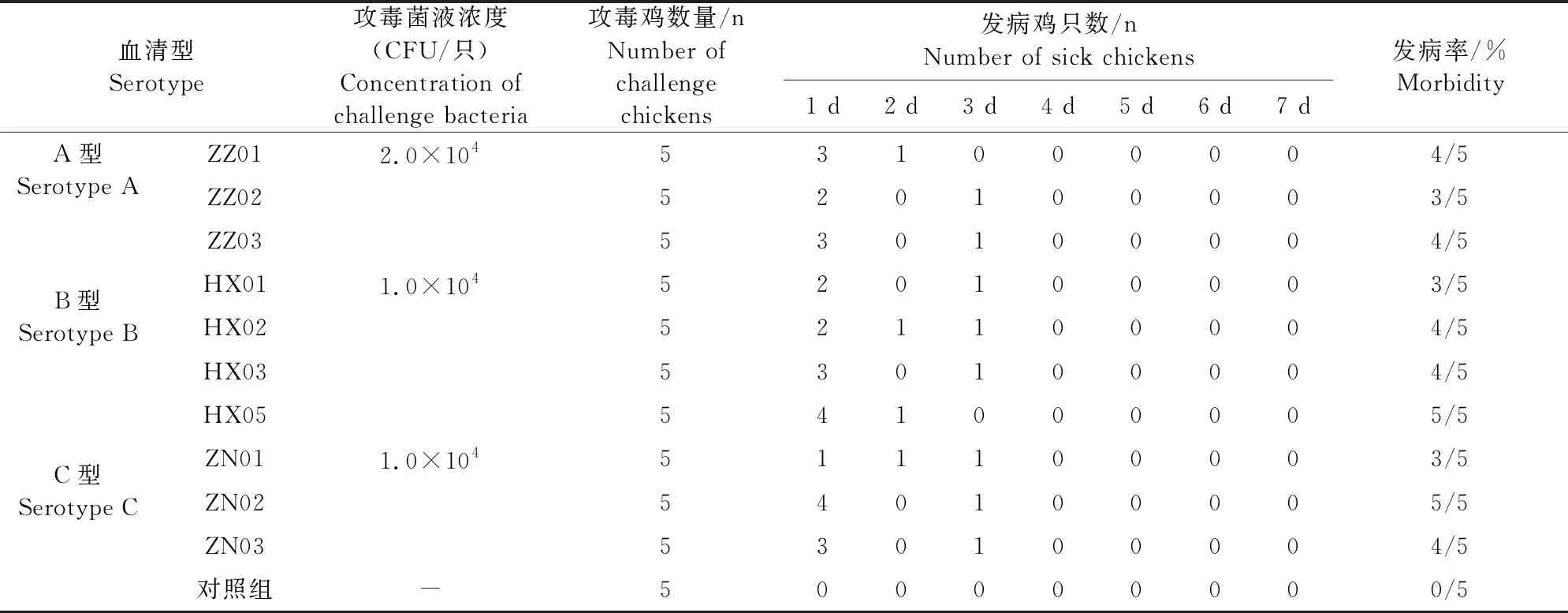
表3 10株分离株攻毒试验结果
对攻毒后7 d鸡只进行剖检和病理组织学观察,病变主要表现在上呼吸道,有干酪样坏死物渗出阻塞在鼻腔、气管及咽部等,并散发出具有浓烈的恶臭气味。部分病死鸡肺脏变白、变大;攻毒后14 d,鼻腔症状减轻,有少量褐色黏液,水肿和出血基本消失,肺脏变白现象明显缓解。
进一步对采集的样品进行病理组织切片观察。ZN01株结果表明,与对照组相比,攻毒后7 d,眶下窦以炎症反应为主,有大量异嗜性粒细胞浸润和聚集(图3A2);肺脏出现少量炎性细胞浸润,肺泡融合变大,界限不清晰(图3B2);气管黏膜上皮细胞坏死、脱落,有纤维素性物质渗出(图3C2)。攻毒后14 d,眶下窦内的异嗜性粒细胞裂解,数量减少并形成坏死灶,逐渐被上皮样细胞吸收、包裹形成肉芽肿样结构(图3A3);肺脏炎性细胞浸润减轻,肺泡结构有明显恢复(图3B3);气管黏膜脱落减轻,黏膜层及黏膜下层有淋巴细胞浸润减少(图3C3)。心、肝、脾和肾等其他组织均未见明显病理变化,结果见图4。
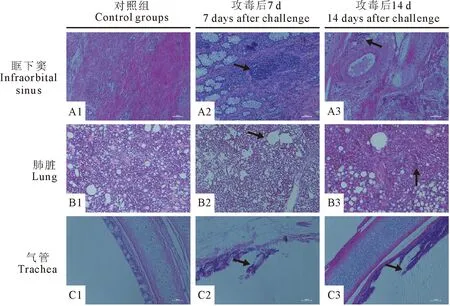
a1~A3.眶下窦切片;B1~B3.肺脏切片;C1~C3.气管切片A1-A3.Infraorbital sinus sections; B1-B3.Lung sections; C1-C3.Tracheal sections
a1~A3.心脏切片;B1~B3.肝脏切片;C1~C3.脾脏切片;D1~D3.肾脏切片A1-A3.Heart sections; B1-B3.Liver sections; C1-C3.Spleen sections; D1-D3.Kidney sections
3 讨论
鸡传染性鼻炎是鸡的一种急性上呼吸道传染病,在季节更替时尤其多发,主要以育成鸡和产蛋鸡发病为主。该病在世界范围内流行,已被中国、美国以及南非等多国报道[11]。近年来,我国多个地区发病率呈上升趋势,而且3个血清型均有流行,其中B型最多,A型次之,C型相对较少[5]。本研究对2016年5月至2017年2月从浙江杭州、浙江金华、安徽宣城、安徽黄山、浙江舟山和浙江宁波等8个养鸡场发现的疑似鸡传染性鼻炎发病鸡群采集的122份样品进行分离鉴定,副鸡禽杆菌阳性数为48个,阳性率为39.3%,8个养殖场的阳性率为36.8%~50.0%。对10株分离株进行生物特性分析,血清A型3株,血清B型4株,血清C型3株,A型、B型和C型3个菌株的阳性率分别为30%、40%和30%。以上结果表明江浙皖地区鸡传染性鼻炎流行依然很严重,3个血清型都存在。
接种灭活疫苗仍然是防控鸡传染性鼻炎的主要手段,目前主要有二价苗和三价苗[12-14]。然而,我国多地暴发鸡传染性鼻炎,甚至在接种了二价或三价灭活疫苗的鸡群中仍然发生,这给鸡传染性鼻炎的防控带来了困难。另外,不同血清型之间交叉保护性差,现有疫苗能否完全抵抗田间流行菌株对疫病防控是个挑战。本研究对江浙皖部分地区疑似鸡传染性鼻炎发病鸡场采样进行流行病学调查,经形态学、卫星现象试验、PCR鉴定和血清型鉴定进一步确认为副鸡禽杆菌,结果表明副鸡禽杆菌3个血清型均在流行。攻毒试验表明分离株人工感染SPF鸡出现鸡传染性鼻炎的典型症状,以呼吸道症状为主,面部肿胀、嗜睡、张口呼吸、鼻腔内有黄褐色干酪样渗出物,采食量和饮水量显著下降,面部和皮下组织出现不同程度的水肿,眼睑肿胀,发病率为60%~80%,A血清型(ZZ01株)致死率20%,说明分离到的菌株毒力较强。部分病死鸡肺脏出现淤血。病理组织切片观察发现眶下窦、肺脏和气管都有炎性细胞浸润以及气管黏膜层脱落,黏膜层及黏膜下层有淋巴细胞浸润,这与鸡传染性鼻炎典型症状一致[15]。
本研究从江浙皖不同地区分离获得了A型、B型和C型3种不同血清型的副鸡禽杆菌菌株,初步掌握了鸡传染性鼻炎流行情况及不同血清型菌株的毒力及致病力,为鸡传染性鼻炎的防控和三价疫苗研发奠定了基础。
