进展期胃癌术后生存相关影响因素分析
2024-05-09陈梦雅郑海伦邓晓晶
陈梦雅,邓 敏,郑海伦,邓晓晶
(蚌埠医科大学第一附属医院 消化内科,安徽 蚌埠 233004)
胃癌是指原发于胃的上皮源性恶性肿瘤。根据2020年中国数据[1],胃癌的发病率和死亡率在恶性肿瘤中位于第三位,我国胃癌发病率占全球胃癌的40%,大多数发现已是进展期,生存率较低。手术是胃癌唯一的根治性治疗方法[2],但仍有40%~80%的术后病人死于胃癌复发,研究[3]证实,辅助化疗是胃癌综合治疗不可或缺的重要手段,可显著提高病人手术成功率及术后生存时间,但世界范围内尚无标准、统一的胃癌围手术期化疗方案。近几年,胃癌的分子机制研究有了新的进展,可以利用靶向药物提高生存率,人表皮生长因子2(HER2)阳性胃癌病人在化疗方案中加入曲妥珠单抗可提高生存率[4]。Ki-67作为一种增殖标志物,可用于预测癌症的预后,研究[5]发现,Ki-67在癌细胞中表达水平相似,不受拷贝数变异影响,过度表达或者表达不足将带来不利影响。因此,探讨胃癌的临床特征、手术方式、病理特征及辅助化疗等与生存预后的关系,同时利用免疫组织化学法检测HER2和Ki-67等分子的表达,探索其对辅助化疗方案应答的预测,对胃癌治疗精准化、个体化具有重要的临床意义。
1 资料与方法
1.1 研究对象
本研究采用回顾性病例系列研究方法。病例纳入标准:2015-2018年在我院行胃癌根治术并且病例资料及随访资料完整的cⅡ~ⅣA期病人(第8版AJCC临床cTNM分期[6]),淋巴结清扫采用D2式。排除标准:(1)临床或病理或随访资料不完善者、中途失访者;(2)患有其他胃肿瘤(淋巴瘤、间质瘤、神经内分泌肿瘤,残胃癌等)或其他恶性肿瘤(如结直肠癌)的病人;(3)术前行辅助化疗的病人;(4)术中及术后4周内发现远处转移的病人;(5)未行胃癌根治及标准D2术的病人。根据上述标准,共筛选纳入577例病人。
1.2 分组方案
按手术方式分为开腹手术、腹腔镜下手术,并且淋巴结清扫采用D2式;按病理分为WHO分型(腺癌、印戒细胞癌、混合型)、Borrmann分型(结节隆起型、局限溃疡型、溃疡浸润型、弥漫浸润型);按化疗方案分为奥沙利铂+氟尿嘧啶类、以多西紫衫醇(TXT)为基础的化疗药、其他。
1.3 观察指标
主要观察指标为病人的5年无疾病生存期(DFS)及总生存期(OS),次要观察指标为化疗周期完成情况与预后的关系。
1.4 随访
采用电话随访,收集以下随访信息:术后肿瘤状态、是否复发、复发时间、是否出现转移、转移部位及时间、死亡及死亡时间、原因。分别计算DFS及OS,若病人未出现复发转移或者仍存活,以最后一次随访日期为截止日期,随访截至2022年7月18日。
1.5 统计学方法
采用χ2检验、Kaplan-Meier生存分析、Log-rank检验和Cox回归比例风险模型。
2 结果
2.1 进展期胃癌术后生存的单因素分析
577例进展期胃癌病例的中位DFS为48个月,中位OS为53个月,5年无疾病生存率和总生存率为47.8%、47.6%。病例中出现转移及复发294例(49.1%),1、3、5年无疾病生存率分别为72.6%、52.6%、47.8%;275例(47.7%)存活,1、3、5年总生存率分别为82.5%、54.2%、47.6%;死亡302例。
对577例临床病例资料进行Kaplan-Meier生存分析,结果显示,年龄、肿瘤部位、肿瘤直径、Borrmann分型、分化程度、淋巴结转移、神经脉管侵犯、浸润深度、临床分期、是否化疗、化疗周期、HER2是否阳性、Ki-67是否阳性是胃癌预后的相关因素,与胃癌的DFS及OS相关(P<0.05~P<0.01)(见表1)。HER2、Ki-67阳性及阴性的免疫组织化学染色结果见图1。
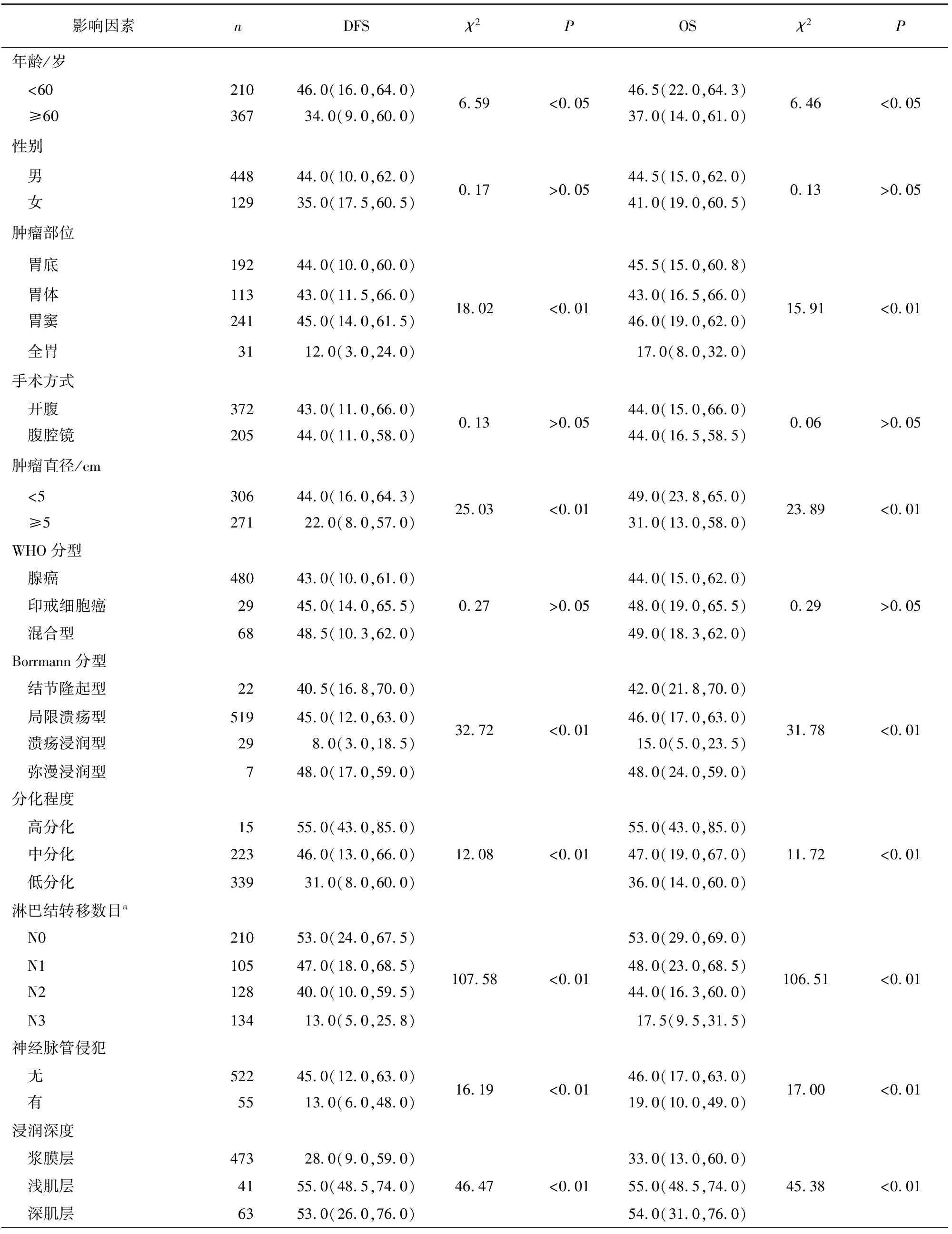
表1 影响进展期胃癌术后生存的单因素分析[M(P25,P75)]
2.2 进展期胃癌术后生存多因素分析
将单因素分析中与预后相关的因素进行Cox回归比例风险模型分析,结果显示,Borrmann分型、淋巴结转移、浸润深度、化疗周期、HER2及Ki-67是DFS的独立预后因素(P<0.05~P<0.01),Borrmann分型、淋巴结转移、浸润深度、化疗周期、HER2是OS的独立预后因素(P<0.05~P<0.01)(见表2)。由RR值可得出,HER2阳性、Ki-67阳性的复发危险分别为阴性的1.868倍、1.665倍,HER2阳性的死亡危险是阴性的1.832倍。

表2 临床特征对DFS及OS影响的COX回归比例风险模型分析
3 讨论
胃癌是最常见的消化道恶性肿瘤之一,虽然由于胃癌早诊早治概念的提出大大提升了胃癌的治愈率,但进展期胃癌仍有着较高的术后复发率,严重威胁病人的生命健康。研究[4]表明,胃癌是一种复杂的异质性疾病,进展期胃癌的生存周期与多种因素相关,根治性手术仍是唯一的治疗方式。本研究结果显示,对于进展期胃癌根治性术后病人,年龄、肿瘤部位、肿瘤直径、Borrmann分型、分化程度、淋巴结转移、神经脉管侵犯、浸润深度、临床分期、是否化疗、化疗周期、HER2是否阳性、Ki-67是否阳性是胃癌术后预后的相关因素,而性别、手术方式、WHO分型、化疗方案与胃癌病人的生存时间无明显相关性。表明胃癌的预后情况,有多种因素如病理特征等需要高度关注。

随着治疗技术的更迭,胃癌的主要根治方法已从单一手术治疗转变为包含化疗、放疗、靶向治疗等多种方法的综合治疗体系。但迄今为止,世界范围内尚没有统一共识。相较于欧美国家主张的围手术期化疗,亚洲国家(中国、日本、韩国等)指南推荐手术及术后包含铂类(顺铂、奥沙利铂)加氟嘧啶类(卡培他滨、替吉奥)的辅助化疗作为胃癌治疗的一线方案,同时根据HER2状态使用或不使用曲妥珠单抗[7]。研究[8]表明,奥沙利铂联合卡培他滨具有较好的安全性,同时改善病人DFS,奥沙利铂作为第三代铂类化合物,毒性作用较弱。在本研究中,50%以上病人使用了奥沙利铂+氟尿嘧啶类化疗方案,病人未进行化疗的中位DFS及OS分别为31个月和33个月,病人使用奥沙利铂和氟尿嘧啶类的中位DFS及OS分别为45个月和46个月。并且根据分析,术后化疗3周期以上明显提高了病人生存期。
近几年对胃癌的分子研究有新的进展,可以利用靶向药物提高生存率,例如,HER2阳性胃癌病人中使用曲妥珠单抗提高生存率,血管内皮生长因子受体抑制剂雷莫芦单抗作为单一药物或联合使用[4]。Ki-67作为一种增殖标志物,用于预测癌症的预后,基于53项研究和7 078例病人的Meta分析和系统综述[9],Ki-67的高表达预示着胃癌病人不良预后;此外,一项关于Ki-67对胃癌接受新辅助化疗预测意义的研究[10]表示,Ki-67的表达可能是疗效的决定因素。本研究中,HER2阳性的表达与生存预后有关,阳性病人的生存周期明显低于阴性病人。Ki-67阳性的中位DFS及OS分别为23个月及27.5个月,Ki-67阴性表达的DFS及OS分别为46个月及46.5个月,差异具有统计学意义。进展期胃癌常用Borrmann分型,有研究[11]表明,HER2阳性比例与胃癌病人Borrmann分型有关。研究[12]表明,BorrmannⅣ型是进展期胃癌的独立预后因素,预后通常比其他类型差。在本研究中,Ⅲ型及Ⅳ型的中位DFS及OS均低于Ⅰ型及Ⅱ型。迄今为止,尚未有广泛研究胃癌中HER2表达与Borrmann分型之间的关系,有待进一步研究。目前,抗血管生成治疗是胃癌研究的重视方向[13],但在一线用药中治疗进展期胃癌是否安全有效,临床试验正在进行中。
综上所述,进展期胃癌化疗周期、Borrmann分型、HER2是否阳性、Ki-67是否阳性等是生存预后的影响因素,提示这些指标是评估、预测病人病情及预后的辅助指标之一。此研究仍有一些不足之处,首先,本研究采用回顾性病例系列研究方法,可能会导致异质性和内部偏差;其次,数据来源仅限于我院就诊的病人,病人源具有地域性,关于病人的选择,可能存在一定的主观性;另外,多数病人虽在术后接受辅助化疗,缺乏针对病人的标准治疗方案,化疗方案使用不止一种,可能会存在偏倚,有待前瞻性、大样本量的标准化研究进一步探究。
