海蓬子(Salicornia europaea)生态浮床对富营养化海水的净化效果研究
2024-05-09罗梓峻李秋芬田文杰陈聚法
罗梓峻,李秋芬 ,田文杰,左 涛,陈聚法
(1.中国水产科学研究院黄海水产研究所,山东 青岛 266071;2.上海海洋大学水产与生命学院,上海 201306)
生态浮床通过栽种的植物生长吸收营养盐来处理水体的富营养化物质,这种模式能有效降低环境次生灾害的风险、提高区域生物丰度。生态浮床是以陆生植物为无土栽培对象,将人造浮床作为栽培介质进行易地移栽[1-2]。不同于人工湿地系统,生态浮床根系没有接触到沉积物,而是直接在水体中吸收污染物[3],茎部则始终处于水面上方。生态浮床一般由浮垫、固定介质和水培植株组成[4]。浮床不仅仅是水质处理的主体,也是扩大水体有益菌附着面积的载体,由茎、根、根系生物膜组成的处理系统共同完成污染物的截留和转化[5-6]。
浮床上的植物能正常存活生长是持续净化水体的首要条件。海蓬子(Salicorniaeuropaea)又称海芦笋、海胖子,是藜科(Chenopodiaceae)盐角草属(Salicornia)的一年生双子叶草本植物。海蓬子原产于盐碱海滨,后作为有机蔬菜、药材、饲料引进至我国华北地区种植[7]。海蓬子是耐盐程度极高的植物,并有极强的吸盐能力[8],能适应1%~5%盐度的种植条件,在3%~5%盐度的海水灌溉条件下生长最快,是迄今发现耐盐程度最高的植物之一[9]。其多生长于潮间带滩涂,能直接用海水浇灌,对于滩涂、盐碱地有机种植与治理综合利用有较好的效用。已有研究证实,在浮床种植模式下北美海蓬子对海水水质净化效果显著,植株在无土栽培下能很好利用水体营养物质完成自生的生长发育[10]。海蓬子在50%水面覆盖面积下对总氮吸收效率最高,达44.90%[11]。
笔者尝试利用欧洲海蓬子耐盐耐浸、对水体营养盐吸收较好的特点,搭建与褐牙鲆(Paralichthysolivaceus)共养的浮床循环水系统,持续产生养殖尾水,通过异位浮床处理,模拟近海、入海口的富营养化状态及海水净化处理条件[12]。海蓬子能在浮床上利用水体氮、磷等营养元素进行正常的生长发育[13]。该研究考察了海蓬子在富营养化水体的存活和生长能力,并探究海蓬子在浮床种植条件下对水体中氨氮(NH4+-N)、硝态氮(NO3--N)、亚硝态氮(NO2--N)、磷酸盐(PO43--P)的净化效果,可为我国北方海水养殖尾水净化排放及富营养化的入海口和近海海水环境修复提供物质基础和技术支撑。
1 材料与方法
1.1 实验材料
实验所用海蓬子幼苗采集于潍坊市昌邑市下营镇潍河河滩,在采集前使用卷尺测量,根据采集地海蓬子植株大致形态分布,选择地上部高17.00~18.00 cm的海篷子苗,采集后利用实验室天平再次筛选7.00~8.00 g苗种,保证植株的形态相似、质量相当。幼苗经过移栽或多或少出现水土不服或伤根断根等情况,所以先将采集的海蓬子幼苗在盐度较低的浮床水培池暂养15 d,待幼苗在培育池中长出较密集新根后再开展实验。循环水的盐度设置为25‰,为海水与地下水混合,养殖所用的海水取自山东青岛黄海,已经过水塔净化过滤。
实验所需的模拟富营养化海水来自褐牙鲆养殖池,褐牙鲆规格为10.00±2.00 g,鱼苗进入养殖槽前用15.00 mg·L-1高锰酸钾溶液水浴15 min。使用1台供气量为60 L·min-1的增氧泵为养殖池供气。植物浮床床体选用24孔EPE可发性聚乙烯材质材料[14],海蓬子幼苗用种植海绵塞固定于EPE浮床种植孔中,种植海绵在水体吸水后膨胀,能保证植物幼苗不会脱落并充当部分根系附着基。褐牙鲆养殖池和浮床净化池为200 cm×100 cm×60 cm的水泥池,实际水位高度30 cm,紫外杀菌池选用720 mm×520 mm×440 mm的蓄水箱,系统实际流动水量约为1 200 L。
1.2 实验方法
1.2.1模拟富营养化海水及海蓬子浮床净化系统
为考察海蓬子对富营养化水体的持续净化能力,构建了由褐牙鲆养殖池(Z1)和植物净化池(W1)、紫外杀菌池构成的模拟富营养化海水及海蓬子浮床净化循环水系统(以下简称“循环水系统”,图1),3个池之间通过可控流量水泵连接,地点位于中国水产科学研究院黄海水产研究所琅琊基地,同时设置一套不投放植物浮床的空白对照组,由褐牙鲆养殖池(Z2)、空白池(W2)组成,其余条件与实验组相同。净化池中浮床植物的栽种按照每组生物量一致、形态质量互补搭配。
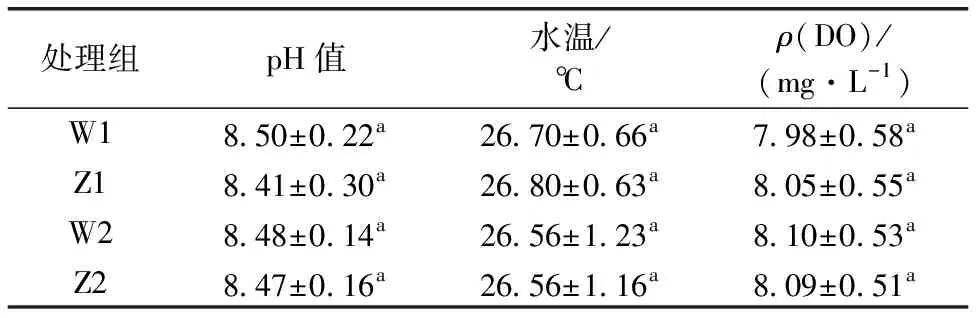
表1 系统环境指标
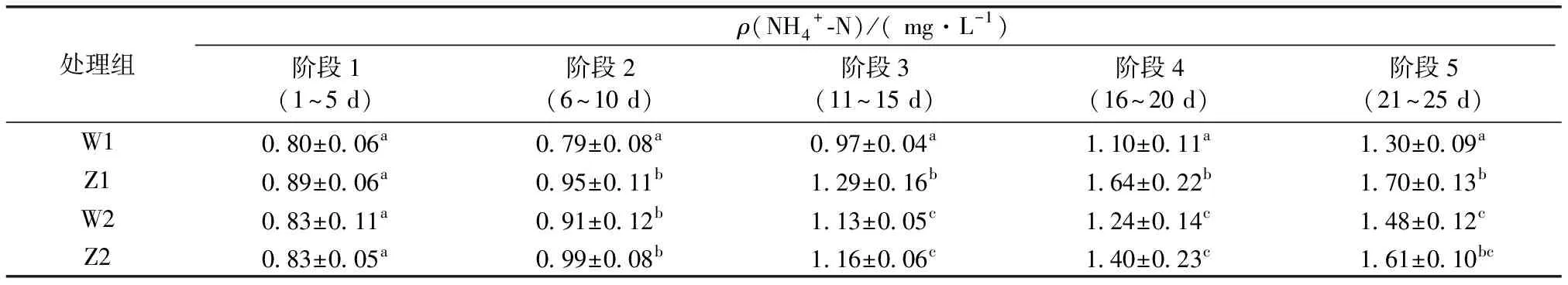
表2 各实验阶段系统NH4+-N浓度
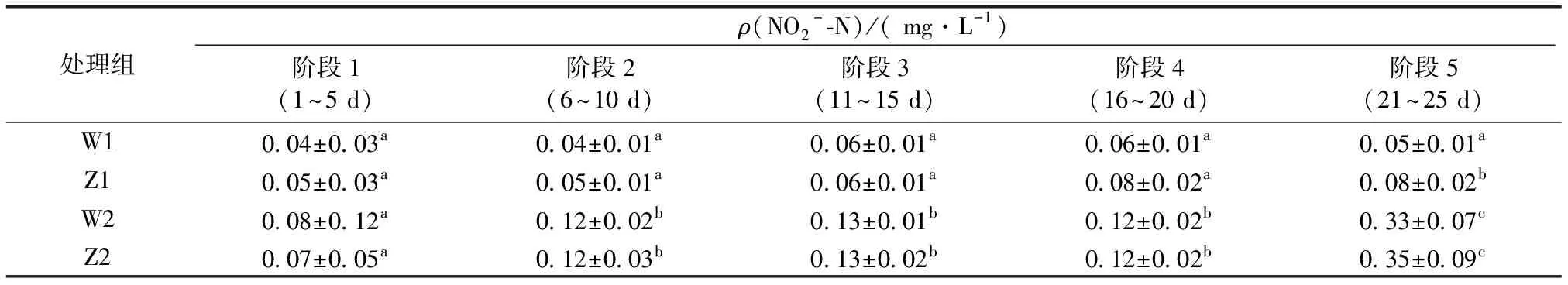
表3 各实验阶段系统的NO2--N浓度
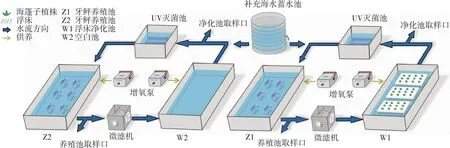
图1 模拟富营养化海水及海蓬子浮床净化系统与对照系统示意
向每组系统的养殖池投放100尾褐牙鲆幼苗,向实验组植物净化池投放3块海蓬子浮床装置,覆盖生物量约为650 g·m-2,利用水泵从养殖池抽水至植物净化池,再引水至紫外杀菌池,紫外光灯不间断照射杀菌后由水泵回流至褐牙鲆养殖池,净化池与褐牙鲆养殖池的水力停留时间(HRT)设置为12 h。实验期间每天对鱼苗进行2次连续投喂,投喂饲料量为总体重的5%~10%。实验期间除加注因池塘渗漏和蒸发损失的水之外不再换水,利用海水补充蓄水池,补充量不超过10%。
1.2.2海蓬子对养殖废水中无机盐营养的吸收
实验期间,每天从植物净化池(W1)、空白池(W2)和褐牙鲆养殖池(Z1、Z2)出水口取水样测定水质指标(图1),考察加海蓬子的净化系统与对照系统无机营养盐浓度的差异及HRT对植物净化效果的影响,采样时间为当天第2次投喂前1 h,取样减少的水量立即用等量养殖水补足。测定指标包括NH4+-N、NO3--N、NO2--N、PO43--P浓度,测定方法参照GB 17378.4—2007《海洋检测规范 第4部分: 海水分析》,NH4+-N浓度采用次溴酸盐氧化法测定,NO2--N浓度采用萘乙二胺分光光度法测定,NO3--N浓度采用锌-镉还原法测定,PO43--N浓度采用磷钼蓝分光光度法测定,同时每天用便携式水质检测计对各组的水温、pH值和DO浓度等环境指标进行监测。
1.2.3植株生长指标测定
在海蓬子浮床净化水质期间观察记录海蓬子的存活和生长状况,及时清理死亡植株,以植株长度和质量的增加量作为生长指标,实验期间每5 d记录一次净化池海蓬子死亡数量,以植株枯黄倒伏叶片脱水、根系发黑脱落为死亡标准,其中长度测定是将海蓬子植株从浮床上取出,在平面上伸展后,用直尺从植株从叶顶部到根底部进行测量,每组浮板选取5株进行测量并计算平均值;将取出的海蓬子用吸水纸吸干根部水分,放置于电子天平上测量,每组浮板选取5株测量湿重并计算平均值;将整株植物从培养槽中完整取出,分成地上部、地下部。再将鲜样品材料置于105 ℃烘箱中杀青30 min,转至80 ℃烘24 h ,称得干重。
1.3 数据分析处理
使用Excel 2016软件统计数据,采用SPSS 24.0软件对2组系统不同区域的水质差异进行单因素方差分析,利用OriginPro 2022软件绘制水质变化趋势。
2 结果与分析
2.1 系统环境指标情况
系统运行初期各组间pH值、水温、DO浓度如表1所示。实验期间的池塘水体pH值在8.41~8.50之间,平均水温在26.56~26.80 ℃之间,ρ(DO)在7.98~8.10 mg·L-1间,各组间的pH值、水温和DO浓度无显著差异,海蓬子浮床的投放对3类环境因素的影响不明显。
2.2 海蓬子浮床对氨氮的净化效果
NH4+-N在不同运行阶段的浓度及差异的显著性如表2所示,阶段1的ρ(NH4+-N)为0.70~1.00 mg·L-1,净化池(W1)稳定,空白池(W2)则波动幅度较大,但W1与W2之间尚未出现显著差异,可能是水体中的残饵与褐牙鲆粪便堆积量较少,海蓬子植株还处于根系生长和水体适应阶段,净化效果不明显。第1阶段之后(6~25 d)W1和W2的NH4+-N浓度都有明显的上升趋势,ρ(NH4+-N)分别从0.70和0.74 mg·L-1累积到1.45和1.71 mg·L-1,W1的NH4+-N浓度显著低于W2。
将净化系统内不同区域的水质进行对比,如图2~3所示。Z1作为褐牙鲆的养殖池,饲料和残饵直接在该池溶解,实验阶段1养殖池Z1的NH4+-N浓度相对稳定,ρ(NH4+-N)从第2天开始上升,25 d内最大达1.92 mg·L-1,而净化池W1中的NH4+-N浓度因海蓬子的吸收作用而缓慢上升。阶段2至阶段5净化池W1的NH4+-N浓度均与养殖池Z1存在差异,海蓬子浮床对NH4+-N的去除率随时间增长逐步升高,运行期间平均去除率为21.77%,动态去除率在第4阶段(16~20 d)最高,为32.97%,说明在净化池中海蓬子截留吸收NH4+-N的效果明显。
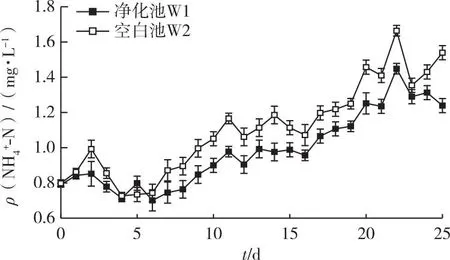
图2 净化池和空白池中NH4+-N浓度的变化趋势
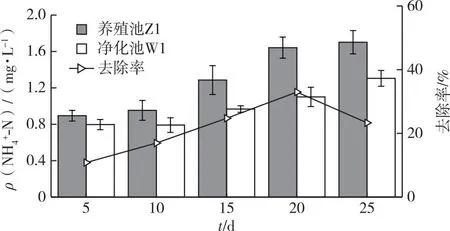
图3 净化系统中养殖池与净化池NH4+-N浓度的差异
2.3 浮床系统对NO2--N的净化效果
在实验不同运行阶段取样点的NO2--N浓度均值及其差异显著性如表3所示。阶段1养殖池中粪便堆积量较少,净化池中硝化/反硝化作用尚不明显,因此W1与W2的NO2--N浓度水平相似。3~5 d W1与W2水体中的NO2--N浓度分别在提升至0.08和0.16 mg·L-1后下降并趋于稳定(图4)。阶段2 W2的NO2--N浓度远高于W1,平均浓度相差0.08 mg·L-1。随着时间延长,W2池中出现鱼苗死亡的情况,18 d时NO2--N浓度开始急剧升高。而W1的NO2--N水平稳定在0.03~0.08 mg·L-1之间。阶段2至阶段5,W1的NO2--N浓度显著低于W2,说明海蓬子浮床在处理富营养水体时对NO2--N的抑制有较显著的效果。
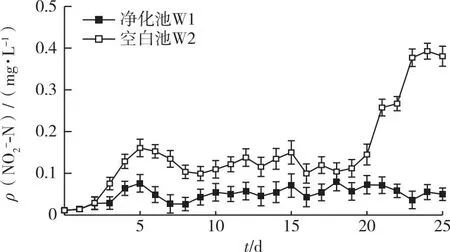
图4 净化池和空白池中NO2--N浓度的变化趋势
如图5所示,W1池的ρ(NO2--N)平均值由0.04上升至0.05 mg·L-1,Z1池由0.05上升至0.08 mg·L-1。从去除率可以看出,在同一系统中的净化池W1与养殖池Z1之间的NO2--N浓度也具有一定的差异,NO2--N在系统运行期间的平均去除率为20.03%。6~20 d去除率虽有下降趋势,但随着实验时间延长,NO2--N的去除率持续提升,动态去除率在第5阶段(21~25 d)最高,为35.66%。
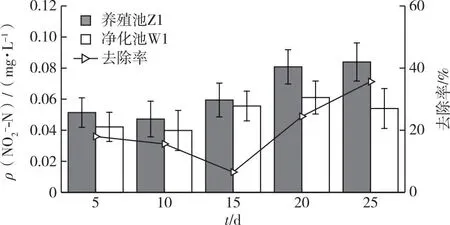
图5 净化系统中养殖池与净化池NO2--N浓度的差异
2.4 浮床系统对PO43--P和NO3--N的净化效果
2个系统中的ρ(PO43--P)呈逐渐上升趋势。净化池W1在23 d时最高,达0.61 mg·L-1,23 d之后稳定在0.57~0.61 mg·L-1。空白组W2的ρ(PO43--P)在23 d时最高,为0.76 mg·L-1,并有继续升高的趋势。净化池中的PO43--P浓度始终稍低于空白池(图6),但W1与W2的浓度差异仅在阶段5显著,同时实验池内部W1与Z1之间浓度差异各阶段皆不显著。
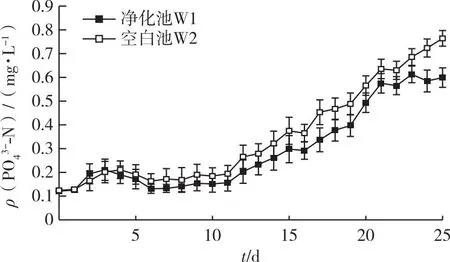
图6 净化池和空白池中PO43--N浓度的变化趋势
2个系统中NO3--N浓度一直处于逐渐累积的状态,W1和W2在25 d内的ρ(NO3--N)最高,分别为27.96和30.61 mg·L-1。W1浓度稍低于W2,但各阶段组间浓度差异不显著,W1与Z1之间各阶段NO3--N浓度差异同样不显著(图7)。由此可见,海蓬子对PO43--P和NO3--N有一定吸收能力,但低于对NH4+-N和NO2--N的吸收。
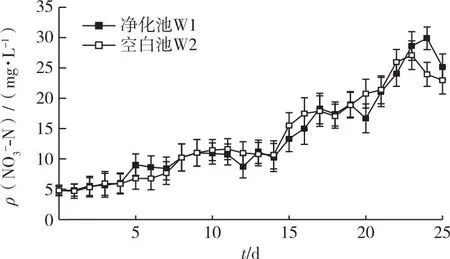
图7 净化池和空白池中NO3--N浓度的变化趋势
2.5 海蓬子植株生长状况
实验6~10 d净化池W1中海蓬子植株还处于对水体的适应阶段,根部较为薄弱,枯萎数量较多,多为断主根或细小植株,生长速度也较慢。10 d之后海蓬子植株存活率趋于稳定,根部发育完善,株体下部在水培之后生出明显的白色新根,水上部茎叶苍绿饱满,鳞片状叶间长出分支,吸水和吸收营养能力增加,植株高度明显增长。植株宽度的增长速度也很快,说明在此期间海蓬子对水体的营养物质吸收率较高,且较多转换为自身的营养积累。从浮床净化池对水体中营养盐的去除趋势也能看出,去除率的高低与植株质量成正相关。
经过25 d浮床培养,W1池中海蓬子的存活率虽然逐渐下降,但能保持在93%以上,25 d的存活率为93.33%。经测定,植株的各项生长指标得到明显增长(表4),植株的总体长度增长约12%,鲜重增加102%,干重增加83%。从干鲜重增加比看出,鲜重的增量高于杀青之后干重的增量,推断其原因可能是海蓬子的叶型紧凑饱满,植株吸收大量水分储存于叶片中,用于缓解极端盐胁迫的情形,说明在采集和培育海蓬子时尽量不伤及植株根部,经过一定时间的缓冲就能够较好地在富营养化海水中实现无土栽培,并通过吸收营养盐起到减轻富营养化的作用。
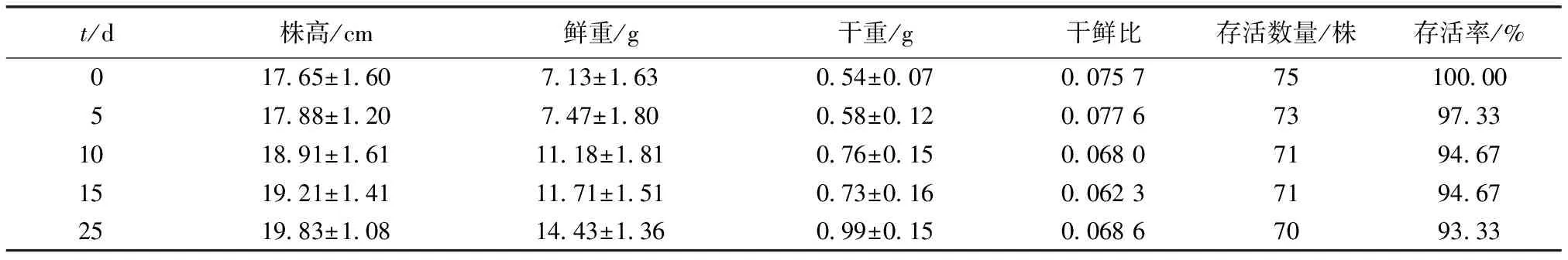
表4 海蓬子生长状况
3 讨论
3.1 生态浮床净化能力的影响因素
浮床结构能够提供充分的植物截留水体无机盐离子的条件,促进植株生长吸收NH4+-N。有研究表明,生态浮床对NH4+-N的去除是比较显著的,添加人工填料的浮床系统对NH4+-N吸收效果更为显著,最高平均去除率可达57.90%,其在植物根系、微生物膜和填料之间可能存在协同作用[15]。该研究中NH4+-N平均最高去除率为32.97%,达到较好的NH4+-N去除效果,若进一步改善浮床工艺条件NH4+-N去除效果或能更佳。根系是截留无机盐的主要组织,海蓬子是具有发达根系的盐碱地植物,在土壤种植情况下,植株的冠根比受到环境因素的显著影响,与土壤的含盐量成反比[16]。在浮床无土栽培条件下,植株在水体中形成发达的根系结构,因此拥有更小的冠根比,其地下部分几乎与地上部等长,也能为根际脱氮微生物的附着提供良好的条件。海蓬子浮床对NO2--N的去除效果显著,平均去除率最高为35.66%。南春容等[10]的研究证明,NH4+-N和NO2--N有优先吸收作用,这与该实验的结果一致。实验中期根系发育更加完善,对营养盐需求增加,转换效率更快。在高盐环境的氮素刺激下,盐角草氮同化关键酶的活性更高,盐角草在高盐环境的氮吸收能力也随之增高[17]。刘育等[18]的湿地系统中,芦苇、美人蕉、香根草和风车草对NO2--N的吸收率分别为26.30%、29.90%、23.80%和23.20%,低于该研究的NO2--N去除率。相较于湿地模式,浮床的植物根系悬浮于水体,根系和微生物膜能更好地截留水体的NO2--N。
浮床对PO43--P和NO3--N有一定去除效果,但不明显,其影响因素较多,可能与植物种类及生物量有关,水体中的PO43--P和NO3--N可能不是海蓬子发育生长所需的主要元素,同时循环尾水中的某些无机盐已远超植株可吸收浓度。邵学新等[19]的研究发现,植物磷储量与生物量呈正相关。洪华生等[20]对厦门港的海洋调查发现,吸收海水PO43--P的主体是浮游植物。浮床种植工艺的选择对无机盐的吸收也有很大影响。该研究的浮床属于传统浮床(T-EFB),而没有使用挂篮填料作为植物生长基质的结合浮床(C-EFB),例如使用明矾泥作为基质的美人蕉浮床对水体PO43--P和NO3--N的吸收有较好效果[15]。可见,不同基质对无机盐的吸收效果存在差异,需要根据水质情况选用不同的基质材质进行栽种。唐伟等[2]的研究表明,水生植物生长会增强其对水体的脱氮能力,生物量增多是影响脱氮的最主要因素。
贾军等[21]的研究表明,同等条件下4.5 h的HRT对PO43--P的吸收效果最好。高书伟等[22]的反硝化系统验证了20 h是NO3--N的最佳处理HRT。而该研究条件下12 h的HRT对NH4+-N和NO2--N处理效果较好,说明不同类型无机盐截留和转化所需时间具有差异。未来在相同处理条件下可设置不同的HRT,来探究海蓬子对无机盐的吸收效果差异。浮床铺设的覆盖面积和生物量与不同水质指标的净化效果具有一定的关联性,覆盖面积与TN、CODMn、BOD5的去除率呈正相关[23]。吴英杰等[11]讨论了海蓬子不同栽种量与氮、磷吸收的关系,在约800 g·m-2覆盖密度下TN和NO3--N处理效果最好,在约1 200 g·m-2覆盖密度下TP的处理效果达到最佳。下一步将针对海蓬子生物量与不同种类营养物质吸收量的变化关系进行进一步探究,有助于确定海蓬子栽植量与污染水体的最佳搭配。
3.2 生态浮床净化海水的作用植物筛选
利用生态浮床净化污水的关键因素是植物能否在污水中存活,而富营养化海水的净化对植物的耐盐性有更高的要求,因此海水净化浮床植物的筛选除了考虑耐浸性,还要考虑耐盐性。研究筛选的耐盐植物海蓬子可以在海水中很好地存活,解决了海水净化物种的难题。有研究选用碱蓬作为生态浮床的作用植物,但海蓬子较碱蓬在海水中存活率更高,存活的时间更长,这可能与其比碱蓬有更强的吸盐能力有关。海蓬子地上部生物量的贮存和组织内的离子转移共同完成吸盐过程,使得海蓬子在盐胁迫下组织内的盐离子浓度显著高于碱蓬等其他藜科植物[8,24-25]。植物胞质中Na+浓度对植物内K+的平衡以及微量元素吸收、酶活性、新陈代谢和光合作用产生极大影响[26],海蓬子在极盐条件下如何保持Na+/K+平衡尚需进一步探究。海蓬子的高耐盐性还可能与某些基因表达有关,如郝晓燕等[27]的研究发现,盐角草中的SeP5CS基因受植物盐胁迫后诱导表达,推测该基因在盐角草抵御盐胁迫逆境中起着重要作用。在生态系统中植物密度调控机制影响下,群落优势物种常发生更替[28],相较于互花米草这类有较强入侵性的物种,以土著植物海蓬子作为海水净化工具物种,能有效限制物种的扩散,投放于自然环境中能减少产生次生灾害的风险。
3.3 生态浮床改进展望
下一步可继续深入探究海蓬子浮床对单一无机盐因素的吸收效果和效率。该研究中部分死亡植株的主根有明显的断痕,推测其主要的死亡原因与采集时对海蓬子根系的损伤有关,因此可继续探究改进浮床制作和栽种工艺,提高植物生长存活稳定性及其吸收效果。根据浮床运行条件设置系统的不同运行阶段,加入浮床微生物的接种阶段和间断性曝气阶段或可对无机盐的吸收产生显著效果[15]。同时,应检验海蓬子浮床在开放海域环境下的抗逆性和净化效能,改进浮床设计,这对利用其搭建完善浮床设施以改善富营养海水水质具有重要的意义。
4 结论
以海蓬子为浮床栽种材料,通过模拟的富营养化海水系统进行净化实验,结果显示,12 h的HRT下海蓬子浮床对NH4+-N和NO2--N去除效果显著(P<0.05),最高去除率分别为32.97%和35.66%;对NH4+-N和PO43--P有一定去除效果,但不明显。通过浮床水培的海蓬子存活率可达93%以上,且生长状态良好,植株的总体长度增长约12%,鲜重增加102%,干重增加83%,说明原生于滩涂的植物通过处理也能直接置于富营养化海水中存活。该研究也为富营养化海水的浮床处理技术和海蓬子的进一步拓展应用提供了参考。
