十二烷基苯磺酸钠暴露对黄颡鱼(Pelteobagrus fulvidraco)胚胎发育毒性和仔鱼神经毒性的影响
2024-05-09田海军姜汉军任胜杰杨治国
田海军,姜汉军,任胜杰,杨治国
(1.信阳农林学院水产学院,河南 信阳 464000;2.浙江淡水水产研究所,浙江 湖州 313001)
表面活性剂被广泛应用于工农业生产和日常生活中,可显著改变表(界)面的物理化学性质,具有润湿、乳化、起泡以及增溶、分散、洗涤、防腐、抗静电等多项功能[1]。据中国洗涤用品工业协会统计预测,2022年我国表面活性剂市场总量达461.5万 t,预计未来几年内将呈现增长的发展态势[2]。表面活性剂中阴离子型占比最多,约占65%~80%[2]。阴离子型表面活性剂统称直链烷基苯磺酸钠(LAS),国内检出频率较高的是十二烷基苯磺酸钠(sodium dodecyl benzene sulfonate,SDBS)[3]。此外,水体阴离子表面活性剂相关分析方法中使用的参考标准物质也均为SDBS。
阴离子表面活性剂随着工农业和生活污水进入水环境中,在水面形成泡沫,会破坏水体溶解氧的动态平衡,造成水质恶化,影响水生生物的生长。GB 3097—1997《国家海水水质标准》规定:1类海水中ρ(LAS)≤0.03 mg·L-1,2~4类海水中ρ(LAS)≤0.1 mg·L-1。GB 3838—2002《地表水环境质量标准》规定ρ(LAS) ≤ 0.20 mg·L-1。
诸多学者开展了表面活性剂对水生生物毒性研究,水体SDBS的毒性研究对象有凡纳滨对虾(Litopenaeusvannamei)[4]、安氏伪镖水蚤(Pseudodiaptomusannandalei)[5]、黄河鲤(Cyprinuscarpio)[6]、褐点石斑鱼(Epinephelusfuscoguttatus)[7]、刺参(Apostichopusjaponicus)[8]、双小核草履虫(Parameciumprimaurelia)[9]、中华倒刺鲃(Spinibarbussinensis)[10]、奥尼罗非鱼(Oreochromisniloticus)[11]和大鳞副泥鳅(Paramisgurnusdabryanus)[12]等。上述研究集中在急性毒性及生理生化影响方面,有关环境相关浓度下SDBS对鱼类的亚急性毒性效应尤其是神经毒性方面的研究尚鲜见报道。
黄颡鱼(Pelteobagrusfulvidraco)肉质鲜美,是我国的特种经济养殖鱼类之一。环境问题严重制约了黄颡鱼养殖的健康持续发展,如水污染等给黄颡鱼养殖带来严重影响[13-14],急需加强水环境污染物对黄颡鱼影响的机理研究。当前尚未有SDBS对黄颡鱼毒性的相关研究报道。黄颡鱼作为毒理学实验材料,具有繁殖技术成熟、胚胎发育观察容易、全基因组测序已完成、便于开展分子毒理学研究等优点。
水环境暴露能更真实地反映SDBS等阴离子表面活性剂在实际环境中的暴露影响情况,有利于科学评估阴离子表面活性剂的水环境生态风险。为评估水体SDBS浓度对黄颡鱼早期发育阶段的胚胎发育毒性和神经毒性的影响,笔者探讨了不同SDBS浓度暴露下黄颡鱼胚胎的孵化死亡率和畸形率,检测了仔鱼脑组织的乙酰胆碱酯酶活性及相关基因的转录水平以及5-羟色胺含量及相关基因的转录水平,探讨其神经毒性的潜在机制,为进一步评估水体阴离子表面活性剂污染对水生动物的毒性作用机制提供借鉴和参考。
1 材料与方法
1.1 实验动物
实验用黄颡鱼亲本来自武汉市水产科学研究所,亲本雌雄比例为1∶1,雌鱼体长(171.3±9.0)mm,体重(101.4±16.5)g;雄鱼体长(242.1±11.6)mm,体重(193.4±19.6)g。亲本共300尾在学院实训基地水泥池中流水加曝气方式培育,设棕榈产卵巢,半球形(直径25 cm,深12 cm);培育水温(24.5±0.3)℃,pH值 为7.0~7.5,ρ(DO)为6.70~9.50 mg·L-1;光暗周期为12 h∶12 h,每日投喂 2 次黄颡鱼专用饲料。黄颡鱼产卵后收集并清洗受精胚胎,置于培养箱中,温度设置为(24.5±0.3)℃,于 4 h 后置于显微镜下挑除死亡胚胎,选取正常发育受精胚胎,分组暴露于不同浓度的SDBS溶液中。
1.2 主要试剂与仪器
试剂:SDBS为分析纯(国药集团河南化学试剂有限公司),乙酰胆碱酯酶(AChE)和5-羟色胺(5-HT)试剂盒(南京建成生物工程研究所)。
仪器:体式显微镜(Olympus-SZ61,日本奥林巴斯),全自动样品冷冻研磨仪(JXFSTPRP-64L,上海净信),高速冷冻离心机(Eppendorf 5424R,德国艾本德),酶标仪(DR200-BC,无锡德朗),荧光定量PCR仪(CFX-96,美国Bio-Rad)。
1.3 胚胎及仔鱼暴露实验
随机挑选受精 4 h 后发育正常、大小相近的黄颡鱼胚胎进行染毒暴露实验。参考GB 3838—2002规定,结合课题组前期测定SDBS对黄河鲤急性毒性和生理生化指标的影响[6]以及淮河上游大型水库水样中阴离子表面活性剂浓度部分断面超标(0.3~0.8 mg·L-1)的实际现状,确定 0、0.2、0.4、0.6、0.8 mg·L-1作为实验暴露质量浓度(配制SDBS溶液的水质为超纯水,实测质量浓度分别为0、0.19、0.38、0.58、0.77 mg·L-1,后面统一为设计暴露浓度),间隔 24 h更换新配制的暴露溶液,以保证浓度恒定。设置 3 组平行,暴露实验容器采用 12孔细胞培养板,每孔放置 30 枚胚胎,暴露溶液每 24 h 更换1次,保证各组浓度保持不变。暴露期间水温保持(24.5±0.3)℃,光暗周期设置为 12 h∶12 h。及时挑出死亡胚胎以防对其他胚胎造成污染,并统计胚胎孵化累计死亡率和畸形率(畸形胚胎数/孵化脱膜胚胎总数×100%),胚胎发育中如出现卵黄异常、脑和脊髓分化异常、体弯曲、心包异常等现象均统计为胚胎畸形。暴露至孵化出5日龄仔鱼停止。
1.4 神经递质乙酰胆碱酯(AChE)酶活性和5羟色胺(5-HT)含量
每个暴露组随机取6尾5日龄正常仔鱼的脑组织混样。另外,每个暴露组采集全部的5日龄成活畸形仔鱼脑组织进行混样,共30个生物学重复。用去离子水清洗 2~3 次,加入0.1 mol·L-1磷酸盐缓冲液 300 μL,置于 2.5 mL离心管内 4 ℃匀浆 400 s,加入 700 μL磷酸盐缓冲溶液进行清洗转移。4 ℃下 2 500 r·min-1离心 10 min(离心半径为13.5 cm),取上清液待测AChE酶活性和5-HT含量。在酶标仪上测定吸光度值,记录并处理数据。
1.5 荧光定量 PCR 检测相关基因的相对表达量
每个暴露组取10尾5日龄仔鱼脑组织混样作为一个重复,共3个生物学重复,液氮速冻后储存在-80 ℃冰箱中以进行基因表达分析。置于冰上匀浆,用 TRIzol 试剂抽提总RNA,逆转录为 cDNA,引物序列见表 1。PCR 反应程序设定如下:cDNA 模板2.0 μL,正、反向引物(10 μmol·L-1)各1.0 μL,荧光预混液12.5 μL,双蒸水8.5 μL,95 ℃ 预变性3 min,95 ℃变性10 s,55 ℃退火10 s,72 ℃ 延伸20 s(循环40 次),72 ℃最终延伸5~10 min。设定对照组仔鱼的乙酰胆碱酯酶基因(ache)、5羟色胺基因(5-ht)的 mRNA 相对表达量为1.00,结果采用2-ΔΔCt相对表达量算法确定 mRNA 的相对表达量。
1.6 统计学分析
数据统计分析采用SPSS 26.0软件进行,统计学差异采用单因素方差分析(one-way ANOVA)和邓肯检验(Duncan′s test)比较,检验时需验证数据的方差齐性(方差不齐时可采用Welch ANOVA或Brown-Forsythe ANOVA进行分析),P<0.05表示有显著性差异。
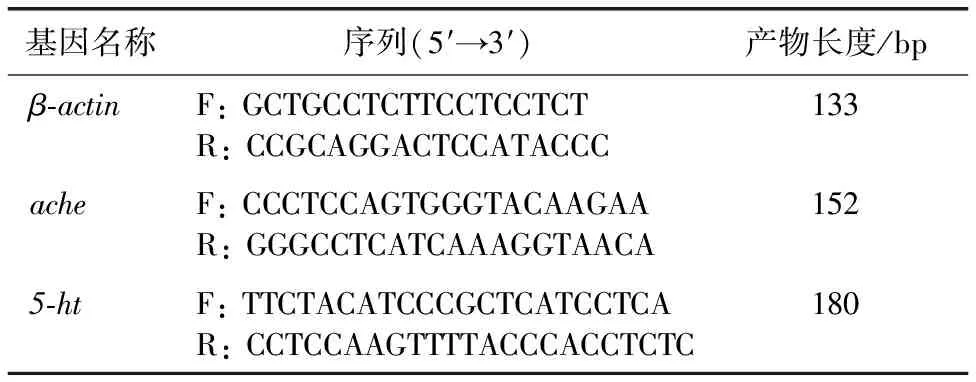
表1 神经递质相关基因荧光定量PCR引物序列
2 结果与分析
2.1 胚胎孵化累计死亡率与畸形率变化
如图1所示,与对照相比,不同暴露浓度下黄颡鱼胚胎孵化死亡率和胚胎畸形率分别提高7.8~23.4和4.5~14.5百分点,均呈显著上升趋势(P<0.05)。
同一幅图中直方柱上方英文小写字母不同表示不同暴露浓度间某指标差异显著(P<0.05)。
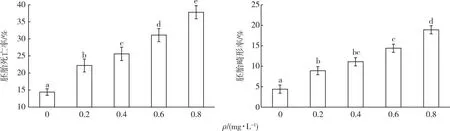
如图2所示,显微镜(4×10倍)观察发现,暴露处理后黄颡鱼胚胎存在着心包水肿(心脏异常)、卵黄水肿、身体卷曲、脊椎弯曲、头部畸形等现象。
a—心包水肿,b—卵黄水肿,c—身体卷曲,d—脊椎弯曲,e—头部畸形。
2.2 神经递质AChE酶活性和5-HT含量变化
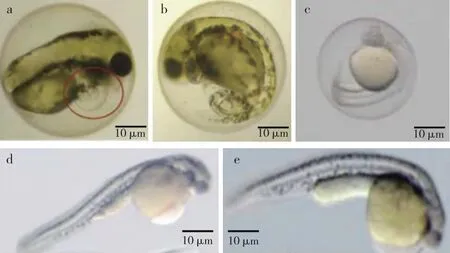
如图3所示,伴随着暴露浓度的升高,黄颡鱼仔鱼脑组织AChE酶活性和5-HT含量呈下降趋势,均显著低于对照(P<0.05)。与对照相比,各剂量暴露组正常仔和畸形仔鱼脑组织AChE酶活性分别显著降低12.0%~50.5%和15.0%~53.9%(P<0.05),5-HT含量分别显著降低2.6%~9.9%和3.0%~11.1%(P<0.05)。
同一幅图中直方柱上方英文小写字母不同表示不同暴露浓度间某指标差异显著(P<0.05)。
2.3 脑组织ache和5-ht基因mRNA相对表达量变化
如图4所示,不同暴露浓度下仔鱼脑组织ache和5-ht基因相对表达量随SDBS暴露浓度的升高而下降。与对照相比,ache基因mRNA转录水平在高浓度暴露组(0.8 mg·L-1)中被显著抑制(P<0.05),5-ht基因mRNA转录水平在0.4~0.8 mg·L-1浓度暴露组中被显著抑制(P<0.05)。
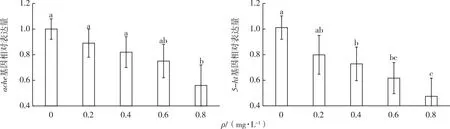
同一幅图中直方柱上方英文小写字母不同表示不同暴露浓度间某指标差异显著(P<0.05)。
3 讨论
3.1 SDBS暴露处理对黄颡鱼胚胎影响及细胞毒性机制
SDBS暴露处理的黄颡鱼胚胎孵化畸形率提高了4.5~14.5百分点(P<0.05),死亡率提高了7.8~23.4百分点(P<0.05)。与叶辽辽等[12]测得ρ(SDBS)≥ 2.5 mg·L-1时大鳞副泥鳅(Paramisgurnusdabryanus)胚胎孵化率下降、畸形率上升有一定差异。上述结果证实SDBS暴露会导致胚胎孵化率下降和畸形率上升,但是效应浓度不同可能是不同鱼种的敏感性及孵化水温差异等因素导致。分析其胚胎发育毒性的原因,可能是SDBS与细胞膜表面疏水部分结合,破坏了胚胎细胞膜结构[15]。另外,由于SDBS暴露时会形成泡沫,可能导致水体溶解氧浓度下降,间接造成胚胎发育影响。同时,SDBS能通过抑制机体的抗氧化作用从而造成细胞遗传物质的损伤,影响DNA转录与表达等[16]。郑璐[17]研究发现,6种表面活性剂均能引起细胞质粒pBR322的DNA损伤,分析其原因为表面活性剂与细胞质粒DNA直接结合导致。在这6种表面活性剂中磺酸型表面活性剂诱导细胞DNA损伤的毒性较强,推测其具有一定的遗传毒性。孔帅[18]研究了阴离子表面活性剂导致细胞毒性的完整过程,通过荧光显微镜在线观察到HPTS-Cn阴离子荧光表面活性剂首先与人皮肤成纤维细胞(HF)、人肝癌细胞系(HepG2)和人肝星形细胞(LX-2)细胞膜结合,随后进入细胞并聚集在内质网上,造成内质网的肿胀;同时,还观察到了细胞骨架的破坏、隧道纳米管(TNTs)的断裂以及囊泡的产生。吴光洁[19]研究发现,随着十二烷基苯磺酸异丙胺盐暴露浓度的增加,鲤鱼肝细胞损伤逐渐加重,出现肝细胞空化、核迁移、核溶解、肝血窦扩张充血等现象。以上研究初步探讨了阴离子表面活性剂对细胞的毒性影响,但具体的细胞毒性机制需要更进一步的研究。
3.2 SDBS暴露处理对黄颡鱼神经毒性及机制
ACh和5-HT是神经元间重要的信息传递物质,其含量水平与黄颡鱼的各项生理活动密切相关。测定黄颡鱼脑组织中能够调节ACh信息传递活动的AChE酶活性来作为神经行为变化的进一步证据。AChE酶能够降解神经递质乙酰胆碱,与神经传导密切相关,对黄颡鱼胚胎的神经发育至关重要,是常被用于评估神经毒性的生理学指标之一[20]。当AChE酶活性受到抑制时会导致乙酰胆碱在突触和神经肌肉接头处过度积累,进一步影响正常的神经传递进程。实验结果表明,经过十二烷基苯磺酸钠暴露后,黄颡鱼仔鱼脑组织中AChE酶活性显著下降,ache基因的mRNA表达水平也下调,表明SDBS暴露可能抑制了黄颡鱼仔鱼AChE酶的合成和表达,妨碍了胆碱能神经递质系统的正常运作。吴光洁[19]研究发现,鲤(Cyprinuscarpio)脑AChE酶活性随着十二烷基苯磺酸异丙胺盐暴露浓度的升高而降低。金叶飞[21]研究发现,在亚急性浓度的十二烷基苯磺酸钠暴露14 d,随着暴露浓度的增加,鲫(Carassiusauratus)鱼脑组织的AChE酶活性被显著抑制(P<0.05)。张江慧[22]研究发现,质量浓度分别为0.5、1、2、4和8 mg·L-1的水体十二烷基苯磺酸异丙胺盐暴露对异育银鲫(Carassiusauratusgibelio)脑AChE酶活性产生波动影响。 GUIHERMINO等[22]对十二烷基苯磺酸钠、十二烷基硫酸钠等表面活性剂的研究中发现,无论是体内试验还是体外试验,这些表面活性剂均会明显抑制AChE酶活性。表面活性剂抑制AChE酶活性的原因可能是它改变了蛋白质表面的电荷,从而改变了酶在溶液中的性质,使得酶活性下降[22]。体外试验观测到表面活性剂影响AChE酶活性的最低质量浓度分别为12.5~100 mg·L-1,而体内试验的最低质量浓度分别为2~11.9 mg·L-1,这些数值与受污染的地表水中表面活性剂的质量浓度(0.5~10 mg·L-1)基本相当[23-25]。
课题组还测定了黄颡鱼脑组织中5-HT含量和5-ht基因的mRNA转录水平来进一步研究SDBS诱导神经毒性分子的机制。其中,暴露后仔鱼脑组织中5-HT含量显著下降,相关基因的mRNA转录水平也下调。大量研究证实,5-HT是脊椎动物调剂运动输出的重要神经递质[26-27]。进一步研究表明,5-HT还可以与多巴胺、γ-氨基丁酸和谷氨酸等其他神经递质系统相互作用,共同调节学习和记忆能力、高水平的认知能力以及恢复认知功能等[26-27]。该研究中5-ht基因的转录水平下调提示,亚急性SDBS的暴露可能通过干扰5-ht基因的转录水平影响黄颡鱼的神经系统。
3.3 SDBS暴露胚胎发育毒性与仔鱼神经毒性之间的联系
SDBS暴露处理后黄颡鱼胚胎孵化畸形率和死亡率均显著提高。造成胚胎发育毒性的原因可能有3个方面:一是SDBS与细胞膜表面疏水部分结合,破坏了胚胎细胞膜结构[15];二是SDBS暴露形成泡沫,导致水体溶解氧浓度下降,对胚胎发育造成影响;三是SDBS能通过抑制机体的抗氧化作用从而造成细胞遗传物质的损伤,影响DNA转录与表达等[16]。鱼类的胚胎畸形多发生于神经胚期,此时神经管的正常发育和分化是器官发生的基础,胚胎处于神经胚时期对外界刺激最为敏感[28-30]。推测SDBS暴露处理对胚胎神经管发育产生影响,造成其不能正常分化为脑和脊髓,后期会形成仔鱼的头部畸形和脊椎畸形;在孵化Ⅰ期的畸形胚胎表现为弓背或弯尾、卵黄囊膨大等现象,各种畸形胚胎在发育进程中逐步死亡。实验发现暴露处理后黄颡鱼胚胎存在着心包水肿(心脏异常)、卵黄水肿、身体卷曲、脊椎弯曲、头部畸形等现象,这些畸形可能和神经管发育分化成器官时遭受到SDBS暴露引起的胚胎神经毒性有关。
4 结论
综上所述,SDBS暴露显著提高了黄颡鱼胚胎孵化的死亡率和畸形率,SDBS通过抑制AChE酶活性和5-HT含量影响神经传导,抑制神经递质相关基因表达,从而对黄颡鱼产生胚胎发育毒性及神经毒性作用。
