盐胁迫下Spd对非洲凤仙生理指标及总黄酮含量的影响
2024-05-07何会流
何 会 流
(重庆城市管理职业学院, 重庆 401331)
土壤盐渍化是一个全球性问题,严重影响植物生长[1].盐害会引起植株代谢紊乱、光合作用减弱,影响其经济与观赏价值[2].通过喷施外源物质以提升植物耐盐性,是园林植物应用中比较常见的一种方式.非洲凤仙(ImpatienswalleranaHook. f.)为凤仙花科(Balsaminaceae)多年生肉质草本植物.其花期长,耐阴性强,可作花坛、花境、花丛和花群等植物设计素材,还可室内盆栽.因此,研究非洲凤仙次生盐代谢影响,以及利用外源物质增强其抗盐性意义重大.
多胺(PAs)是一类低分子含氮碱.在逆境胁迫下,植物体内不同类型的PAs,如腐胺(Put)、亚精胺(Spd)和精胺(Spm)的含量会发生变化,外源PAs会对植物的抗逆性产生不同的影响[3].其中,Spd由于其多价阳离子特性,可直接作为胁迫保护物质,还可作信号分子,与植物抗逆境胁迫关系密切[4].研究表明,外施适宜浓度Spd能有效缓解植物高温胁迫、低温胁迫、干旱胁迫、水分胁迫、盐胁迫等[5-9]的影响.非洲凤仙逆境研究较少,目前有Na2CO3胁迫[10]、重金属胁迫[11]以及盐胁迫对其实生苗细胞膜透性和丙二醛含量的影响[12]等研究.但外源亚精胺(Spd)对花期非洲凤仙在盐胁迫作用下的影响鲜见报道.本试验以花期非洲凤仙为材料,采用室内模拟盐胁迫环境,通过向非洲凤仙叶片喷施不同浓度Spd处理,研究盐胁迫下外源Spd对非洲凤仙渗透调节物质、保护酶系统以及次生代谢产物总黄酮的影响,旨在为非洲凤仙栽培生产以及提高其药用成分提供一定的理论依据.
1 材料与方法
1.1 材料
供试材料为花期非洲凤仙(ImpatienswalleranaHook. f.),由重庆市大土公司花卉基地提供.经预实验筛选确定100 mmol/L NaCl为最佳处理浓度.用长势相当的非洲凤仙花期苗(花盆12 cm×12 cm),设置6个处理组.①CK (蒸馏水);②T0 NaCl(100 mmol/L NaCl);③T1 NaCl(100 mmol/L)+Spd(0.2mmol/L);④T2 NaCl(100 mmol/L)+Spd(0.4 mmol/L);⑤T3 NaCl(100 mmol/L)+Spd(0.6mmol/L);⑥T4 NaCl(100 mmol/L)+Spd(0.8 mmol/L).每组20盆.每4 d浇灌一次稀释10倍的MS营养液,NaCl溶到营养液里浇灌土壤.处理时长12 d.在处理期5、9、13 d上午9∶00采非洲凤仙叶片(0.1 g×12份/盆)待测.
1.2 方法
1.2.1 可溶性糖、可溶性蛋白含量的测定
可溶性糖含量测定参照张志良等[13]采用蒽酮比色法.可溶性蛋白含量测定采用考马斯亮蓝法[14].
1.2.2 抗氧化酶、脯氨酸含量、丙二醛的测定
采用氮蓝四唑(NBT)光还原法测定超氧化物歧化酶(SOD)活性[15];采用愈创木酚法测定过氧化物酶(POD)活性[13];采用上海优选提供的测试盒测定过氧化氢酶(CAT)活性;采用酸性水合茚三酮显示法测定脯氨酸(Pro)含量[14];采用硫代巴比妥酸法测定丙二醛(MDA)含量[16].
1.2.3 总黄酮含量的测定
总黄酮含量测定参照李晓明等[17]的方法.
1.2.4 数据处理
利用Excel 2007完成数据整理,SPSS 22.0新复级差法进行数据统计分析(P<0.05).Origin Pro 8.0作图.
2 结果与分析
2.1 盐胁迫下Spd对非洲凤仙可溶性糖、可溶性蛋白含量的影响
由表1可知,与CK组相比,在100 mmol/L NaCl胁迫条件下,T0组可溶性糖含量仅在第4 d时升高,较CK组上升了20.638%,在8、12 d时则显著降低了18.415%、48.029%.外源Spd喷施后,随其浓度增加,可溶性糖含量先升后降.T3组可溶性糖含量较T0,4、8、12 d分别显著提升了53.742%、81.332%、73.473%,缓解效果较好.以上结果表明,短期(4 d)盐胁迫时,可溶性糖含量提高,长期(8、12 d)则抑制下降.喷施Spd后,可有效提高非洲凤仙可溶性糖含量,缓解盐胁迫伤害,浓度0.6 mmol/L为最适.
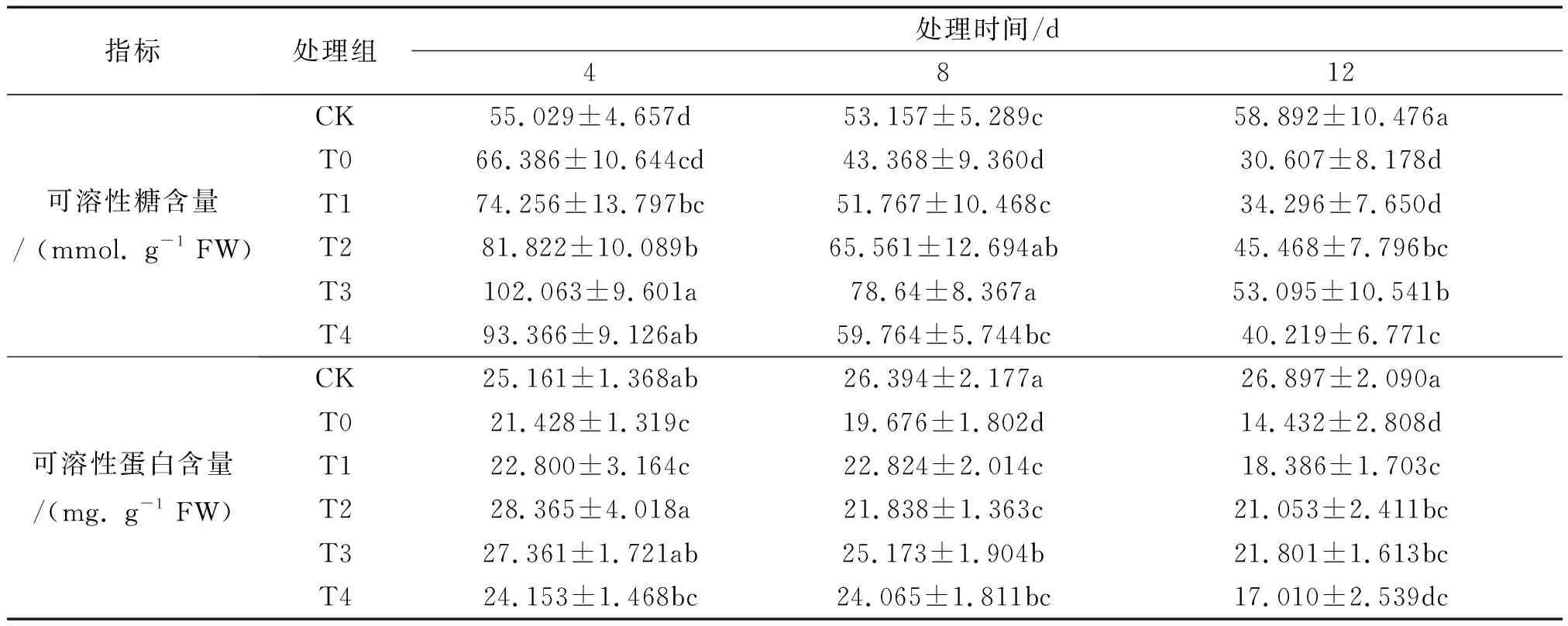
表1 不同浓度外源Spd对盐胁迫下非洲凤仙叶片中可溶性糖和可溶性蛋白含量的影响
可溶性蛋白含量在盐胁迫下,T0组较CK下降均显著,4、8、12 d时下降了14.836%、25.453%、46.343%,降幅与胁迫时长正相关.喷施Spd后,非洲凤仙可溶性蛋白含量随外源Spd浓度升高而先升后降,均有不同程度的回升.4 d时,T2 和T3组可溶性蛋白含量均显著高于T0组,分别是T0组的1.324、1.277倍,两组间差异不显著;8、12 d时,T3组(0.6 mmol/L)是T0组的1.279、1.511倍,差异显著.以上结果表明,盐胁迫造成非洲凤仙叶片中可溶性蛋白含量的显著下降,通过喷施Spd后,可以有效提高非洲凤仙叶片中的可溶性蛋白含量,缓解盐胁迫的抑制作用,且最适Spd浓度为0.6 mmol/L.具体结果如表1所示.
注:不同字母表示浓度不同溶液Spd处理间差异显著(P<0.05);CK、T0—T4分别代表空白对照组、不同浓度Spd溶液处理组.下同.
2.2 盐胁迫下Spd对非洲凤仙Pro、MDA含量的影响
如表2所示,盐胁迫下非洲凤仙叶片内Pro含量与CK组相比,4、8、12 d分别升高了11.358%、10.343%、2.304%,随时长呈下降趋势.通过施加不同浓度的外源Spd后,与T0组相比,Pro出现上升趋势,其中以T3处理组最为明显,其含量分别提高了22.717%、30.587%、38.864%.以上结果表明,花期非洲凤仙Pro含量在盐胁迫下升高以抵抗胁迫伤害,但自身调节能力不足;外源Spd可有效缓解NaCl引起的渗透胁迫,且最适浓度为0.6 mmol/L.

表2 不同浓度外源Spd对盐胁迫下非洲凤仙叶片中脯氨酸、MDA含量的影响
盐胁迫下,4、8、12 d非洲凤仙T0组MDA含量较CK升高幅度大,分别是CK的1.586、1.484、1.242倍,随盐害时长呈上升趋势.经Spd处理后,各时段MDA含量较T0组总体呈现先降后升走向.T3较T0组4、8、12 d分别降低了11.031%、18.131%、16.062%.这表明外源Spd可有效缓解盐胁迫对非洲凤仙膜系统的损害程度(见表2).
2.3 盐胁迫下Spd对非洲凤仙叶片SOD、POD和CAT活性的影响
T0组较CK,花期非洲凤仙叶片中SOD和POD活性均呈先升后降的走向.12 d时,T0组的SOD活性下降程度最大,较CK降低了30.937%,而POD活性下降了21.158%.经Spd处理后,4、8、12 d非洲凤仙SOD、POD活性较T0均有不同升幅.12 d时T3较T0组SOD、POD分别提高了67.918%、64.617%,表现最显著.CAT活性T0组较CK各时段分别显著降低了19.728%、22.973%、23.129%.通过喷施不同浓度的外源Spd后,CAT活性呈现一个明显的上升趋势,且T3处理组效果最为明显,相比T0组,4、8、12 d分别提高了19.492%、26.316%、26.549%.该结果说明三种抗氧化酶对盐胁迫的反应不同,但喷施不同浓度的外源Spd都可以不同程度地提高三者的活性,可以有效缓解盐胁迫对凤仙的伤害,增强其清除活性氧(ROS)的防御能力,且该试验中,Spd最佳浓度0.6 mmol/L(见表3).
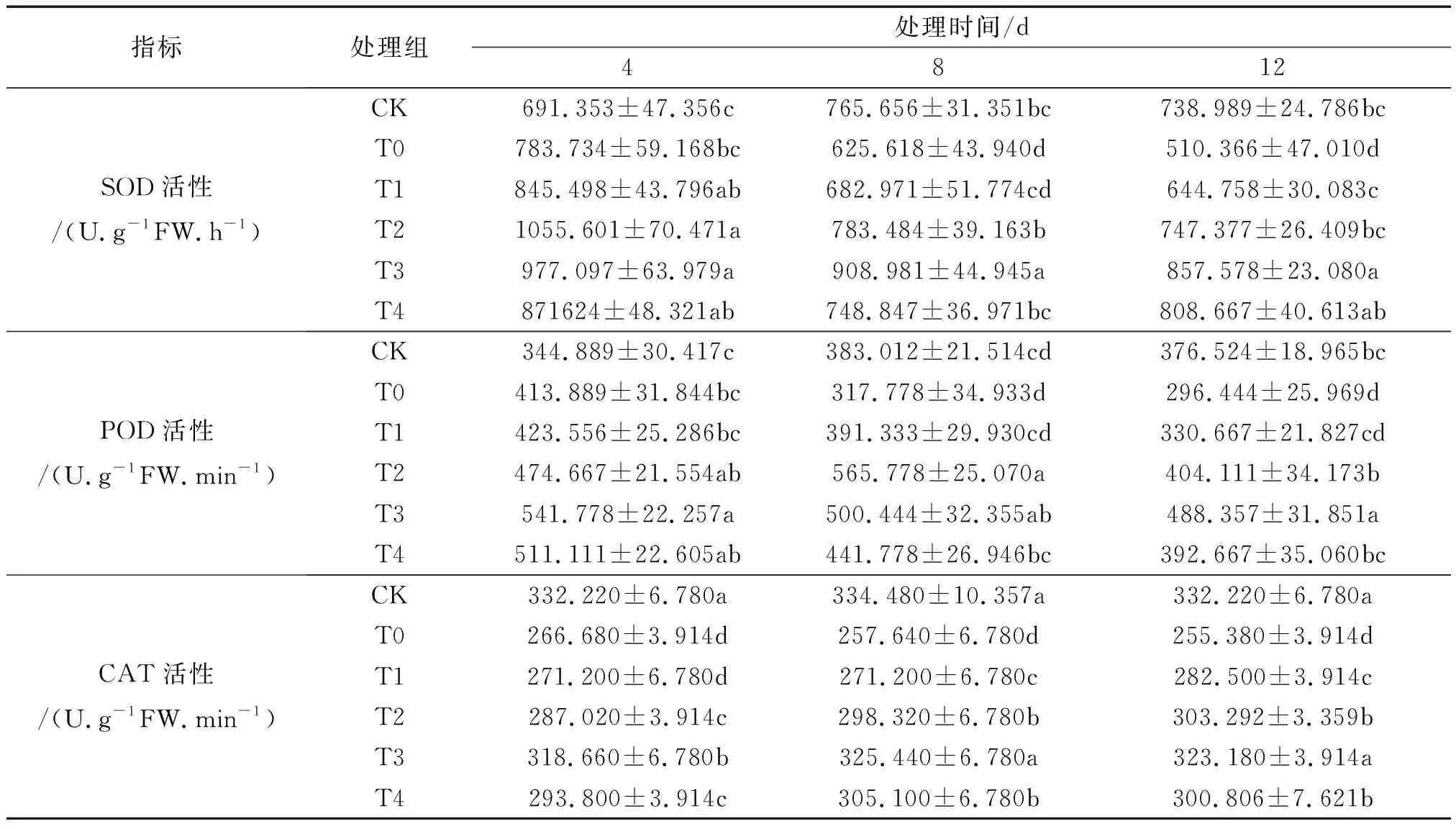
表3 外源spd对盐胁迫下非洲凤仙叶片中SOD、POD和CAT活性的影响
2.4 盐胁迫下Spd对非洲凤仙总黄酮含量影响
盐胁迫下,花期非洲凤仙叶片4、8、12 d总黄酮含量较CK降低了15.821%、26.431%、25.685%,降低显著.通过喷施不同浓度的外源Spd后,随着处理时间的递增,总黄酮含量呈现略降趋势,并且可以看出T3处理组效果最明显,相对于T0组,处理的4、8、12 d分别提高了54.308%、53.547%、52.189%.此外,T3组非洲凤仙叶片内总黄酮含量分别是CK对照组含量的1.223倍、1.130倍、1.131倍.以上结果说明,通过喷施不同浓度的外源Spd可以有效提高盐胁迫下非洲凤仙叶片内总黄酮含量,且最适浓度为0.6 mmol/L(见图1).

图1 盐胁迫下外源Spd对非洲凤仙叶片总黄酮含量的影响
3 讨论与结论
3.1 盐胁迫下Spd对非洲凤仙可溶性糖、可溶性蛋白含量、Pro的影响
盐胁迫会引起渗透胁迫、离子毒害和次级胁迫,极大危害到植物的生存[18].植物可用渗透调节方式来适应盐胁迫,通过积累可溶性糖、Pro、无机离子等来调节细胞内的渗透势,维持水分平衡,保护酶活性[19].本试验中,100 mmol/L盐胁迫下非洲凤仙叶片的可溶性糖短期(4 d)显著升高,而Pro则在整个处理时段内持续积累,显示系列盐胁迫适应性行为.Pro既可作为渗透调节物质,还能增强植物盐胁迫的信号调控机制[18].盐胁迫下,花期非洲凤仙可溶性蛋白下降显著,表明对渗透调节没有正向作用.卢克欢等[20]盐处理颠茄叶片也有类似结果.研究表明,Spd增强了植物在胁迫条件下碳水化合物代谢,增强了葡萄糖、果糖及蔗糖合成酶的活性[21].在信号转导过程中,Spd诱导了逆境蛋白相关基因的表达,促进了蛋白质的合成,在蛋白质翻译后,Spd还可与细胞内原有蛋白质发生共价交联,稳定蛋白质结构,减缓蛋白质降解[22].此外,Spd通过激活谷氨酸途径中Pro合成的限速酶和关键酶活性,促进了Pro的积累,同时也提高了分解代谢关键酶ProDH的活性,加速了Pro的转化和利用[8].本试验中,100 mmol/L盐胁迫下,花期非洲凤仙经Spd处理后,其可溶性糖、Pro和可溶性蛋白含量均增幅显著.这与赵东晓等[9]研究结果一致.表明外源Spd可以明显缓解盐胁迫对花期非洲凤仙的抑制.
3.2 盐胁迫下Spd对非洲凤仙MDA含量和抗氧化酶活性的影响
盐胁迫可引起植物体内ROS产生,导致膜脂过氧化,产生过多MDA.膜受伤害的程度越严重,MDA含量越高[23].本试验中,花期非洲凤仙叶片在100 mmol/L盐胁迫下,MDA含量较CK显著升高,且随盐害时长呈上升趋势,表明膜已经明显伤害.与刘泽静等[12]报道的150 mmol/L内是非洲凤仙种植的耐盐范围并不相同,说明植物花期盐敏感性增强.Spd处理后,MDA含量显著下降,这与李娜等[24]研究结果一致.表明外源Spd有利于花期非洲凤仙叶片细胞膜的稳定与完整性.
抗氧化酶可清除植物细胞ROS、抵御膜脂过氧化.盐胁迫下,ROS产生与清除动态平衡失稳,MDA含量增加.4 d时,花期非洲凤仙SOD、POD活性明显升高.这与盐胁迫处理紫苏[25]的结果类似.长期(8、12 d)非洲凤仙SOD、POD和CAT活性均下降,与前述花期盐敏感增强的结果一致.研究表明,Spd可以结合到抗氧化酶分子上,改变酶的构象,使单位酶活性升高[26].此外,逆境胁迫下Spd可与植株体内产生的O-2、OH-等阴离子结合,有助于清除过量ROS[27].本研究中,外施Spd (0.6 mmol/L)后,抗氧化酶活性提升明显.这与海霞等[28]研究结果一致.表明Spd具有减轻盐胁迫对植物叶片造成的氧化伤害.
3.3 盐胁迫下Spd对非洲凤仙总黄酮含量影响
研究表明,一定盐胁迫下,黄芩、黄蜀葵、三倍体丹参等[29-31]总黄酮含量会提升,而高盐处理则相反.本研究中,非洲凤仙总黄酮含量在100 mmol/L盐胁迫后下降显著.这和宁亚茹等[30]研究结果一致,表明花期非洲凤仙对盐影响更敏感.可能与盐胁迫诱导总黄酮合成中间产物,并参与合成花青素等色素有关[32].外源Spd(0.6 mmol/L)处理后,总黄酮含量显著增加,表明非洲凤仙抗氧化活性增强,抗盐性提高.这与张春平等[25]研究紫苏结果相似.说明外源Spd对提升盐胁迫下非洲凤仙总黄酮含量有重要作用.
综上,外施Spd(0.6 mmol/L)处理100 mmol/L盐胁迫下花期非洲凤仙,其可溶性糖、可溶性蛋白、Pro以及总黄酮含量显著增加;抗氧化酶活性明显提升;MDA含量降低.因此,外源Spd可以缓解盐胁迫对非洲凤仙的伤害,提升次生代谢产物总黄酮含量,增强了非洲凤仙抗盐性,为非洲凤仙栽培和药用成分增加,提供了一定的理论依据.
