17β-HSD14基因在魁蚶性腺发育过程中的表达特征
2024-05-07王文静刘志鸿孙秀俊周丽青徐万栋
王文静,吴 彪,刘志鸿,孙秀俊,周丽青,徐万栋
(1.上海海洋大学水产科学国家级实验教学示范中心,上海 201306;2.农业农村部海洋渔业可持续发展重点实验室,中国水产科学研究院黄海水产研究所,山东青岛 266071;3.山东省东营市垦利区行政审批服务局,山东垦利 257500)
水生动物性腺发育受内因和外因共同调控,其中内因是相关的遗传物质,而外因则包括温度、盐度、pH、光照周期等环境因子[1]。近年来,对脊椎动物体内性类固醇激素合成相关基因的研究报道较多,而在贝类中研究较少[2]。性类固醇激素是性别决定、分化和性腺发育的关键物质,能够诱导水生动物性逆转[3,4],也可以影响性腺发育[5]。起初,许多学者认为性类固醇激素只存在于脊椎动物中,然而越来越多的证据表明性类固醇激素也存在于无脊椎动物体内[6,7]。性类固醇激素在虾夷扇贝(Mizuhopectenyessoensis)、栉孔扇贝(Chlamysfarreri)、海湾扇贝(Argopectenirradians)、长牡蛎(Crassostreagigas)和近江牡蛎(C.ariakensis)性腺中的测定均已有报道,结果表明贝类性腺中性类固醇激素的含量随生殖周期的变化产生季节性变化[8-12]。性类固醇激素的合成以胆固醇作为前体,由一系列类固醇合成酶催化调控,主要包括细胞色素P450基因家族(Cytochrome P450s,CYP)和羟类固醇脱氧酶家族(Hydroxysteroid dehydrogenases,HSD)的成员,以及其他类固醇氧化还原酶[13]。在脊椎动物中,类固醇合成酶及其通路都已经有较为深入的研究,胆固醇在类固醇激素合成急性调节蛋白StAR(steroidogenic acute regulatory protein)的作用下从细胞质转运至线粒体内膜上,然后由细胞色素侧链裂解酶CYP11催化产生孕烯醇酮,孕烯醇酮回到细胞质后,再由CYP17、CYP19、3β-HSD和17β-HSD等基因编码的类固醇合成酶催化形成相应的性类固醇激素[14]。已有研究表明,软体动物的主要种类,如头足类、腹足类和双壳类等,能够利用胆固醇或孕烯醇酮等前体物质合成性类固醇激素[15]。但在贝类中性类固醇激素合成机制的研究相对较为匮乏,其中性类固醇激素合成通路中的关键基因也有待进一步研究。
17β-羟类固醇脱氢酶(17β-hydroxysteroid dehydrogenase,17β-HSD)是一类以NAD(P)(H)作为辅酶的氧化还原酶,是性类固醇激素合成过程中的催化酶,因其作用于类固醇的第17位碳而得名[16]。目前在哺乳动物中,已发现该家族的15种亚型,并根据发现顺序依次命名[17]。17β-HSD能够氧化17β-羟基类固醇,或还原17-酮类固醇,从而实现性类固醇激素活性的调节,如催化雄烯二醇和睾酮、雌二醇和雌酮、双氢睾酮和3α-雄烷二醇等之间的相互转化,对于维持生物体内性类固醇激素的合成与代谢发挥重要作用[18]。在水产动物中,许多17β-HSD基因已被发现,在牙鲆(Paralichthysolivaceus)中筛选克隆了10个17β-HSD基因,其中3个基因(17β-HSD10、17β-HSD12a和17β-HSD12b)在卵巢中表达量较高,1个基因(17β-HSD9)在精巢中表达量较高,说明牙鲆17β-HSD基因家族可能与性腺发育过程中雌雄激素的合成有关[19]。栉孔扇贝中已发现了17β-HSD4、17β-HSD8和17β-HSD14,这3个17β-HSD基因在性腺中的表达量都具有性别二态性,可能参与了性腺的发育与成熟、雌二醇的含量调节等过程[20]。三角帆蚌(Hyriopsiscumingii)中17β-HSD11基因在性腺中的表达量具有性别二态性,注射雌二醇干扰后,17β-HSD11基因在精卵巢中的表达量降低[21]。17β-HSD14基因作为17β-HSD基因家族成员,可能参与性腺发育和雌二醇含量调节,是性类固醇激素合成通路中的基因之一。
魁蚶(Scapharcabroughtonii)是我国黄渤海区重要的大型底栖贝类,也是我国北方重要的经济养殖物种[22]。魁蚶性腺被斧足覆盖,不解剖情况下肉眼不可见,给准确判断性腺发育状态带来困难,这是人工育苗工作中的一个难题。掌握魁蚶性腺发育与性类固醇激素相关基因的相关性,能够为顺利开展人工亲贝选择和苗种繁育提供支撑。本研究筛选并验证了魁蚶17β-HSD14基因序列,进行了生物信息学分析,并利用原位杂交、荧光定量PCR技术检测了该基因在魁蚶性腺中的时空表达规律,为了解17β-HSD14在魁蚶性腺发育中的作用提供了参考。
1 材料与方法
1.1 实验材料
实验用魁蚶采自山东省青岛海域野生群体,选取壳长为70 mm左右的健康个体运回实验室置于过滤海水中暂养1周,每天投喂小球藻2次、换水1次,每次换水量50%,水温18 ℃左右,盐度30,海水pH 8.0。魁蚶性腺组织取样后,通过组织学方法将魁蚶性腺发育阶段划分为5个时期,即形成期(Ⅰ期)、增殖期(Ⅱ期)、成熟期(Ⅲ期)、排放期(Ⅳ期)和耗尽期(Ⅴ期)。同时取成熟期精巢、卵巢、鳃、斧足、外套膜、闭壳肌和肝胰腺7种组织,置于原位杂交固定液(Servicebio,中国)中固定24 h,用于原位杂交实验。
1.2 RNA提取与反转录
在魁蚶性腺发育的5个时期中,各选3个精巢和卵巢样品进行RNA提取,RNA的提取采用Trizol法,提取的RNA采用1%的琼脂糖凝胶电泳检测完整性和Nanodrop 2000(Thermo Scientific,美国)检测纯度和浓度,并且OD260 nm/ OD280 nm的比值范围应在1.8~2.2,将鉴定合格的样品稀释到1 000 ng/μL。使用Evo M-MLV Plus cDNA合成试剂盒(Accurate,中国)将魁蚶RNA逆转录为cDNA,保存于-20 ℃备用。
1.3 核心片段验证
从实验室前期转录组测序结果中获得魁蚶转录组文库中17β-HSD14基因cDNA片段,使用Primer 3.0(http://www.primer3plus.com/cgi-bin/dev/primer3plus.cgi)设计特异性引物进行片段验证,引物见表1。采用2×Tap Plus Master Mix Ⅱ(Dye Plus)(Vazyme,中国)扩增目的基因,1%琼脂糖凝胶电泳检测PCR产物后,使用TaKaRa MiniBEST Agarose Gel DNA Extraction(TaKaRa,中国)试剂盒进行切胶回收。使用5 min TA/Blunt-Zero Cloning试剂盒(Vazyme,中国)将纯化后的目的片段连接到载体上,转化至DH5α化学感受态细胞(Vazyme,中国)中,在含Amp的LB平板上过夜培养后挑选阳性菌落送北京擎科生物科技有限公司测序。

表1 实验所用引物序列
1.4 基因序列及进化分析
对测序得到的17β-HSD14基因序列进行分析,使用ORF Finder(https://www.ncbi.nlm.nih.gov/orffinder/orffinder/)进行开放阅读框(Open Reading Frame,ORF)区预测,SignaIP-5.0 Server(https://services.healthtech.dtu.dk/service.php?SignalP-5.0)预测信号肽,TMHMM 2.0(https://services.healthtech.dtu.dk/services/TMHMM-2.0/)预测蛋白质的跨膜结构域,SMART(http://smart.emblhe idelberg.de/ smart/set_mode.cgi?NORMAL=1)预测基因结构和功能域。利用ExPASY(https://web.expasy.org/protparam/)在线网站预测蛋白理化性质,Swiss-model(https://www.swissmodel.expasy.org/)网站进行蛋白质三级结构预测,Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)网站预测亚细胞定位,使用BLAST进行碱基序列同源性比对分析和相似蛋白质序列搜索,使用DNAMAN软件进行氨基酸多序列比对,用MEGA 11.0软件以邻接法(Neighbor-Joining,NJ)构建系统进化树。
1.5 原位杂交
利用原位杂交分析17β-HSD14基因在魁蚶精巢(Ⅲ期)、卵巢(Ⅲ期)、鳃、斧足、外套膜、闭壳肌和肝胰腺中的定位。原位杂交探针由赛维尔公司设计,探针序列见表1。主要步骤如下:固定的组织经梯度酒精脱水、浸蜡、包埋、切片、捞片和烤片,依次将切片放入二甲苯15 min、二甲苯15 min、无水乙醇5 min、无水乙醇5 min,之后风干,DEPC水浸泡。组织切片于修复液中煮沸5 min,自然冷却。根据不同组织不同指标特性,滴加蛋白酶K于37 ℃消化15 min。先用纯水冲洗,后用PBS洗3次。滴加预杂交液,37 ℃孵育1 h。倒出预杂交液,滴加含探针杂交液,浓度500 nmol/L,恒温箱42 ℃杂交过夜。洗去杂交液后,滴加含二标探针杂交液,稀释比1∶400于42 ℃孵育3 h。滴加封闭血清正常兔血清,置于室温30 min。倒去封闭液,滴加鼠抗地高辛标记碱性磷酸酶anti-DIG-AP,37 ℃孵育50 min,后PBS洗4次。滴加NBT显色液,用显微镜观察阳性显色情况。后用纯水冲洗,自然风干后,中性树胶封片,得到的原位杂交的切片置于CIC显微镜(XSP-C204)下,进行图像的采集与分析。
1.6 魁蚶性腺不同时期的表达分析
根据测序得到的编码序列(Coding sequence,CDS)区序列设计17β-HSD14定量引物,qRT-PCR使用的引物见表1,以RL15基因[23]作为内参基因。使用HiScript©Ⅲ RT SuperMix for qPCR试剂盒(Vazyme,中国)将RNA反转录为cDNA,然后使用ChamQ SYBR Color qPCR Master Mix试剂盒(Vazyme,中国)在CFX 96(Bio-rad,美国)上进行qRT-PCR反应,反应体系为:2×ChamQ SYBR Color qPCR Master Mix 10 μL,正反向引物各0.4 μL,cDNA模板1 μL,RNase Free H2O 8.2 μL。反应条件为:95 ℃预变性3 min,95 ℃ 10 s,60 ℃ 30 s,40个循环。每个qRT-PCR实验进行3个重复,采用2-ΔΔCt法计算17β-HSD14基因的相对表达量,所有数据均在SPSS 22.0中采用单因素方差分析,定量数据以平均值±标准差(SD)表示,并将其进行统计学分析的显著性水平设为P<0.05。
2 结果
2.1 17β-HSD14基因序列及生物信息学分析
克隆获得的17β-HSD14基因CDS序列长度为822 bp,编码273个氨基酸。17β-HSD14蛋白无信号肽,不存在跨膜区域,推测其为一个胞内蛋白。17β-HSD14基因蛋白质的分子质量为29.66 kDa,理论等电点为6.89,分子式为C1 306H2 065N361O403S12,脂溶系数为79.30,平均亲水系数(GRAVY)为-0.331,不稳定系数为30.07<40.00,说明17β-HSD14基因编码产物为亲水性稳定蛋白。17β-HSD14在第2~262氨基酸序列中存在NADB结构域,且存在NAD(P)结合位点(TGXXXGXG)和催化活性位点(YXXXK)(图1)。亚细胞定位显示,17β-HSD14蛋白存在于细胞质和过氧化物酶体中。利用Swiss-model在线网站预测了三维结构,17β-HSD14蛋白序列与同源模板的相似性为51.54%,QMEAN为0.81,GMQE为0.82,结果说明该蛋白与模板蛋白的匹配度较高,该蛋白含有46.86% α-螺旋,14.65% β-折叠和38.45%无规则卷曲(图2)。

图1 17β-HSD14氨基酸的多序列比对Fig.1 Multiple comparisons of 17β-HSD14 amino acid红色方框内为NAD(P)结合位点,蓝色方框内为催化活性位点。
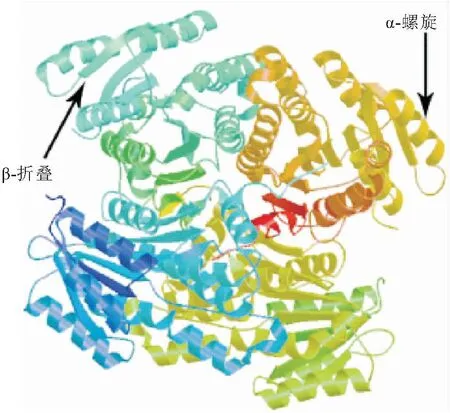
图2 17β-HSD14蛋白质三级结构预测Fig.2 Prediction of tertiary structure of 17β-HSD14 protein
氨基酸序列比对发现,魁蚶的17β-HSD14与欧洲牡蛎(Ostreaedulis)的同源性最高,为77.82%;与长牡蛎、美洲牡蛎(C.virginica)、福建牡蛎(C.angulata)、加州贻贝(Mytiluscalifornianus)、厚壳贻贝(M.coruscus)、蓝贻贝(M.edulis)、栉孔扇贝、虾夷扇贝和欧洲扇贝(Pectenmaximus)的同源性相近,都在75.85%~77.44%的范围内;与硬壳蛤(Mercenariamercenaria)的同源性比较低,为69.49%(表2)(图1)。与斑马鱼(Daniorerio)等鱼类和非洲爪蟾(Xenopustropicalis)等两栖动物的同源性较低,为57.93%~66.02%;与智人(Homosapiens)等哺乳动物的同源性最低,为50.78%~51.94%。系统进化树如图3所示,魁蚶17β-HSD14先与贻贝、牡蛎、扇贝和蛤等双壳贝类聚为一支,然后再与鱼类和两栖动物聚在一起,进化关系最远的是智人等哺乳动物。

图3 不同物种17β-HSD14氨基酸序列系统进化树Fig.3 Phylogenetic tree of 17β-HSD14 amino acid sequence in different species

表2 不同物种17β-HSD14氨基酸序列号与同源性Tab.2 17β-HSD14 amino acids sequences numbers and identity of different species
2.2 17β-HSD14基因mRNA在魁蚶7种组织中的细胞学定位
性腺原位杂交结果如图4所示,在卵巢组织中,17β-HSD14基因阳性杂交信号主要位于卵细胞和滤泡细胞壁上;在卵细胞中,阳性杂交信号主要出现在细胞质中,与亚细胞定位预测结果质一致。精巢组织中的精原细胞和精子中也都检测到了17β-HSD14基因的阳性杂交信号。17β-HSD14基因在其他组织的定位结果如图5所示,魁蚶斧足、外套膜、肝胰腺、闭壳肌和鳃的细胞质中均检测到了该基因的阳性杂交信号。与阴性对照组相比,斧足组织中的阳性杂交信号主要位于外表皮、肌纤维和结缔组织中(图5 A1、A2);外套膜上肌纤维中的阳性杂交信号较为明显,而上皮层和结缔组织中的阳性杂交信号则较弱(图5 B1、B2);在肝胰腺组织中,肝小管上的阳性杂交信号较为强烈(图5 C1、C2);闭壳肌中的阳性杂交信号主要位于其肌纤维中(图5 D1、D2);鳃组织中,在鳃丝表面上检测到了17β-HSD14的阳性杂交信号(图5 E1、E2)。
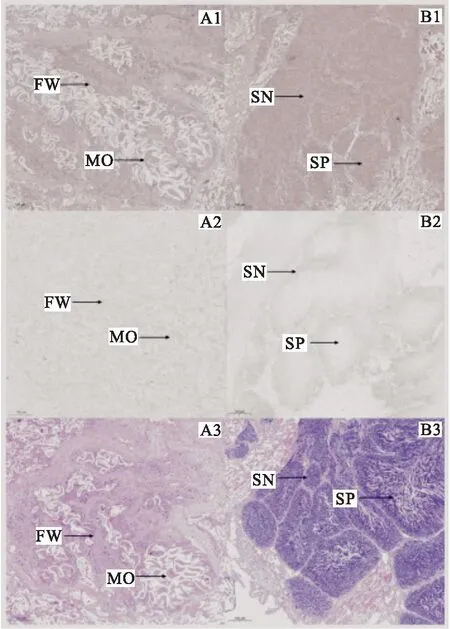
图4 17β-HSD14在魁蚶性腺中的细胞学定位Fig.4 Cytological localization of 17β-HSD14 in gonad of S.broughtoniiA:卵巢;B:精巢;1:原位杂交结果图;2:阴性对照图;3:HE染色图;MO:成熟卵子;FW:滤泡壁;SN:精原细胞;SP:精子;比例尺:100 μm。

图5 17β-HSD14在魁蚶斧足、外套膜、肝胰腺、闭壳肌和鳃中的细胞学定位Fig.5 Cytological localization of17β-HSD14 in foot,mantle,hepatopancreas,muscle and gill of S.broughtoniiA:斧足;B:外套膜;C:肝胰腺;D:闭壳肌 E:鳃;1:原位杂交结果图;2:阴性对照图;3:HE染色图;OE:外表皮;Mf:肌纤维;Ct:结缔组织;Ep:上皮层;Ht:肝小管;Gf:鳃丝;比例尺:100 μm。
2.3 17β-HSD14基因在不同发育时期的性腺中的表达分析
荧光定量检测结果表明,17β-HSD14基因在5个发育时期的精卵巢组织中均有表达(图6)。其中,Ⅱ期卵巢中17β-HSD14的表达量最高,显著高于Ⅰ期,且极显著高于其他3个时期,Ⅰ期和Ⅲ期的17β-HSD14表达量显著高于Ⅳ期,极显著高于Ⅴ期;Ⅱ期精巢中17β-HSD14的表达量也最高,显著高于Ⅰ期和Ⅴ期。17β-HSD14的表达量从Ⅰ期到Ⅱ期的精卵巢发育过程中均呈上升趋势,在Ⅱ期达到最高值,然后从Ⅱ期到Ⅴ期的发育过程中呈下降趋势,并在Ⅴ期达到最低值。比较17β-HSD14在同一发育时期精巢和卵巢的表达差异发现,5个时期卵巢中17β-HSD14的表达量均高于精巢,且Ⅰ期和Ⅱ期差异达到极显著水平,Ⅲ期显著差异,而Ⅳ期和Ⅴ期无显著差异。

图6 17β-HSD14在魁蚶不同发育时期性腺中的相对表达量Fig.6 Relative expression of 17β-HSD14 in gonad during different developmental periods of S.broughtonii*表示同一时期精巢和卵巢间表达量存在显著差异(P< 0.05),**表示同一时期精巢和卵巢间表达量存在极显著差异(P< 0.01)。图中不同的小写字母代表不同时期卵巢的表达量的差异,不同大写字母代表不同时期精巢的表达量的差异。
3 讨论
17β-HSD是性类固醇激素合成过程中的关键催化酶,17β-HSD14是17β-HSDs中一个新成员,最早从人视网膜cDNA文库中分离得到[24],它能催化雌二醇转化为雌酮、5α-雄烷-3α,17β-二醇转化为雄酮[25]。本实验在魁蚶中克隆获得的17β-HSD14基因CDS序列长度为822 bp,编码273个氨基酸。17β-HSD14基因所编码的氨基酸中存在17β-HSD的SDR家族典型结构特征NAD(P)结合位点(TGXXXGXG)和催化活性位点(YXXXK)[26]。魁蚶的17β-HSD14基因与欧洲牡蛎的同源性最高,与贻贝、牡蛎和扇贝较近,且与鱼类、两栖动物和哺乳动物的同源性也较高,说明17β-HSD14在进化过程中相对保守。
17β-HSD14基因的原位杂交发现在魁蚶卵巢、精巢、斧足、外套膜、肝胰腺、闭壳肌和鳃中均检测到了17β-HSD14基因的阳性杂交信号,表明17β-HSD14在魁蚶各个组织中均有表达,表明除参与性类固醇激素合成外17β-HSD14可能还参与机体的其他生理活动。17β-HSDs在其他物种中也存在无组织特异性的现象,如17β-HSD11在三角帆蚌各组织中均有表达[21];17β-HSD基因在福建牡蛎所有组织中表达,且在内脏团中表达量较高,说明其可能参与了牡蛎的脂肪代谢过程[16];牙鲆17β-HSD1在雌性个体的卵巢、鳃、肾、头肾、脾、胃、肠组织和雄性个体的精巢中表达[27];17β-HSD12在人体的肝脏和肾脏等脂质代谢相关器官中高度表达,在脑垂体、肾上腺和睾丸等内分泌相关器官中被检测到,表明17β-HSD12可能参与脂质生物合成和类固醇代谢的调节[28];以上结果表明17β-HSDs在贝类和脊椎动物中都具有广泛的生物学功能。在魁蚶所有组织中,肝胰腺的肝小管上17β-HSD14的阳性杂交信号最强烈,表明17β-HSD14基因除参与性类固醇激素的合成外可能也参与魁蚶的脂肪酸代谢过程。
性类固醇激素广泛存在于贝类中,其含量随不同的生殖阶段而变化,且存在性别二态性,在性别决定和性腺发育中起着重要作用。有研究表明,性类固醇激素可以加快性腺的发育并影响贝类的性别[29]。性类固醇激素在脊椎动物的性别分化、生长发育、生殖代谢等过程中发挥着重要的生理作用,类固醇合成酶及其通路都已经有较为深入的研究,但性类固醇激素参与贝类繁殖过程的分子机制仍不清晰。本研究中,精卵巢中17β-HSD14在Ⅱ期的相对表达量均为最高,在精卵巢发育过程中均呈先上升后下降趋势。17β-HSD14的表达量在魁蚶精卵巢由增殖期到成熟期的过程中迅速降低,说明17β-HSD14基因可能在生殖细胞成熟和排放过程中发挥了重要作用。近江牡蛎性腺中睾酮和雌二醇的含量均在增殖期最高,且性类固醇激素的变化与生殖周期相关,提示睾酮和雌二醇可能参与了性腺发育过程的调节[12]。栉孔扇贝精卵巢中的雌二醇和睾酮含量均随生殖过程周期性地变化,表明性类固醇激素在栉孔扇贝性别维持、性腺分化、配子发生和排放等过程中具有潜在的重要作用[20]。以上结果表明17β-HSD14作为性类固醇激素合成酶,可能通过影响性类固醇激素的合成而影响性腺发育。魁蚶5个时期卵巢中17β-HSD14的表达量均高于精巢,且卵巢中Ⅰ期、Ⅱ期和Ⅲ期表达量显著高于精巢,具有性别二态性。已有研究发现三角帆蚌中17β-HSD11基因在卵巢中的表达量极显著高于精巢[21],与本研究结果相似;海湾扇贝性腺发育过程中,雌二醇和孕酮的表达量在卵巢中均高于精巢,而睾酮在精巢中的表达量均高于卵巢,表现出性别二态性[10]。这提示17β-HSD14可能与雌二醇、孕酮的合成呈正相关关系。在近江牡蛎性腺中,雌二醇、孕酮在卵巢中含量较高,睾酮在精巢中含量较高,且17β-HSD14基因在卵巢中的表达量较高,与雌二醇、孕酮的含量正相关,可能是由于其对雌二醇转化为雌酮的作用比睾酮到雄烯二酮的作用更为有效[12]。魁蚶5个时期卵巢中17β-HSD14的表达量均高于精巢,可能也是由于在卵巢中对雌二醇的调控比在精巢中对睾酮的调控作用更重要。
本研究鉴定了性类固醇合成相关基因17β-HSD14在魁蚶中的组织分布和性腺发育过程中的表达特征,表明17β-HSD14基因可能通过调节性类固醇激素的合成影响性腺发育。研究结果为魁蚶性腺发育相关研究提供了基础资料,为科学管控魁蚶亲贝育肥提供了支撑。
