转基因水稻感染SRBSDV后对植株营养物质的影响
2024-05-07何晓婵周小军朱丽燕朱浩吕仲贤徐红星
何晓婵,周小军,朱丽燕,朱浩,吕仲贤,徐红星*
(1.金华市农业科学研究院,浙江 金华 321000;2.浙江省农业科学院 植物保护与微生物研究所,浙江 杭州 310021)
南方水稻黑条矮缩病(southern rice black-streaked dwarf disease)是2001年在我国广东首次发现的一种新的水稻病毒病,主要由白背飞虱(Sogatellafurcifera(Horvth))传播[1-2]。2009—2011年,该病毒病在我国水稻产区大面积发生,造成水稻减产,甚至绝收[3]。受台风和降雨等影响,该病毒病的介体昆虫白背飞虱会随着降雨和暖湿气流迁飞、定居及蔓延,造成南方黑条矮缩病的流行。明确病毒是否对寄主植物的营养物质等产生影响,是直观解释介体昆虫寄主选择偏好的基础,有助于进一步理解病毒的传播机制,从而为培育抗虫作物品种或制定综合防治策略提供理论基础。
已有研究表明,病毒的侵染会改变寄主植株的形态。如受玉米粗缩病毒(MRDV)侵染的玉米叶肉细胞中叶绿体的数量减少,细胞器发生病变以及液泡膜也明显内陷[4]。水稻感染SRBSDV后植株明显矮缩,分蘖增加,叶片深绿褶皱,后期茎秆上出现瘤状突起[5]。植物病毒能够引起植物营养状况(氨基酸、可溶性糖含量等)的改变,从而影响媒介昆虫的寄主适应性。研究证明,木薯花叶病毒(cassava mosaic virus,CMV)侵染能够显著提高木薯植株韧皮部汁液中氨基酸的含量,有利于媒介昆虫烟粉虱的种群增长[6];Xu等[7]研究发现,感染SRBSDV的水稻植株体内的总氨基酸含量较健康植株提高了31.13%,可溶性糖含量几乎是健康植株的3倍。而西葫芦感染黄瓜花叶病毒(cucumber mosaic virus,CMV)后,韧皮部和叶片的糖分、氨基酸比例均显著下降,从而降低蚜虫的种群适应性[8-9];张泽龙等[10]研究表明,黄瓜被瓜类褪绿黄化病毒(cucurbit chlorotic yellows virus,CCYV)侵染后叶片中防御物质总酚、单宁的含量降低,同时可溶性糖和游离氨基酸等营养物质含量也显著降低。
目前已开展了不少关于病毒感染对寄主植株的影响研究,但关于转基因水稻感染病毒的影响研究鲜有报道。因此,本研究以白背飞虱传播的SRBSDV及转基因水稻(MH63、T1C-19、T2A-1)为研究对象,考察病毒对不同品种转基因水稻株高、可溶性糖、碳氮含量、氨基酸含量等物质的影响,从而为病毒对同一生境的昆虫产生定位寄主趋向和取食趋向的原因提供例证,同时为阐明农田生态系统中的植物病毒传播发生机制提供依据。
1 材料与方法
1.1 材料
水稻品种:Bt水稻品系T1C-19(含cry1C基因)、T2A-1(含cry2A基因)和常规对照水稻品种明恢63(MH63)均由华中农业大学提供。
1.2 方法
1.2.1 SRBSDV病株的获得
将无毒白背飞虱低龄若虫置于垫有湿滤纸的烧杯中,饥饿2 h后转移至SRBSDV病株上进行饲毒2~3 d,后转移至健康水稻苗上饲养以度过循回期,最后把携带SRBSDV的白背飞虱分别接到2叶1心期的T1C-19(含cry1C基因)、T2A-1(含cry2A基因)和常规对照水稻品种明恢63(MH63)上,进行接毒,检测后供试验用。
1.2.2 水稻株高
分别选T1C-19、T2A-1、MH63的正常水稻植株和感SRBSDV病株,每处理随机取15株,从根部起依次测量水稻植株地上部分的自然高度。
1.2.3 可溶性糖含量测定
经温度处理后的水稻叶片烘干,用粉碎机粉碎均匀后待测。称取烘干磨碎的样品0.05 g,置于离心管中,加入1 mL 80%乙醇,85 ℃下保温水浴30 min,然后3 000 r·min-1离心5 min,将上清液倒入大试管中,将残渣反复提取2次,所有上清并入试管,加活性炭吸附色素,之后过滤定容待测。采用蒽酮比色法,取稀释后糖提取液20 μL,加入700 μL蒽酮试剂,立即摇匀,沸水浴中准确加热10 min,迅速冷却至室温,然后放置于暗处10 min后,取200 μL于酶标板中测D630值。
1.2.4 碳氮含量测定
经温度处理后的水稻叶片烘干,用粉碎机粉碎均匀后,用EURO元素分析仪测定碳氮含量。
1.2.5 稻株氨基酸含量测定
分别取SRBSDV病株和健康稻株的叶鞘,于110 ℃杀青1 h后,60 ℃烘干至恒重。称取1 g磨成粉末,加0.1%的HCl定容至25 mL,充分溶解后过滤。取2 mL上清液加4 mL 0.1% TFA溶液快速摇匀,用SEP-PAK 柱纯化后在Sykam S433D氨基酸分析仪上测定氨基酸含量。
1.3 数据分析
采用SPSS 19.0统计软件进行数据分析,应用t检验进行差异显著性检验,描述性统计值用平均值±标准误表示,显著水平设置为ɑ=0.05。
2 结果与分析
2.1 SRBSDV对转基因水稻株高的影响
由表1可知,MH63、T1C-19、T2A-1水稻植株感染SRBSDV 后株高分别为107.33、98.83、109.83 cm,均显著低于正常水稻植株。
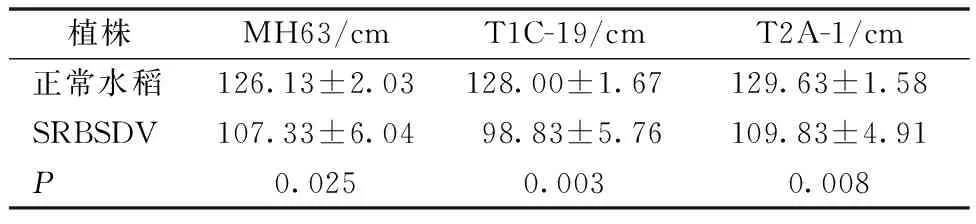
表1 SRBSDV对转基因水稻株高的影响Table 1 Effect of SRBSDV-infected plants on plant height of transgenic rice
2.2 SRBSDV对转基因水稻植株可溶性糖含量的影响
正常水稻植株可溶性糖含量分别为2.10%、2.12%、1.89%,而转基因水稻MH63、T1C-19、T2A-1感染SRBSDV后可溶性糖含量分别为1.90%、2.09%、2.19%(表2),与正常水稻可溶性糖含量均无显著性差异。

表2 SRBSDV对转基因水稻植株可溶性糖含量的影响Table 2 Effect of SRBSDV-infected plants on soluble sugar contents of transgenic rice
2.3 SRBSDV对转基因水稻植株碳氮含量的影响
由表3可知,不同水稻品种感染SRBSDV后对水稻碳氮含量的影响是不同的。正常MH63水稻感染SRBSDV后氮含量显著提高,碳含量无显著性差异;T2A-1水稻感染SRBSDV后氮含量降低,碳含量显著提高;TIC-19水稻感染SRBSDV后氮含量显著提高,碳含量略有提高。
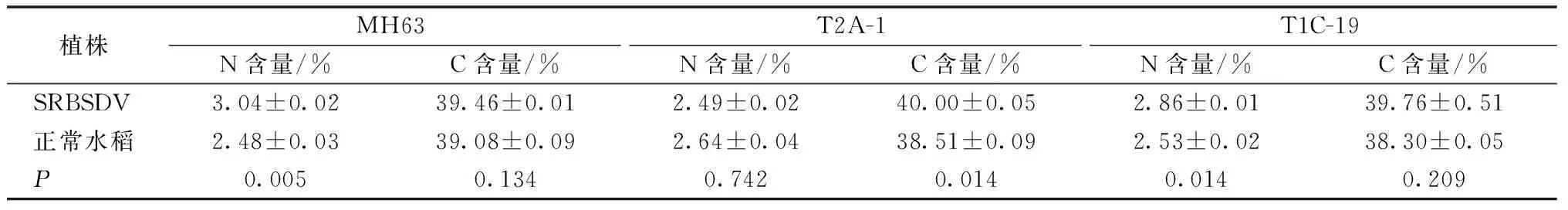
表3 SRBSDV对水稻植株碳氮含量的影响Table 3 Effects of SRBSDV-infected plants on carbon and nitrogen content of transgenic rice
2.4 SRBSDV对转基因水稻植株氨基酸含量的影响
不同水稻品种感染SRBSDV后植株体内氨基酸含量变化见表4~6。转基因水稻MH63、T1C-19、T2A-1感染SRBSDV后植株体内各种氨基酸及总氨基酸含量均提高。
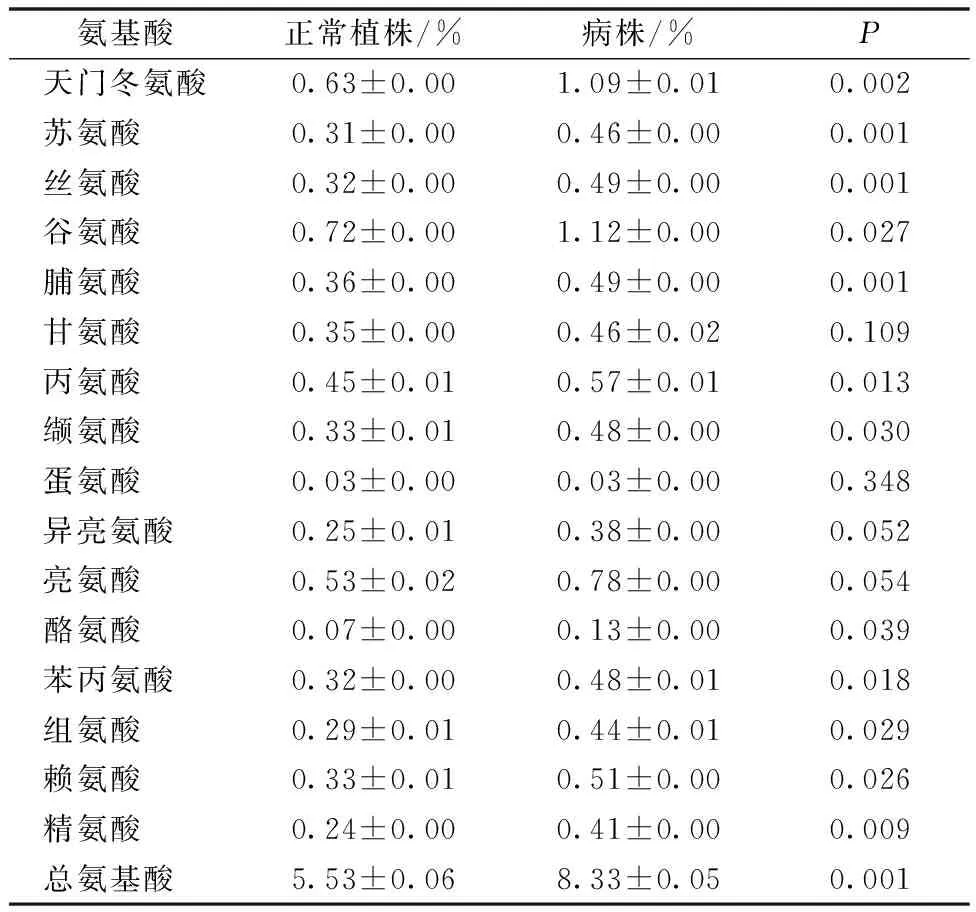
表4 MH63感染SRBSDV后植株内氨基酸含量的变化Table 4 Changes in amino acid contents in SRBSDV-infected rice plants of MH63
MH63感染SRBSDV后其体内天门冬氨酸、苏氨酸、丝氨酸、谷氨酸、脯氨酸、丙氨酸、缬氨酸、酪氨酸、苯丙氨酸、组氨酸、赖氨酸、精氨酸含量分别增加了0.46百分点、0.15百分点、0.17百分点、0.40百分点、0.13百分点、0.12百分点、0.15百分点、0.06百分点、0.16百分点、0.15百分点、0.18百分点、0.17百分点,总氨基酸含量提高了2.80百分点,均高于正常水稻植株的各种氨基酸含量及总氨基酸含量(表4)。
T1C-19感染SRBSDV后除蛋氨酸含量略微下降,其他15种氨基酸含量均有提高,且除脯氨酸、丙氨酸、苯丙氨酸与正常水稻植株含量无显著差异,其他12种氨基酸含量均显著高于正常水稻植株(P<0.05),总氨基酸含量较正常植株提高了0.84百分点,也显著高于正常水稻植株氨基酸含量(P<0.05)(表5)。
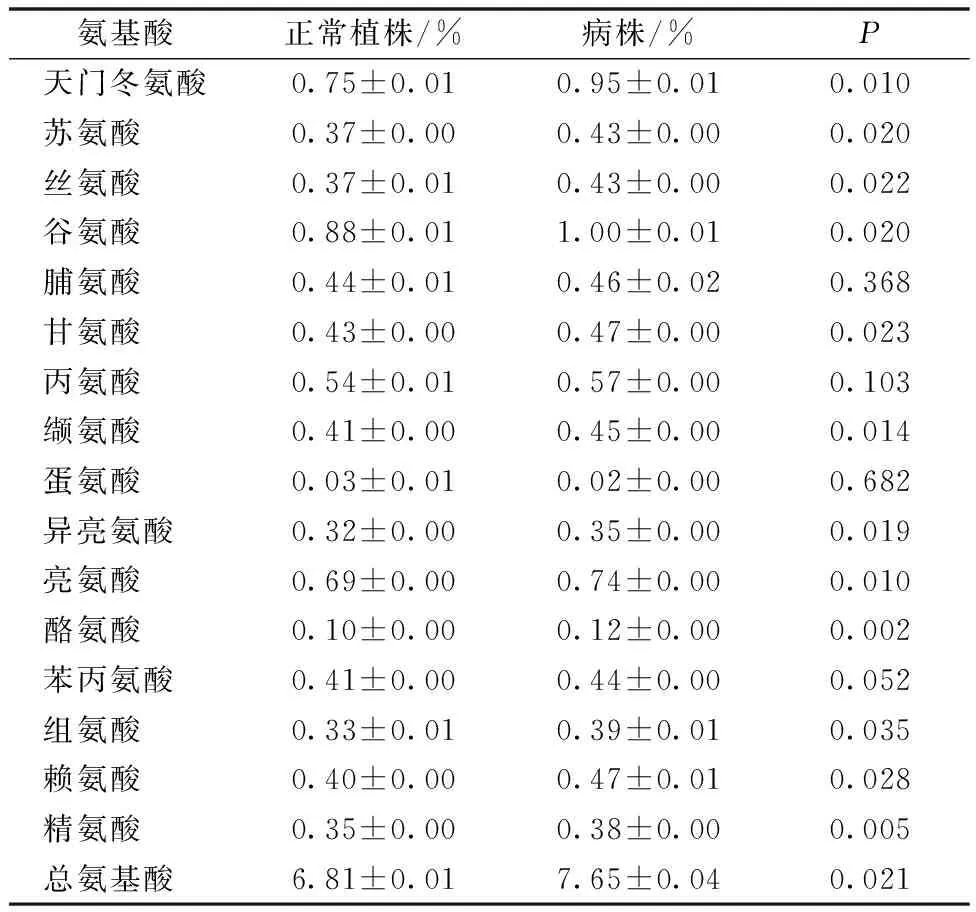
表5 T1C-19感染SRBSDV后植株内氨基酸含量的变化Table 5 Changes in amino acid contents in SRBSDV-infected rice plants of T1C-19
T2A-1感染SRBSDV后天门冬氨酸、苏氨酸、谷氨酸、异亮氨酸、亮氨酸、组氨酸、赖氨酸、总氨基酸含量均显著高于正常水稻植株氨基酸含量(P<0.05),其他氨基酸含量与正常水稻植株氨基酸含量均无显著性差异(表6)。

表6 T2A-1感染SRBSDV后植株内氨基酸含量的变化Table 6 Changes in amino acid contents in SRBSDV-infected rice plants of T2A-1
3 讨论
寄主与病毒的侵染是一个相互竞争的过程,植物利用细胞壁的物理屏障、RNA干扰等多种方式抵御病毒的侵入,相反,病毒则借助机械损伤或媒介昆虫完成侵染,且经过病毒原质体、装配病毒粒子和编码沉默抑制子的形成来确保病毒 RNA不被寄主降解。因此,病毒的生命活动过程,通常与宿主蛋白相互作用,从而直接或间接导致易感寄主产生症状[11]。如贝壳杉烯氧化酶与RDV互作,抑制 GA 的合成,导致水稻产生矮缩症状[12],生长素调节因子(PAP1)与TMV RdRp 互作干扰生长素的合成,使植株产生矮化的症状[13]。本研究结果与前人研究一致,试验结果表明,MH63、T1C-19、T2A-1感染SRBSDV后植株高度显著下降,呈明显矮缩状。另外,病毒还使植株呈花叶、皱缩等症状,影响作物光合作用,严重影响作物的产量和品质[14]。
游离氨基酸、可溶性糖是植物体内基础的营养物质,进而影响媒介昆虫的生长发育和生殖能力等生物学特性[15]。已有研究表明,当植物遭受病原物的侵染时,会诱导体内可溶性糖、氨基酸以及碳水化合物含量的变化,其中氨基酸含量的变化会直接影响到植食性昆虫的取食[16-18]。本研究结果表明,MH63、T1C-19、T2A-1感染SRBSDV 后可溶性糖含量与正常水稻无显著性差异。与丁天波等[19]的研究结果一致,该研究表明番茄感染ToCV后总糖含量与正常植株无显著性差异。而闫慧娟等[20]的研究发现,感病品种的三叶期玉米植株接种矮花叶病毒(maize dwarf mosaic virus,MDMV)后,叶片可溶性糖含量下降。陈茜等[21]研究发现,CMV侵染的烟草叶片中总糖含量较健康烟草略有降低。笔者早期研究发现,水稻嘉优8号在感染RBSDV后植株体内的可溶性糖含量则是正常稻株的3倍[22],与本试验的结论均不一致。所以笔者推测可能是由于水稻品种、病毒种类不同等原因造成的。
病毒侵染寄主后也会对寄主植物的碳氮代谢产生影响,进而导致媒介昆虫生物学特性的改变。如大豆花叶病毒(SMV)侵染大豆后,病毒明显地抑制寄主碳水化合物代谢,促进寄主氮化物的代谢,从而有利于病毒的复制和增殖[23]。本试验的研究结果表明,不同品种的转基因水稻感染SRBSDV后碳氮含量影响不一致,MH63、T1C-19感染SRBSDV后水稻植株的氮含量显著提高,T2A-1水稻感染SRBSDV后碳含量则显著提高(P<0.05)。
丁天波等[19]研究发现,感染ToMV的番茄植株与正常植株总氨基酸及游离氨基酸含量均未达到显著性差异。而陈茜等[24]研究发现,CMV侵染的叶片中游离氨基酸的含量显著升高[21],PVY 的侵染导致烟草体内氨基酸含量增加。本研究发现 MH63、T1C-19、T2A-1感染SRBSDV后植株体内各种氨基酸及总氨基酸含量均提高。这与杨熙彬等[25]、何哓婵等[22]的研究一致。因此,可以推断病毒侵染诱导植株营养物质的变化趋势是多样的,不同传播方式的病毒,其介体获毒所需的时间、持毒和传毒时间均不相同,因此,病毒通过改变寄主植物的营养物质、次生物质等来调整介体昆虫的“去留”以最大限度地把病毒传播下去。
