SOX7基因慢病毒载体的构建及其在缺氧条件下对HUVECs增殖与迁移功能的影响
2024-05-07吴逸卓黄俊鑫丁晓维
吴逸卓, 黄俊鑫, 丁晓维, 于 昱
(上海交通大学医学院附属新华医院心血管发育与再生医学研究所, 上海 200092)
SOX转录因子家族在1990年由于哺乳动物Y染色体性别决定区(Sex determining region of Y,SRY)中HMG盒的高度保守性而首次被发现[1]。按照基因构成和功能可分为9个家族(A、B1、B2、C、D、E、F、G、H)[2]。其中SOX7通常在转录水平上参与胚胎脉管系统的发育[3]。在E7.5的小鼠胚胎中,SOX7+的细胞占内皮前体细胞中ETV2+/FLK1+/CD41-细胞的97%,说明SOX7可能是早期血管发生的重要调节因子[4]。在动脉粥样硬化病变早期,血管内膜增厚,出现缺氧环境,血管内皮细胞功能发生改变[5],而SOX7是内皮相关转录因子,调控血管功能。研究显示,SOX7突变体斑马鱼的脉管系统出现显著的血管异位连接[6]。在高级别胶质瘤患者中,SOX7促进血管形成异常[7]。因此,SOX7与血管内皮细胞之间的联系有待深入探索。本研究通过构建SOX7稳定表达细胞株,分析缺氧条件下SOX7对人脐静脉内皮细胞株(Human umbilical vein endothelial cells,HUVECs)功能的影响,以期进一步探究SOX7对动脉粥样硬化早期病变的具体作用机制。
1 材料与方法
1.1 细胞人胚肾细胞系(293T细胞)、人脐静脉内皮细胞系(HUVECs)、pcDNA3.1(+)-SOX7质粒、pHAGE-CMV-MCS-IRES-ZsGreen慢病毒过表达载体(以下简称pHAGE空载体)及相关辅助质粒(psPAX2和pMD2.G)由新华医院心血管发育与再生医学研究所保存。
1.2 试剂与仪器NheI-HF(货号:R3131V)、NotI-HF(货号:R3189V)均购自美国NEB公司;无内毒素质粒小提中量试剂盒(离心柱型)(货号:DP118-02)、无内毒素质粒大提试剂盒(离心柱型)(货号:DP117)、琼脂糖凝胶DNA回收试剂盒(增强型)(货号:DP219-02)均购自天根生化科技(北京)有限公司;ClonExpress II One Step Cloning Kit(货号:C112-01)、Ultra Gelred(货号:GR501-AA)、ChamQ SYBR Color qPCR Master Mix(货号:Q411-02)均购自南京诺唯赞生物科技股份有限公司;Agarose(Low EEO)(货号:ST004Q)、BeyoPureTMLB Broth with Agar(premixed powder)(货号:ST158)、BeyoPureTMLB Broth(premixed powder)(货号:ST156)、Ampicillin(100 mg/mL,1 000×)(货号:ST008)、辣根过氧化物酶标记山羊抗兔IgG(H+L)(货号:A0208)、CCK-8试剂盒(货号:C0039)、polybrene(货号:C0351)均购自上海碧云天生物技术有限公司;高糖DMEM培养基(货号:L110KJ)、0.25%胰酶EDTA溶液(货号:S310KJ)购自上海源培生物科技股份有限公司;SOX7 Polyclonal antibody(货号:23925-1-AP)、GAPDH Monoclonal antibody(货号:60004-1-Ig)均购自武汉三鹰生物技术有限公司;Stbl3感受态细胞(新赛美生物,货号:MC012);PEI 250000(美国,Polysciences公司,货号:24314-2);胎牛血清(以色列,BI公司,货号:04-001-1ACS);PrimeScriptTMRT Master Mix(Perfect Real Time)(货号:RR036A)、RNAiso Plus(货号:9109)购自日本TaKaRa公司。超净工作台(型号:51900900)、三气培养箱(型号:51033781)均购自美国Thermo Fisher Scientific公司;荧光显微镜(德国,ZEISS公司,型号:Axio Vert.A1);梯度PCR仪(型号:C1000)、荧光定量PCR仪(型号:CFX96)、垂直电泳仪(型号:1658000)、膜转移装置(型号:1703930)、化学发光成像仪(型号:12003154)均购自伯乐生命医学产品(上海)有限公司;高速离心机(德国,Eppendorf公司,型号:5424R);多功能酶标仪(瑞士,TECAN公司,型号:spark)。
1.3 方法
1.3.1 构建SOX7过表达载体 使用限制性内切酶NheI-HF和NotI-HF双酶切pHAGE空载体,通过琼脂糖凝胶DNA回收试剂盒得到线性的载体骨架。以pcDNA3.1(+)-SOX7和pHAGE载体为模版设计引物,PCR扩增SOX7。SOX7引物序列由生工生物工程(上海)股份有限公司合成,引物序列见表1。使用Clon Express II One Step Cloning Kit进行同源重组后转化涂板。挑克隆摇菌,测序得到正确的重组载体。

表1 PCR引物序列设计
1.3.2 慢病毒包装及浓缩使用 PEI250000进行质粒转染。以10 cm培养皿为例,500 μL Opti-MEM无血清培养基中加入9 μg质粒(穿梭质粒∶psPAX2∶pMD2.G =3∶2∶1比例),另取500 μL Opti-MEM无血清培养基加入27 μL PEI250000(浓度为1 μg/μL),静置5 min。将两者混匀,继续静置15 min,加入培养皿。转染后6 h换液,在48 h、72 h时取上清,使用0.45 μm滤网过滤。加入10% PEG6000混匀,4℃静置1.5 h,每20 min上下颠倒。预冷离心机,8 000 r/min,离心10 min。去除上清,使用无血清DMEM重悬沉淀,分装,-80℃保存备用。
1.3.3 慢病毒感染HUVEC 取对数生长期的HUVECs接种至10 cm培养皿中,置于37℃、5%CO2培养箱培养。待细胞密度达50%时,分别加入浓缩后的pHAGE慢病毒悬液和SOX7-pHAGE慢病毒悬液,各100 μL,同时各加入8 μL polybrene,感染24 h后换液。感染后48~72 h在激发波长为488 nm的荧光显微镜下均可观察到绿色荧光。以上步骤重复数次,直至可观测到绿色荧光。
1.3.4 qPCR检测mRNA表达水平 将细胞接种至6孔板中,用RNAiso PLUS提取RNA并测定浓度。取1 μg的RNA和5 μL 5×PrimeScriptTMRT Master Mix (Perfect Real Time),DEPC水补足至10 μL,按照设定程序在PCR仪进行逆转录。qPCR体系:ChamQ SYBR Color qPCR Master Mix(5 μL)、10 μmol/L的Primer-F和Primer-R各0.2 μL、DEPC水(5.4 μL)、未稀释的cDNA(1 μL),按照设定程序在PCR仪进行荧光定量。实验重复3次。
1.3.5 免疫印迹(Western blot)检测 蛋白表达水平将细胞接种至6孔板中,使用放射免疫沉淀蛋白裂解液提取蛋白,BCA法测定蛋白浓度。使用10%聚丙烯酰胺凝胶于80 V恒压电泳,直至溴酚蓝电泳至凝胶底部,后250 mA恒流转膜60 min。室温,5%BSA溶液封闭75 min,TBST洗膜5 min×3次,加入一抗,4℃孵育14~16 h,第二天使用TBST洗膜5 min×3次,加入二抗,室温孵育1 h。继续使用TBST洗膜5 min×3次后,进行化学发光。
1.3.6 细胞划痕实验 取对数生长期的HUVECs,用胰酶(0.25%)37℃消化,对细胞悬液进行计数,并稀释至2.5×105个/mL。在6孔板每孔中接种2 mL细胞悬液,置于37℃、5%CO2培养箱培养过夜,使细胞密度达100%。次日,使用同一枪头在培养皿底部划痕,PBS洗4次,清除漂浮细胞,加入无血清DMEM,分别置于37℃、5%CO2和37℃、5%CO2、1%O2培养箱培养,0、24 h拍照记录。划痕结果用Image J软件进行分析。实验重复3次。
1.3.7 CCK-8细胞增殖实验 根据梁慧敏等[8]的研究结果,本研究以48 h为节点研究缺氧条件下SOX7对HUVECs增殖功能的影响。取对数生长期的HUVECs,用胰酶(0.25%)37℃消化,对细胞悬液进行计数后稀释至2×104个/mL,96孔板每孔接种100 μL,分别置于37℃、5%CO2和37℃、5%CO2、1%O2培养箱培养48 h。去除原培养液,PBS清洗,加入100 μL含10%CCK-8溶液的完全培养基,在原培养条件下继续孵育1 h。使用酶标仪于450 nm处测定吸光度值。实验重复3次。
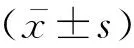
2 结果
2.1SOX7重组慢病毒载体的构建通过对PCR扩增获得产物进行电泳,可看到长度分别为7 724 bp的载体片段条带和1 167 bp的SOX7基因条带,见图1。SOX7-pHAGE重组质粒的DNA测序结果证实,SOX7基因成功插入至限制性内切酶NotI位点(GCGGCCGC)和NheI位点(GCTAGC)之间,见图2、3。

注: A, pHAGE空载体双酶切产物胶图; B, PCR扩增产物胶图。

图2 SOX7-pHAGE重组质粒图谱
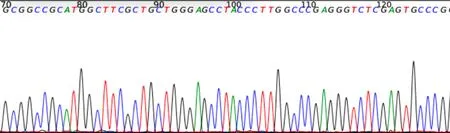
图3 SOX7-pHAGE重组质粒的DNA测序峰图
2.2SOX7重组慢病毒载体mRNA和蛋白表达的验证与pHAGE空载体的SOX7比较,SOX7- pHAGE重组质粒在mRNA水平上显著升高约111.4倍(P=0.002 8),在蛋白质水平上出现过表达条带。空载体未检测出条带,而SOX7- pHAGE重组质粒检测到清晰条带,见图4。

注:A,qPCR检测SOX7 mRNA表达量统计图; B, Western blot检测SOX7蛋白表达电泳图
2.3 构建SOX7稳定感染细胞株在激发波长为488 nm处的荧光显微镜下可观察到SOX7稳定感染细胞株发出绿色荧光,见图5。qPCR和Western blot结果显示,SOX7稳定感染细胞株中SOX7在mRNA水平上显著升高68.2倍(P=0.003 0),在蛋白水平上显著升高1.7倍(P=0.004 3),SOX7稳定感染细胞系构建成功,见图6。

图5 慢病毒感染HUVECs后的荧光表达结果(40×)
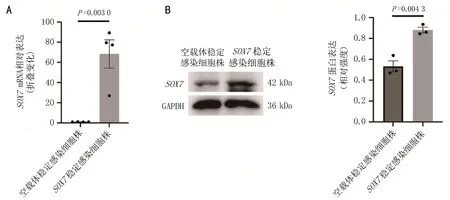
注:A,qPCR检测SOX7 mRNA表达量统计图; B,Western blot检测SOX7蛋白表达电泳图;与空载体稳定感染细胞株比较,P=0.003 0,P=0.004 3。
2.4 缺氧条件下SOX7对HUVECs迁移的影响细胞划痕实验结果显示,在缺氧条件下,空载体稳定感染细胞株的迁移能力降低至常氧条件的0.88倍(P=0.007 6),而SOX7稳定感染细胞株则可改善细胞的迁移能力,使其增强约1.2倍(P=0.004 4)。在常氧条件下,空载体稳定感染细胞株与SOX7稳定感染细胞株对迁移能力无影响(P>0.999 9),见图7。

注:A-B,细胞划痕实验结果图;与pHAGE空载体比较,P=0.007 6, P=0.004 4。
2.5 缺氧条件下SOX7对HUVECs增殖的影响在缺氧条件下,空载体稳定感染细胞株的增殖能力减弱至常氧水平的0.7倍(P=0.007 6),而SOX7稳定感染细胞株可以回补细胞增殖能力,使增殖能力增强1.4倍(P=0.022 8)。在常氧条件下,SOX7稳定感染细胞株可促进细胞增殖,与空载体稳定感染细胞株比较增加1.3倍(P=0.008 7),见图8。
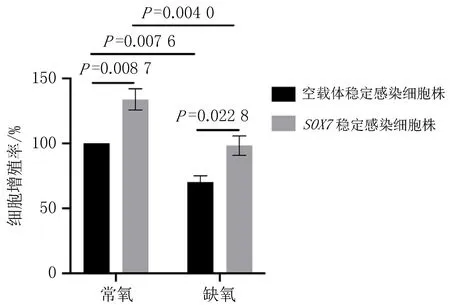
图8 SOX7对HUVECs增殖的影响
3 讨论
SOX7定位于8p23.1,在各类生物的基因组中具有高度保守性[9]。除调控血管发育和维持血管功能外,SOX7在其他领域中也有许多重要的发现。在乳腺癌[10]、前列腺癌[11]中SOX7表达水平下调,可作为肿瘤抑制因子及重要的肿瘤标志物。在人肺癌相关细胞系和乳腺癌细胞系中,SOX7通过上调P38和凋亡途径相关的基因来诱导细胞凋亡,同时SOX7也可抑制泛素-蛋白酶体系统中促凋亡蛋白的降解[12]。除此之外,SOX7在胚胎发育(特别是心血管系统的发育)中也具有重要作用。有研究显示,SOX7单倍体功能不全导致先天性膈疝发生,而缺失SOX7的第二外显子后胚胎在膈肌发育前死亡,并伴有心包囊扩张和卵黄囊异常重塑[13]。小鼠胚胎从E7.5发育至E10.5,胚胎出现了广泛的血管发育异常[14]。在心内膜内皮细胞中特异性敲除SOX7使心内膜垫发育不良,引起房室间隔缺损[15]。SOX7也促进心肌致密化,参与冠状动脉发育[16]。
本研究通过构建SOX7-pHAGE重组质粒和SOX7稳定感染细胞株,为研究动脉粥样硬化中SOX7调控内皮细胞功能提供了理论基础。在肺癌细胞中,过表达SOX7后细胞的迁移和增殖能力减低[17],而在乳腺癌细胞中,缺失SOX7后细胞的迁移和增殖能力增加[10]。SOX7在不同肿瘤细胞中可抑制细胞增殖和迁移能力,但涉及内皮细胞尤其是缺氧造模的疾病模型下的相关研究鲜见报道。因此,本研究重点关注SOX7对缺氧情况下血管内皮细胞的增殖与迁移能力的影响。结果显示,在常氧条件下,SOX7稳定感染细胞株对其迁移能力没有影响,但促进了细胞增殖能力。这与Xu等[10]的研究结果一致。而在缺氧条件下,SOX7稳定感染细胞株可有效回补HUVECs的迁移和增殖能力,改善血管功能。
综上所述,本研究构建了SOX7- pHAGE重组质粒和SOX7稳定感染细胞株。发现在常氧条件下,SOX7稳定感染细胞株可促进HUVECs的增殖能力;在缺氧条件下,SOX7稳定感染细胞株可回补HUVECs被抑制的迁移和增殖能力,这为研究SOX7在内皮细胞中的功能提供了细胞层面的依据。但本研究仅限于体外细胞实验,对SOX7在动脉粥样硬化发生发展中的作用及分子机制仍需进行深入的细胞和动物实验。
