微孔板法测定乳粉中叶酸含量的不确定度分析
2024-05-06刘子音
刘子音
卓一鸣
刘腊兰
彭 纳
吴后吕
(长沙市食品药品检验所,湖南 长沙 410016)
叶酸,或称维生素B9、维生素M,广泛参与人体内蛋白质、核酸的代谢和细胞增殖,并且是血红蛋白的组分之一,对人体尤其是孕妇和婴幼儿的健康至关重要[1]。孕妇缺乏叶酸可致胎儿畸形,婴幼儿缺乏叶酸会阻碍神经系统发育及引发巨幼细胞性贫血[2-4]。中国食品安全标准对婴、幼儿配方食品中叶酸含量都有强制性要求[5]。叶酸含量的检测方法主要有液相色谱法[6-9]、分光光度法[8-9]、酶联免疫法[10-11]、微生物法[12-13]等。由于叶酸不稳定,见光、受热易分解[14],因此不适于采用理化方法检测。目前,微生物法是GB 5009.211—2022指定的仲裁方法,并在2014版的试管法基础上增添了新的微孔板法。微孔板法相较于试管法所耗试剂更少,测定更加快捷,但因培养体积变小,试验的不确定性发生变化。研究拟按GB 5009.211—2022中微孔板法对婴儿配方乳粉中的叶酸含量进行同条件下的10次平行测定,依据CNAS-CL01-G003:2021、CNAS-GL05:2011、JJF 1059.1—2012等标准对影响检测结果的各种因素进行分析和评估,计算各分量的不确定度,综合处理后得到合成标准不确定度及扩展不确定度[15],以期为实验室质量控制和试验流程优化提供依据。
1 材料与方法
1.1 材料与仪器
1.1.1 耗材试剂
婴儿配方乳粉:长沙市食品药品检验所抽检样;
叶酸标准品:纯度≥99.0%,国家标准物质中心;
鼠李糖乳杆菌:ATCC7479,美国模式培养物保藏中心;
菌种储备用琼脂培养基、叶酸测定用培养基:北京路桥技术股份有限公司;
微孔板(96孔)、滤膜(0.22 μm):美国康宁公司。
1.1.2 仪器与设备
电子天平:BSA224S型,北京赛多利斯科学仪器有限公司;
高压灭菌器:SM830型,重庆雅马拓科技有限公司;
生化培养箱:LRH-250F型,上海一恒科技有限公司;
移液器:1 mL、200 μL量程,美国Eppendorf公司;
容量瓶:100,1 000 mL容积,湖南湘玻科学仪器有限公司;
多功能酶标仪:Ensight型,新加坡PerkinElmer公司。
1.2 试验方法
1.2.1 标准溶液的配制 参照GB 5009.211—2022。
1.2.2 接种液的制备 按GB 5009.211—2022要求操作,将鼠李糖乳杆菌菌种转接至菌种储备用琼脂培养基中,(36±1) ℃恒温培养20~24 h,连续传种2~3代,挑取单菌落接种至含有叶酸的叶酸测定用培养液中,(36±1) ℃恒温培养20~24 h,转接至不含叶酸的叶酸测定用培养液中饥饿培养6 h,得到接种液。
1.2.3 样液制备 称取约0.1 g样品于锥形瓶中,加入80 mL氢氧化钠乙醇溶液,具塞,超声振荡2 h,转入100 mL容量瓶中,用无菌水定容。取1 mL无菌水稀释10倍,过滤除菌,得到样品待测液。
1.2.4 样品测定 按GB 5009.211—2022中微孔板法制备试样系列管和标准系列管(均过滤除菌),与含有接种液的测定用培养基(40 μL接种液/10 mL培养基)各150 μL一起转接至微孔板,覆膜,混匀,于(36±1) ℃恒温培养32~40 h,用酶标仪快速测定540 nm处吸光值(若0对照孔出现浑浊,说明可能有杂菌污染,需重做)。
1.2.5 数学模型的建立 按式(1)计算样品中叶酸含量。
(1)
式中:
X——样品中叶酸含量,μg/100 g;
c——样品待测液叶酸浓度的平均值,ng/mL;
V——样品溶液定容体积,mL;
f——样品溶液稀释倍数;
m——样品称取量,g。
1.2.6 数据处理 对各分布类型数据的处理方法及运用到的计算公式参考JJF 1059.1—2012;标准曲线的二项式回归方程由Excel程序生成;二项式方程转换为直线方程的处理方法参考相关文献。
2 结果与分析
2.1 不确定度来源
微孔板法测定叶酸含量过程中的不确定度来源主要有:① 标准溶液制备引入的不确定度,包括标准品的纯度、标准物质的称量、稀释,标准系列管的配制;② 样液制备引入的不确定度,包括样品的称量和稀释,试样系列管的配制;③ 接种微孔板过程引入的不确定度;④ 拟合标准曲线引入的不确定度;⑤ 酶标仪仪器误差产生的不确定度;⑥ 测量重复性引入的不确定度。
2.2 各不确定度分量评定
2.2.1 标准溶液制备引入的不确定度
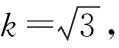
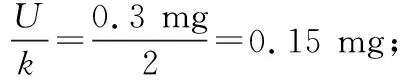


表1 标准工作液配制过程量具校准引入的不确定度
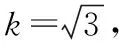
合成标准工作液配制过程引入的相对不确定度:
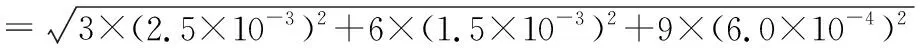
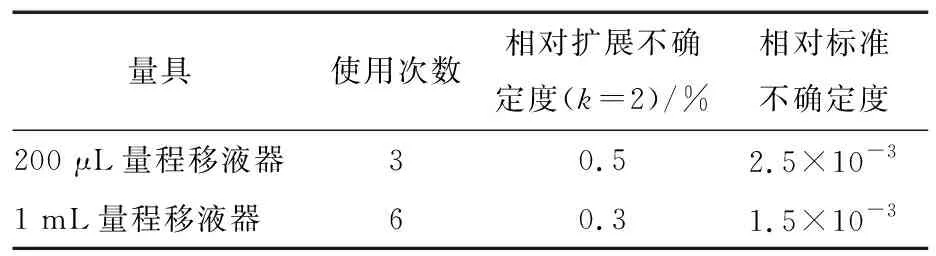
表2 标准系列管配制过程量具校准引入的不确定度
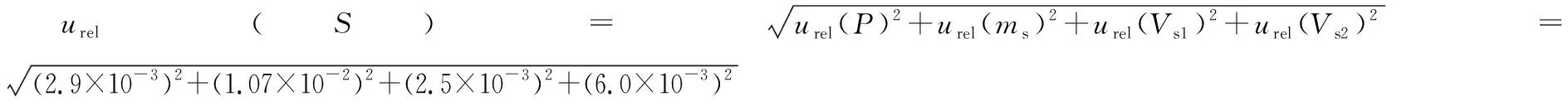
2.2.2 样液制备引入的不确定度
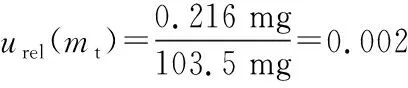
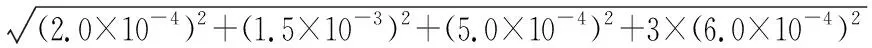
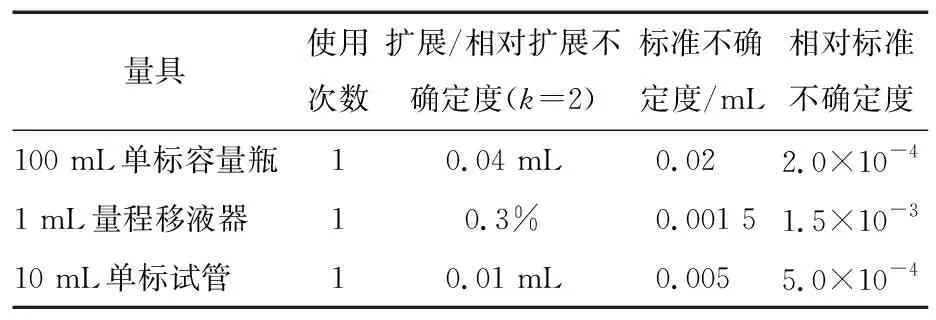
表3 样品待测液配制过程量具校准引入的不确定度
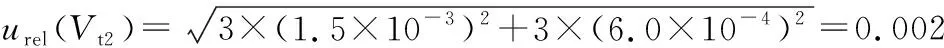
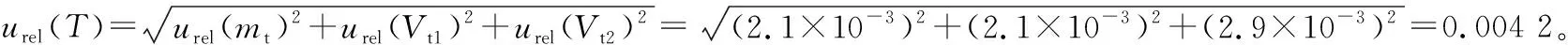
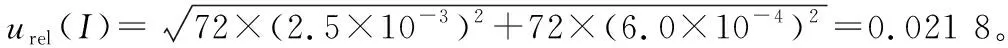
2.2.4 拟合标准曲线引入的不确定度 试验原理是利用鼠李糖乳杆菌的生长速率与环境中叶酸含量成正比,通过检测菌液浊度可反映培养基中初始叶酸含量。理想状态以叶酸初始含量为横轴,吸光度为纵轴建立的标准曲线应为直线,但由于培养过程中叶酸不断消耗,乳杆菌产生的有害代谢物不断累积,实际的生长曲线会逐渐趋于平缓,因此将标准曲线拟合成二次方程较为符合实际情况,具体数据见表4,得回归方程Y=-232.52x2+22.775x+0.182 1,R2=0.997 4。
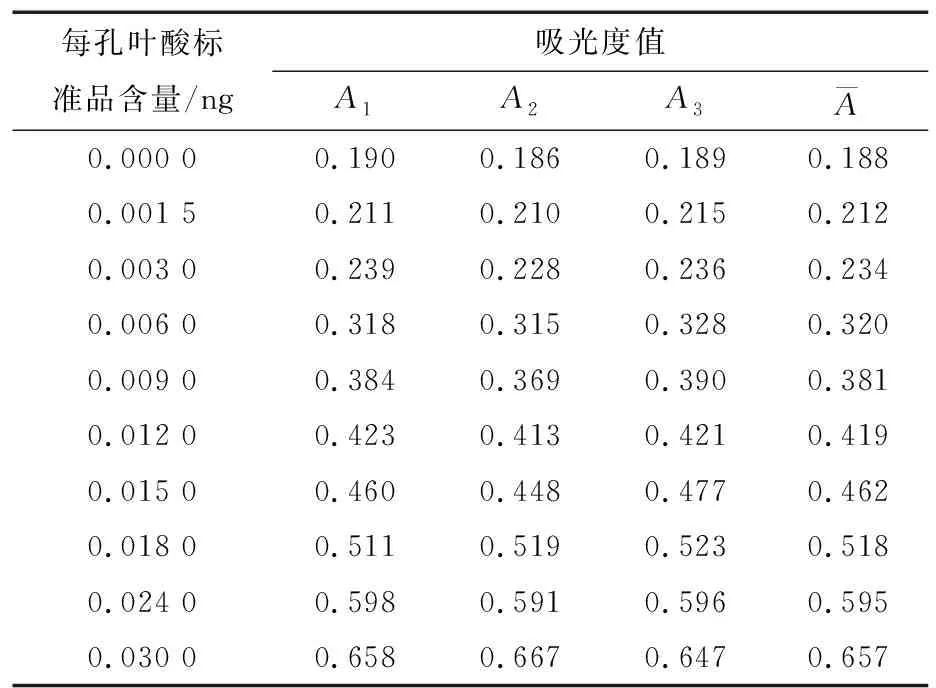
表4 标准曲线试验数据
先将二次曲线方程转化成一次直线方程[16]:
Y=-232.52x2+22.775x+0.182 1=-232.52(x-0.049 0)2+0.739,令Z=(x-0.049 0)2,则原方程可以转化为Y=aZ+b=-232.52Z+0.739,斜率a=-232.52,截距b=0.739,标准曲线校准点吸光度值残差的标准差:
(2)
式中:
n——标准系列管孔数;
Yi——仪器测得的各标准系列管吸光度值(即表4中A1~A3数值);
aZi+b——由标准曲线公式算得的理论吸光度值(见表5)。
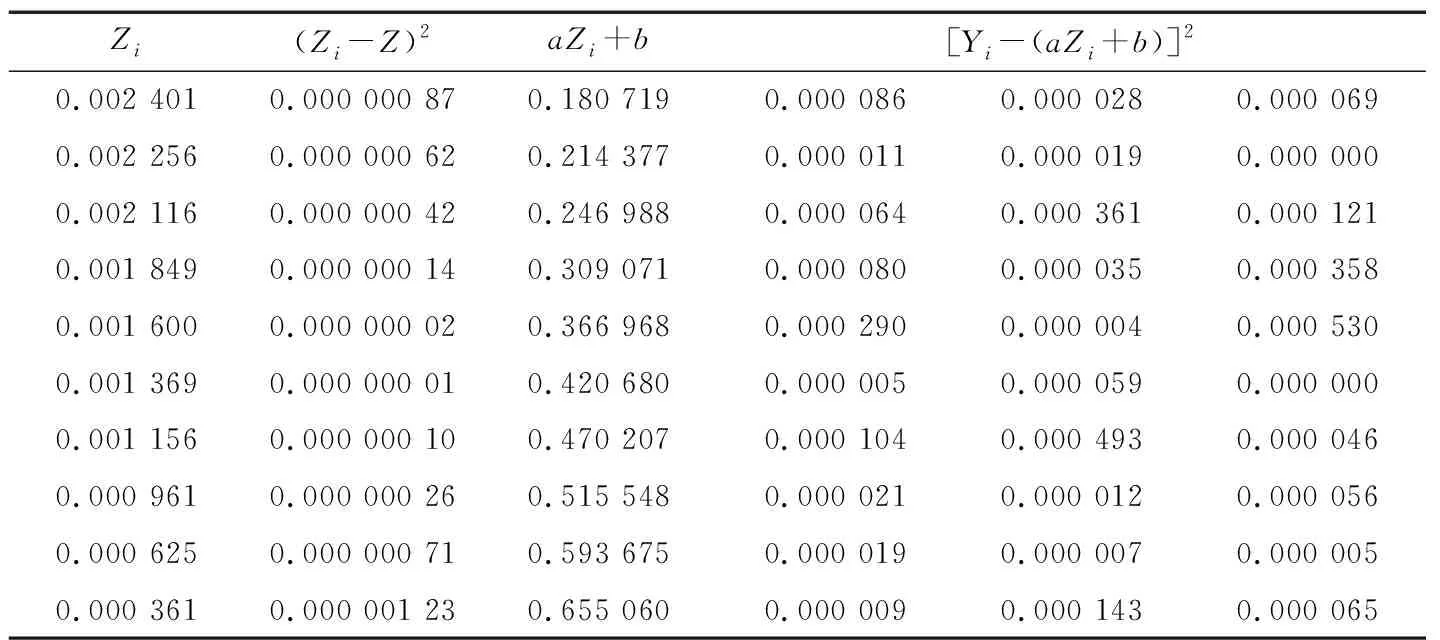
表5 标准曲线各校准点叶酸含量离均差及吸光度值残差
由标准曲线拟合引入的不确定度:
(3)
式中:
p——试样系列管孔数;
C——测得的各试样系列管叶酸含量转换为Z后的平均值;
Zi——各标准系列管叶酸含量转换为Z后的值;

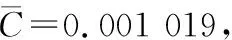
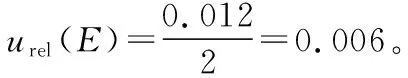
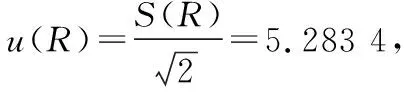
2.3 合成标准不确定度
综上,接种微孔板、拟合标准曲线和测量重复性三者对试验结果影响较大:接种微孔板引入的不确定度主要来自所使用移液器的校准;拟合标准曲线引入的不确定度主要与微生物生长状况的发散性相关;测量重复性引入的不确定度与试验仪器精密度、人员操作稳定性及微生物生长状况的发散性相关,其中后者起关键作用。
将各不确定度分量综合计算,得到此次叶酸测定的合成标准不确定度

2.4 扩展不确定度
该检测结果属于正态分布,当置信水平为95%时,包含因子k=2,扩展不确定度U=u(X)×k=11.04×2=22.08 μg/100 g。此次测定的乳粉样品中叶酸含量可表示为(282.33±22.08) μg/100 g。
3 结论
微孔板法的引入是国标叶酸测定方法的一次优化,其相较于传统的试管法,首先成倍减少了培养基的用量,降低了试验成本。其次,标准管和试样管改用过滤灭菌替代高压灭菌,避免了叶酸受热分解影响检测结果。再次,使用一次性微孔板代替试管,一方面避免了试管因未洗净带入残留造成不良影响,一方面微孔板可以直接使用酶标仪一次性读取全部孔结果,避免了使用分光光度计时逐管测定频繁操作造成的干扰。但新方法有其相应的不确定性。
试验表明,该样品中叶酸含量可表示为(282.33±22.08) μg/100 g(置信度95%)。新增的接种微孔板步骤以及拟合标准曲线、测量重复性,三者是不确定度的主要来源。接种微孔板过程需频繁使用移液器,选用质量较好的移液器能有效降低该不确定度分量。后二者涉及鼠李糖乳杆菌的培养,而微生物的生长状况发散性较大,其影响因素主要有:所用菌株的活性、样品基质所含杂质、培养基的质量、培养条件如温度、时长[17]。因此,选用性状稳定、正规来源的新鲜标准菌株,确保待测样品不含除叶酸外影响鼠李糖乳杆菌生长的其他成分,选用正规厂商培养基并严格按要求配制,使用经检定的恒温培养箱,在适宜的菌液浓度(孔底未出现沉淀)时收取等措施能尽可能降低微生物因素引起的不确定度。 标准品和样品的称量、稀释,标准溶液和样液的配制,以及酶标仪的仪器误差是不确定度的次要来源,可通过使用精密度更高的仪器并注意维护保养、定期检定以减小该部分的影响。
