纳米铁改性生物炭载体强化厌氧氨氧化菌富集与脱氮效果研究
2024-05-05王俊杰杨津津常根旺李绍康侯军华钟根茂白顺果
王俊杰,杨津津,常根旺,李绍康,侯军华,钟根茂,白顺果,李 翔*
1.河北农业大学城乡建设学院,河北 保定 071001
2.中国环境科学研究院,国家环境保护地下水污染模拟与控制重点实验室,北京 100012
厌氧氨氧化 (Anaerobic ammonia oxidizing,ANAMMOX)自1995 年被发现以来,已被广泛用作一种从废水中去除铵(NH4+)的节能生物技术[1].迄今为止,基于ANAMMOX 的工艺在高氮废水的生物脱氮中受到广泛关注[2-3].与传统硝化-反硝化技术相比,ANAMMOX 技术具有许多优点,包括较低的需氧量、较少的污泥产量、较高的氮负荷率和无需外加碳源[4-6].根据目前的文献[7]分析,厌氧氨氧化菌(AnAOB)其中的3 个属,分别为CandidatusJettenia、Candidatus Brocadia和CandidatusKuenenia.
AnAOB 生长条件苛刻,生长缓慢和富集困难极大程度地限制了ANAMMOX 工艺的工程化应用[8].如何实现AnAOB 快速富集是ANAMMOX 工艺大规模应用的技术难题之一.已有研究[9]表明,采用生物膜工艺有助于保持较高的ANAMMOX 微生物量,提升ANAMMOX 反应器的抗冲击负荷,从而提升ANAMMOX 反应器脱氮稳定性[10].生物膜载体对AnAOB 的亲和力是影响生物膜形成速度、稳定性和菌群结构的重要因素[11].传统的生物膜载体有沸石、聚乙烯环、活性炭、海绵、凝胶载体、生物炭、塑料空心圆柱体和陶瓷等.其中BC 具有较大的比表面积、骨架和电子传递能力[12],其不仅能介导AnAOB 进行电子传递,还能强化AnAOB 稳定脱氮.如Chen 等[7]研究发现,BC 促进了电子转移能力,导致负责ANAMMOX 途径的功能基因增加.但由于传统载体亲水性、微生物亲和力不足,且AnAOB 生长极其缓慢,阻碍了ANAMMOX 生物膜的快速形成.铁元素强化ANAMMOX 反应的研究也层出不穷,已有研究表明,nZVI 具有更大的比表面积、更强的还原性,为微生物提供更优异的促进效果,因此受到越来越多的关注[13].同时铁是AnAOB 生长所必需的元素,也是合成参与其代谢的多种含血红素酶所必需的元素.添加适量的铁可以促进AnAOB 的生长,缩短ANAMMOX装置的启动时间[14].此外,nZVI 可以通过消耗残留的溶解氧被氧化为Fe2+和Fe3+,为AnAOB 生长提供厌氧环境[15].如万莉等[16]研究发现,在UASB 装置中添加零价铁以后,装置中同时出现反硝化、ANAMMOX等反应,其中ANAMMOX 占据主导地位,而nZVI@BC材料富集AnAOB 的研究工作较少.本文以传统BC作为骨架,在其表面负载nZVI 以增强其对AnAOB的亲和性,为实现ANAMMOX 生物膜的快速形成、强化AnAOB 的富集提供了新的思路.
本文制备了nZVI@BC 载体,构建了ANAMMOX载体生物膜复合系统,并通过对比投加不同载体的ANAMMOX 装置的脱氮性能、载体表面特征和微生物群落结构变化,探究了nZVI@BC 载体对AnAOB富集的效果,以期为AnAOB 的高效富集提供理论依据和技术支持.
1 材料与方法
1.1 纳米铁改性生物炭载体的制备和改性前后载体表征测试分析
BC 的原材料是核桃壳,其是在600 ℃的高温下充入氮气煅烧得到.nZVI@BC 是通过“FeSO4浸润NaBH4液相还原”法制备[12].将所得的样品使用去离子水和无水乙醇清洗3 次,在恒温干燥箱内以60 ℃烘干6 h,即得到nZVI@BC.为防止nZVI 氧化,用干燥密封袋封装且4 ℃保存.制备过程的反应方程式如式(1)所示.
利用X 射线衍射仪(XRD,BRUKER OPTICS,德国)分析不同载体表面元素,采用扫描电子显微镜(SEM,Thermo Fisher Scientific,美国)分析不同载体形貌,利用比表面积分析仪(Micromeritics,美国)分析不同载体比表面积,利用纳米粒度电位仪(Malvern,英国)分析不同载体表面Zeta 电位.
1.2 接种污泥
ANAMMOX 污泥取自实验室稳定运行3 年的ANAMMOX 反应器[17],接种后每个ANAMMOX 装置中初始混合液悬浮固体浓度(MLSS)为4 717 mg/L、挥发性悬浮固体浓度(MLVSS)为8 312 mg/L,MLSS/MLVSS(浓度比)为0.567,每组装置投加的悬浮污泥量为0.2 L.
1.3 实验用水
进水采用人工模拟废水,其中各组分的浓度如表1 所示.本实验采用无水Na2SO3进行化学脱氧[17],实验装置进水中投加的无水Na2SO3浓度为0.1 g/L,其对微生物和基质浓度几乎不产生影响[18],且化学脱氧的反应式如式(2)所示.实验进水中添加了微量元素Ⅰ和Ⅱ,其组成和浓度如表2 所示.

表1 人工模拟废水组成及浓度Table 1 Artificial simulation of wastewater composition and content
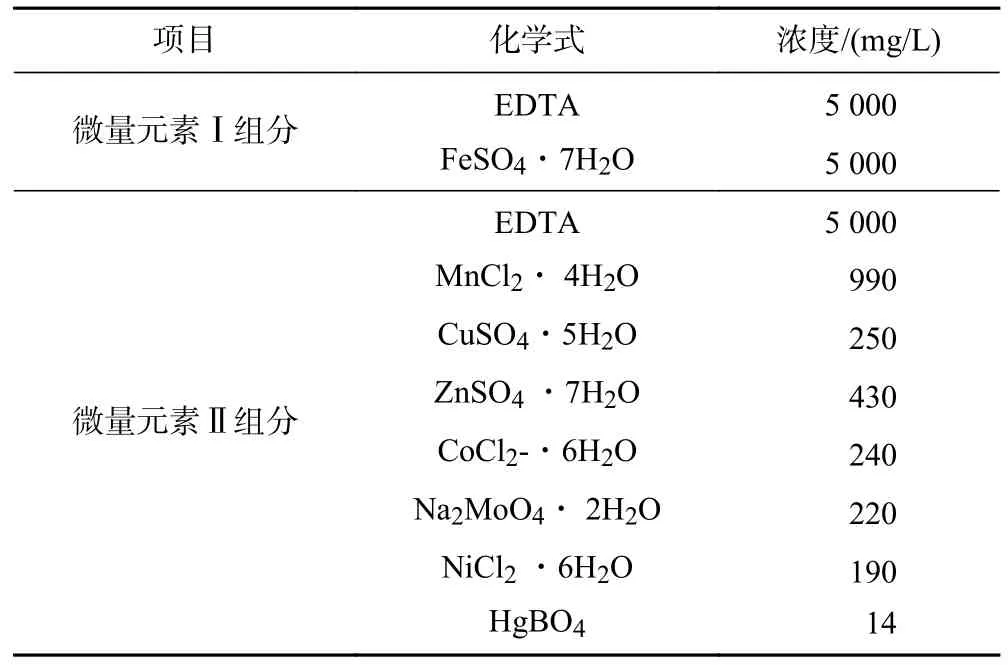
表2 微量元素组分及浓度Table 2 Trace element fractions and contents
1.4 实验装置和运行条件
实验装置容积为0.5 L,其模拟进出废水体积为0.2 L,水力停留时间(HRT)为24 h.实验装置外部用锡纸遮光防止藻类生长,在恒温水浴摇床(33 ℃、120 r/min)中进行富集.设立2 组相同的ANAMMOX装置(见图1),其中R1装置添加BC 载体,R2装置添加nZVI@BC 载体.

图1 ANAMMOX 实验装置示意Fig.1 Schematic diagram of the ANAMMOX experimental setup
1.5 检测项目与方法
每日采用文献[17]中的方法检测装置进出水水质,其中NH4+-N 浓度采用纳氏试剂分光光度法测定,NO2--N 浓度使用N-(1-萘基)-乙二胺分光光度法测定,NO3--N 浓度使用氨基磺酸分光光度法测定.
分析接种污泥和运行20 d 时不同载体表面生物膜中污泥的微生物群落结构,采用文献[8]中报道的常用于检测Anammox 系统微生物群落结构的引物338F(ACTCCTACGGGAGGCAGCAG)和 806R(GGACTACHVGGGTWTCTAAT),针对细菌16S rRNA基因在V3~V4 区域上进行PCR 扩增,与AnAOB 相关的高通量测序工作在Illumina MiSeq 平台进行.污泥浓度和载体表面生物膜的微生物量采用重量法测定.
2 结果与讨论
2.1 载体生物膜表面特征分析
载体生物膜表面特征对微生物附着生长具有关键作用.使用X 射线衍射(XRD)对BC 和nZVI@BC载体进行表征分析,验证nZVI 在BC 表面的负载效果,结果如图2(a)所示.2θ的扫描范围为3°~70°,在44.80°和64.90°时出现衍射峰[13,19],说明nZVI 成功负载至BC 上.
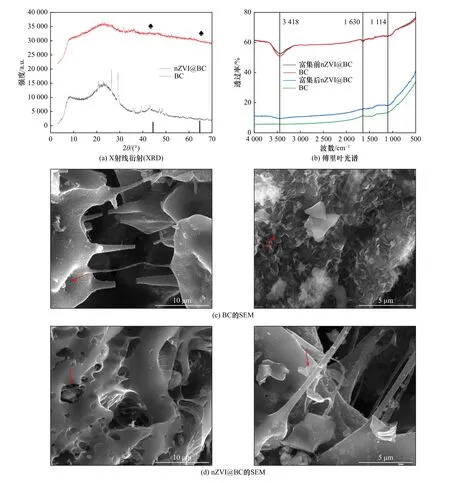
图2 BC 和nZVI@BC 载体的XRD、傅里叶光谱和SEMFig.2 XRD,Fourier spectrum and SEM of BC and nZVI@BC carriers
通过对比改性前、后载体的SEM 图和比表面积数据可知,BC 具有多孔结构,表面呈鱼鳞状〔见图2(c)〕,比表面积(47.17 m2/g)较大,为nZVI 提供了良好的负载位点;nZVI@BC 出现更多微小孔隙〔见图2(d)〕,比表面积(210.82 m2/g)明显增大(见表3),这是因为微观球型且直径较小的nZVI 在BC 表面成功负载.因此载体的表面孔隙越丰富、比表面越大,越能为微生物提供更多的附着位点.

表3 不同载体比表面积、Zeta 电位和表面元素含量对比Table 3 Comparison of specific surface area,zeta potential and surface element content of different carriers
通过对比改性前、后载体表面Zeta 电位可知,BC 的表面电位值为-45.2 mV,nZVI@BC 的表面电位值为-42 mV,这说明载体改性前、后Zeta 电位值没有发生太大变化(见表3),其原因可能是载体表面颗粒带有较多负的或正的电荷,具有很高的Zeta 电位[20].而载体颗粒表面的Zeta 电位能反映载体的聚集稳定性,它们会相互排斥,从而达到载体的稳定性,为微生物的附着生长提供一个稳定的条件.
如图2(b)所示,在3 418 cm-1处产生的吸收峰主要由-OH 基团伸缩振动所引起,在1 630 cm-1处的吸收峰主要是由C=O 和C=C 伸缩振动产生的,由于-OH、C=O 和C=C 都是电负性官能团,说明BC 创造了良好的负载条件,使nZVI 更容易负载在其表面[21].在BC-nZVI 中新的吸收峰(1 114 cm-1处)也发生了偏移,这说明BC 与nZVI 可能通过物理或化学作用形成了nZVI@BC[21].在富集结束以后,3 418 cm-1处产生的吸收峰值明显减弱,这有可能是载体表面生物膜存在污泥将载体包裹在里面.
2.2 ANAMMOX 装置脱氮效果
为了使装置能够进行ANAMMOX 反应,整个实验装置进水NH4+-N 与NO2--N 的基质浓度比采用理论值1∶1.32[2].经过40 d 的运行,R1和R2装置表现出不同的脱氮效果,其中R1和R2装置的NH4+-N 去除率稳定达到90%界限时分别使用了34 d 和17 d,NO2--N 去除率稳定达到90%界限时分别使用了29 d 和13 d,比之前类似的研究花费时间更短,这一方面是因为接种的是成熟的AnAOB 污泥,另一方面是因为改性后的载体比表面积大.由此可见,添加nZVI@BC 使R2装置 的NH4+-N 和NO2--N 去除率达到90%所需的时间均比R1装置短.
第Ⅰ阶段(1~10 d),ANAMMOX 装置进水NH4+-N浓度为50 mg/L,进水NO2--N 浓度为66 mg/L,HRT为24 h.R2装置出水NH4+-N 浓度在2~6 d 不稳定且有明显波动,其中第4 天时出水NH4+-N 浓度达到45.93 mg/L,随后出水NH4+-N 浓度呈现大幅下降,这是由微生物自溶释放有机氮引起的,剩余的微生物群落将有机氮转化为NH4+-N[22],导致第Ⅰ阶段ANAMMOX 装置运行效果不稳定,并且装置中AnAOB 的活性较低,所以装置一开始运行效果不佳〔见图3(a)〕.R1装置出水NO2--N 浓度逐渐增加,与此同时,R2装置出水NO2--N 浓度稳定,但在第7~10 天时,R1装置出水NO2--N 浓度出现明显的上升,但出水NO2--N 浓度始终低于进水NO2--N 浓度〔见图3(b)〕,污泥中的反硝化微生物直接利用NO2--N 和菌体自溶过程中释放的有机碳源进行反硝化作用[8].由于R2装置出水NH4+-N 浓度出现大幅变化,导致R2装置的基质化学计量比高于1.32〔见图3(c)〕.装置出水NH4+-N浓度和出水NO2--N 浓度均有较大的变化,导致NRR呈现下降趋势〔见图3(d)〕.第10 天,R1和R2装置的TN 去除率分别达到45.18%和69.7%〔见图3(e)〕.在第Ⅰ阶段,ANAMMOX 未占主导地位,但R2装置的去除率仍要高于R1装置.
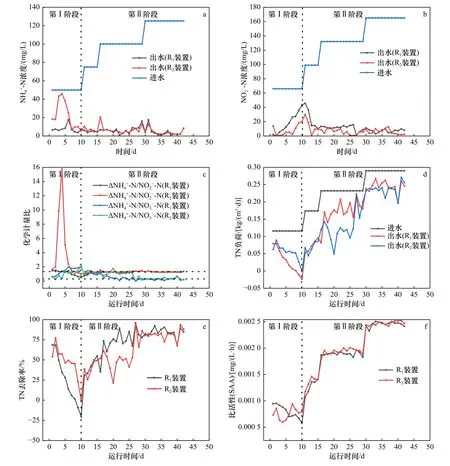
图3 R1 和R2 装置的脱氮性能、化学计量比和比活性变化Fig.3 Variation of nitrogen removal performance,stoichiometric ratio and specific activity of R1 and R2 devices
第Ⅱ阶段(11~40 d),装置的进水NH4+-N 浓度从50 mg/L 逐步提升到125 mg/L,进水NO2--N 浓度从66 mg/L 逐步提升到165 mg/L,HRT 为24 h〔见图3(a)(b)〕.与第Ⅰ阶段相比,第Ⅱ阶段出水NH4+-N 浓度和出水NO2--N 浓度存在小幅波动,装置出水整体趋于稳定.这可能是因为载体为微生物生长提供了不同的生态位点,实现了氨氧化菌(AOB)和AnAOB 等不同菌种的协同脱氮[23]〔见图3(c)〕,R1和R2装置的NH4+-N 消耗量与NO2--N 消耗量的比值已经趋近于理论值1∶1.32,NH4+-N 消耗量与NO3--N 生成量的比值已经趋近于理论值1∶0.26,ANAMMOX 趋于稳定并且占据主导的脱氮地位.如图3(d)(e)(f)所示,R1和R2装置TN 去除负荷(NRR)的最大值分别为0.250 0、0.255 4 kg/(m3·d),TN 去除率的最大值分别为86.99%、89.65%,这与其他生物膜反应器类似[24],这表明AnAOB 可以保留在载体内.该研究中NH4+-N 和NO2--N 的进水浓度最高分别为125 和165 mg/L,且NH4+-N 和NO2--N的去除率均在95%以上,生成的NO3--N 浓度相差不大,最终导致TN 去除负荷相差甚微.BC 和nZVI@BC载体为AnAOB 提供附着位点,提高了微生物的富集密度,江宇勤等[25]研究发现,填料的比表面积越大,越有利于微生物附着、生长和生物膜形成,所以R2装置的去除率高于R1装置.在第Ⅱ阶段,ANAMMOX装置稳定运行,与R1装置相比,R2装置具有更高的脱氮效率和更好的抗冲击性.
2.3 厌氧氨氧化生物膜的变化特征
红色是AnAOB 最显著的特征之一,载体表面生物膜的红色色度与ANAMMOX 活性呈显著相关,可以作为一种直观的ANAMMOX 活性指标[26].载体表面生物膜颜色的变化如图4 所示.第25 天时观察BC 和nZVI@BC 载体富集AnAOB 的效果,发现载体表面生物膜出现红色的污泥,且经过40 d 的培养,BC 和nZVI@BC 载体表面生物膜附着明显的红褐色污泥〔见图4(a)(b)〕.这是因为AnAOB 利用含细胞色素c 在内的多种蛋白质,完成了菌体的生长、繁殖和代谢,其活性明显提高[17],促使本研究中载体表面生物膜红色污泥也明显增多.BC 载体富集的微生物量为2.3 mg,nZVI@BC 载体富集的微生物量为53.4 mg,根据载体生物膜表面富集生物量的结果,复合载体表面AnAOB 的微生物量高于普通载体表面,载体的比表面积是影响生物膜生长状况的首要影响因素[25],因为nZVI@BC 载体的比表面积远大于BC 载体,所以R2装置载体生物膜表面的AnAOB 量是R1装置载体生物膜表面的AnAOB 量的23 倍.实验结束时,在R2装置中接种的絮凝污泥有ANAMMOX 颗粒产生〔见图4(c)〕.装置添加载体后,颗粒污泥粒径的减少有所缓解,可以推断出ANAMMOX 装置中添加nZVI@BC载体能够促进AnAOB 进行造粒.如图4(d)(e)所示,BC 和nZVI@BC 载体表面均出现球状菌,并呈现ANAMMOX 富集物的典型“花椰菜”结构[27].在本研究中,R2装置的色度和富集的微生物量均比R1装置效果显著,R2装置富集AnAOB 的效果比R1装置富集AnAOB 的效果优异.

图4 BC 和nZVI@BC 载体富集厌氧氨氧化菌的变化和实验结束时其SEM 示意Fig.4 Changes of anaerobic ammox bacteria enriched by BC and nZVI@BC carriers and their SEM diagram at the end of the experiment
2.4 微生物群落结构分析
2.4.1 微生物多样性变化特征
对接种时絮凝污泥(R0)、第20 天BC(R1装置)和nZVI@BC(R2装置)表面生物膜进行微生物多样性分析.覆盖率(Coverage)均大于99%,结果较为充分,表明检测样品的细菌可以代表ANAMMOX 装置内大部分微生物群落的变化情况[8].Shannon-Wiener和Simpson 指数可以用来估算样本中微生物群落的多样性,Shannon-Wiener 指数越大代表微生物群落多样性越高,Simpson 指数越大代表微生物多样性越低.经过20 d 的富集,Shannon-Wiener 指数呈下降趋势,Simpson 指数呈上升趋势,其中R2装置的Shannon-Wiener 指数由3.516 降至3.209,Simpson 指数由0.078升至0.102;R1装置的Shannon-Wiener 指数由3.516降至3.329,Simpson 指数由0.078 升至0.088.这说明添加载体后,随着载体富集AnAOB 的进行,微生物逐渐适应新的环境,微生物群落多样性逐渐减少,同时优势物种占比增大,其相关的功能菌逐渐占据绝对优势.
2.4.2 微生物门水平和属水平结果分析
ANAMMOX 装置载体生物膜微生物的优势菌门(相对丰度˃5%)包括绿弯菌门(Chloroflexi)、变形菌门(Proteobacteria)、浮霉菌门(Planctomycetes)〔见图5(a)〕.接种时的AnAOB 的优势菌门为Chloroflexi(占47.32%)、Proteobacteria (占20.65%)、Planctomycetes(占12.4%).如图5(c)所示,经过20 d 的培养,Planctomycetes 在R1装置相对丰度由12.4%变为10.47%,R2装置相对丰度由12.4%变为29.15%,这说明Planctomycetes 的相对丰度在R1装置中减少了1.93%、在R2装置中增加了16.75%,在ANAMMOX装置中引入nZVI@BC 载体进行富集,生物膜微生物中Planctomycetes 的相对丰度大幅提升,研究表明,nZVI@BC 载体富集AnAOB 过程中,Planctomycetes能够成为优势菌门.Chloroflexi 在R1装置的相对丰度由47.32%变为23.81%,在R2装置的相对丰度由47.32%变为26.41%,其在R1、R2装置中分别减少了23.51%、20.91%,同时Chloroflexi 和Planctomycetota是与脱氮相关的微生物[28],Chloroflexi 是AnAOB 的协同菌门,促进ANAMMOX 生物膜的形成,说明污泥驯化过程中Chloroflexi 和Planctomycetota 的相对丰度相差甚微.Proteobacteria 是AnAOB 的协同菌门[2],是参与硝化和反硝化过程的革兰氏阴性菌(其中包括大多数厌氧、好氧和兼性细菌)[29],此过程与脱氮密切相关.在R1装置中Proteobacteria 的相对丰度由20.65%变为23.27%,在R2装置中其相对丰度由20.65%变为21.67%,因此在载体生物膜中其相对丰度占比与其他主要菌门的相对丰度类似[17].在生物膜装置中,Planctomycetes 的相对丰度会有一定程度的提高,Chloroflexi 和Proteobacteria 是生物膜中AnAOB 的重要组成成分,这与Cao 等[30]研究相似,Proteobacteria也是作为填料ANAMMOX 系统中的重要菌群.有研究[31]表明,随着AnAOB 的快速生长和富集,代谢产物将被分泌并释放到液体中,这可以作为不同类型异养细菌的有机碳源,强化异养细菌的快速生长,促进Proteobacteria 相对丰度的提升,进一步佐证了在ANAMMOX 装置添加nZVI@BC 载体能够提升相关微生物的相对丰度.

图5 微生物群落结构分析Fig.5 Analysis of microbial community structure
对ANAMMOX 装置在菌属水平上的菌群结构进行分析,结果如图5(b)所示.根据已有研究[7]可知,Candidatus_Jettenia、Candidatus_Brocadia和Candidatus_Kuenenia是最常见的AnAOB.根据本次污泥测序结果可知,属于AnAOB 菌属的是Candidatus_Kuenenia和Candidatus_Jettenia.Candidatus_Kuenenia在R1装置中其相对丰度由8.48%减至7.49%,而在R2装置中其相对丰度由8.48%增至23.76%,这表明在ANAMMOX 装置中添加nZVI@BC 载体能够大幅提升AnAOB 属Candidatus_Kuenenia的相对丰度;同时,Candidatus_Kuenenia具有更高的底物亲和力及更大的环境耐受性,说明投加的nZVI@BC 载体对上述微生物的底物亲和力及环境耐受性增强.另外,nZVI@BC 载体生物膜表面微生物的相对丰度要高于BC 载体生物膜表面微生物的相对丰度,这表明nZVI@BC 载体能够提升AnAOB 属的相对丰度.反硝化菌属Denitratisoma在R1和R2装置中的相对丰度由10.57%分别变为19.36%和17.38%,根据已有的研究[32]表明,Denitratisoma为AnAOB 提供底物,促进其生长,起到协同作用.BC 可以促进Denitratisoma、Candidatus_Kuenenia的相对丰度增加,同时在ANAMMOX 装置中,添加铁离子能够促进AnAOB生长.这表明在ANAMMOX 装置中添加nZVI@BC载体能够提升AnAOB 在Planctomycetes 中的占比,增强ANAMMOX 反应装置的优势菌属.
3 结论
a) nZVI@BC 载体中nZVI 成功镶嵌到BC 的空隙中,增大了载体比表面积,使nZVI@BC 载体具有更好的微生物亲和性.
b) 通过不断的提升进水氮负荷,装置中先出现恶化现象,随后出现ANAMMOX 反应.在ANAMMOX装置中nZVI@BC 载体比BC 载体具有更好的抗冲击性.
c) 本研究中BC 载体和nZVI@BC 载体颜色逐渐变为红褐色,且nZVI@BC 载体富集的AnAOB 量要比BC 载体多,絮凝污泥AnAOB 装置中添加nZVI@BC载体,使装置中部分絮凝污泥聚集形成颗粒状,创造了ANAMMOX 装置中载体生物膜-颗粒污泥的优越条件,提升了颗粒污泥和生物膜系统的协同作用.
d) 微生物群落分析结果表明,经过20 d 的富集,BC、nZVI@BC 载体生物膜中主要的AnAOB 菌属是Candidatus_Kuenenia.nZVI@BC 载体生物膜中AnAOB 的相对丰度明显高于BC 载体,nZVI@BC 载体的添加能够有效促进AnAOB 的富集.
e) 本实验是采用模拟废水进行富集,为AnAOB的富集创造了理想条件,但今后进一步的研究中可以采用真实废水进行富集,使AnAOB 适应实际情况,为规模化、工程化做相应的准备.
