镉胁迫对忍冬抗氧化酶活性及内源激素含量的影响
2024-05-04张吉斯吕琳琳刁全平
贾 莲,张 冬,张吉斯,吕琳琳,刁全平
(1.鞍山师范学院 化学与生命科学学院,辽宁省天然产物活性分子开发及利用重点实验室,辽宁 鞍山 114007;2.北方测盟测试技术(辽宁)有限公司,沈阳 110042)
随着采矿、冶金以及其他工业的迅猛发展,我国土壤中镉(Cd)污染日益严重。Cd 在土壤中具有很强的迁移性,极易被植物吸收、转移和积累,并通过食物链进入人体,对人类健康造成威胁[1]。当植物根系吸收的Cd 超过其所能承受的阈值时,就会导致氧化应激、光合系统受损、细胞损伤以及植物信号物质(激素和钙离子)失衡等,从而抑制生长发育甚至死亡[2-5]。植物对Cd 的耐受程度、耐受范围表现出差异性,一般来说具有富集特性的植物与普通植物相比对Cd 具有更强的耐性,这主要与植物体内复杂的防御反应机制有关。抗氧化系统是植物受逆境胁迫时抵抗不良影响的重要机制[6-8],植物通过体内的抗氧化酶类如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)以及抗坏血酸过氧化物酶(APX)等协同作用来清除Cd 胁迫产生的活性氧自由基,从而保证植物的正常生长。这些抗氧化酶在抵抗Cd 导致氧化胁迫中的作用已被大量证实,在典型超富集植物龙葵[9]、东南景天[10]、圆锥南芥[11]、滇苦菜[12]等,耐性较强的草本植物如高羊茅[13]、青葙[14]、鸡冠花[15]等,以及一些农作物如玉米[6]、白菜[8]、水稻[16]等都有所报道。但研究发现,不同敏感性植物的抗氧化酶活性对Cd 响应差异很大且尚无规律性可循。
此外,内源激素也是植物在Cd 胁迫中耐受或易感性的重要内源因子[17-19]。Cd 胁迫下,植物内源激素脱落酸(Abscisic acid,ABA)、生长素(Auxin,IAA)、赤霉素(Gibberellin,GA)、细胞分裂素(Cytokinin,CTK)以及乙烯(Ethylene,ET)的含量和平衡会发生一系列变化,从而调控其生长发育来应对胁迫环境[20-21]。有研究显示,Cd 能诱导大麦根系积累ABA,提高ABA 在植物中的分布,导致气孔关闭抑制蒸腾流,从而限制Cd 向地上部枝叶的运输[18];短期轻度Cd(10 μmol/L)胁迫诱导大麦根尖中IAA含量增加,随着处理时间延长,IAA 含量降低,IAA含量的变化参与调控根系生长的重新定向和激活防御反应[22]。邓金群等[23]研究表明超富集植物东南景天(Sedumalfredii)体内IAA、GA、玉米素核苷(Zeatin riboside,ZR)和ABA 含量对Cd 胁迫具有快速响应的特征,其中IAA 和GA 对耐受和积累Cd 有重要作用。Yan 等[24]研究发现,Cd 胁迫下甘蓝型油菜(BrassicanapusL.)叶片中ABA 含量升高,ZR含量降低,使ABA/ZR 增加,其抗Cd 能力与激素水平及其平衡有关。植物体的生命代谢是多种内在因素共同协作的结果,在受到逆境胁迫时,植物体内酶和激素都会发生变化,产生防御胁迫的适应能力。研究Cd 胁迫下植物体内抗氧化酶活性以及内源激素水平的变化,对了解植物耐性机理具有非常重要的意义。
忍冬(LonicerajaponicaThunb.),又名金银花,忍冬科忍冬属半常绿缠绕藤本植物,具有生物量大、生长快、根系发达、适应性强、对土壤要求不严格等特点,是一种优良的垂直绿化植物[25]。刘周莉等[26]研究发现忍冬对Cd 具有较强的耐性和超富集能力,且由于其生长快、生物量高,可以弥补现有超富集植物生物量低、生长缓慢等缺陷,可作为应用于城市Cd 污染土壤植物修复的优势绿化植物。目前,关于Cd 胁迫下超富集植物忍冬的抗氧化酶活性变化的研究较少,且研究表明不同超富集植物的抗氧化防御系统对Cd 的响应差异很大。内源激素在调节植物应对Cd 胁迫中具有重要的作用,但Cd胁迫下忍冬体内激素含量的变化也未见报道。本研究以超富集植物忍冬为材料,研究Cd 胁迫下叶片抗氧化酶活性与内源激素含量的变化特点,并分析其相关性,以期为进一步了解超富集植物对土壤Cd 污染忍耐和富集机制提供科学依据。
1 材料与方法
1.1 试验材料
植物材料为忍冬(LonicerajaponicaThunb.)两年生植株,购自山东省临沂市平邑县,在鞍山师范学院化学与生命科学学院育苗室进行预培养。培养条件为恒温25 ℃,每天进行14 h 光照和10 h 黑暗处理。
1.2 方法
1.2.1 Cd 胁迫处理方法
供试土壤采自鞍山师范学院内园圃0~20 cm的表层土,土壤类型为棕壤,基本理化性质为:pH 7.0,有机质含量为18.56 g/kg,硝态氮含量为1.44 mg/kg,有效磷含量为140.3 mg/kg,有效钾含量为82.13 mg/kg,全Cd 含量为0.85 mg/kg。试验共设定7 个处理,每个处理3 次重复(每盆3 株植物作为一次重复),所设定的添加Cd2+浓度梯度为:0(对照CK)、2.5、5、10、25、50 和100 mg/kg。土壤经自然风干后,过4 mm 筛,分装在直径为20.0 cm、深为15 cm 的塑料花盆中,每盆装土3.0 kg。污染物以CdCl2·2.5H2O 配成对应浓度的溶液,一次性添加到土壤中,充分混匀,并用去离子水调节土壤湿度至田间持水量(WHC)的70%。待土壤平衡4 周后,选取经过预培养4 周的生长健壮、长势一致的忍冬幼苗,修剪成株高为23~25 cm,保留2~3 条分枝移栽至盆中,每盆3 株。经Cd 处理60 d 后,收获植物材料进行相关指标测定。
1.2.2 生物量测定
将植株从土壤中取出,自来水冲洗干净后,吸水纸吸干其表面水分,将根系与地上部分开,每株幼苗选取从顶到根部的第3~4 片完全展开的功能叶,用锡箔纸包裹液氮冷冻后,-80 ℃冰箱保存,供酶活性、内源激素含量等指标的测定,其余部分放入烘箱,105 ℃杀青30 min,80 ℃烘至恒重,称量其生物量。
1.2.3 抗氧化酶活性及丙二醛(MDA)含量测定
粗酶液提取参考邹琦[27]的方法并稍作修改。称取叶片0.2 g 于研钵中,液氮研磨成粉末状,加入预冷的50 mmol/L、pH 7.8 的磷酸缓冲液(内含0.1 mmol/L EDTA 和1%聚乙烯吡咯烷酮),加入少量石英砂,在冰浴中研磨成匀浆,定容到5 mL 离心管中,于13 000×g 低温离心30 min,上清液备用分析。SOD 活性采用氮蓝四唑(NBT)光化还原法测定,以抑制NBT 还原的50%为一个酶活力单位(U);CAT活性采用过氧化氢还原法测定,以每分钟内吸光值减少0.01 为一个酶活力单位(U);POD 活性采用愈创木酚法测定,以每分钟内吸光值变化0.01 为一个酶活力单位(U);APX 活性测定参照Krivosheeva等[28]的方法测定,计算单位时间抗化血酸(ASA)减少量即APX 活性;采用硫代巴比妥酸(TBA)法测定MDA 含量。
1.2.4 内源激素含量测定
内源激素提取参考Hou 等[29]的方法。称取植物叶片1 g(精确到0.1 mg),液氮研磨成粉末状,加入预冷的80%甲醇(20 mL)低温弱光下研磨成匀浆,保鲜膜密封,置4 ℃冰箱中过夜浸提(12 h 以上,避光)。提取液低温离心(20 min,5 000 r/min)后,收集上清液至150 mL 旋蒸瓶中,加10 mL 80%甲醇润洗离心管,残渣再次浸提后离心,合并上清液,40 ℃减压蒸发至没有甲醇残留(大概浓缩至原体积1/3),剩余水相完全转移到50 mL 试管中,用等体积石油醚萃取脱色3 次,弃去醚层后,加入0.1 g聚乙烯聚吡咯烷酮(PVPP)吸附酚类物质,常温下摇床振荡30 min,过滤弃去PVPP,滤液用2 mol/L柠檬酸调节至pH=3,再用等体积乙酸乙酯萃取3次,合并酯相到旋蒸瓶中,于40 ℃减压浓缩至干,用2 mL 80%的甲醇冲洗蒸发瓶3 次,溶解液过Sep-Pak18 小柱纯化,甲醇洗脱后减压蒸干,用50%甲醇溶解定容至2 mL,经0.22 μm 超微有机滤膜过滤,滤液备用分析。
采用Wters Alliance 2695 高效液相色谱仪进样测定IAA、GA3和ABA 含量,色谱柱为C18 反相柱(4.6 mm,250 mm,5 μm,Waters),流动相为甲醇:1%乙酸(45 ∶55),流速为1 mL/min,UV 254 nm 紫外检测;外标法定量,内源激素的标准品购于Sigma公司,根据内源激素标准曲线换算忍冬叶片内源激素含量,每个处理重复测定3 次。
1.3 数据处理和分析
采用Excel 2007 进行数据处理并作图,SPSS 19.0 统计软件进行方差分析,不同处理之间的差异显著性用Duncan's 法进行比较;采用Pearson 相关性检验分析相关性。
2 结果与分析
2.1 镉胁迫对忍冬植株生物量的影响
由表1 可知,随着Cd 处理浓度升高,忍冬植株地下部和地上部生物量均呈现先增加后降低的趋势,尤其是在2.5 mg/kg Cd 处理浓度时地下部生物量比对照显著增加了20.93%(P<0.05),表明低浓度Cd 处理对植株生长产生一定程度的刺激效应。Cd 处理浓度在5 和10 mg/kg 时,Cd 对忍冬地上部和地下部生物量均没有产生显著的影响(P>0.05);当Cd 浓度超过25 mg/kg 时,地下部和地上部生物量显著降低(P<0.05),最多降低了28.78% 和40.92%,表明高浓度Cd 胁迫对忍冬植株生长产生了明显的抑制效应。从整个培养周期来看,高浓度Cd(>25 mg/kg)处理下,忍冬全株生物量下降,但未出现叶片变黄、坏死的现象,仍能维持生长。

表1 镉胁迫对忍冬幼苗生物量的影响Table 1 Effects of Cd stress on the biomass of L. japonica seedlings
2.2 镉胁迫对忍冬叶片抗氧化系统的影响
由表2 可知,随着Cd 处理浓度增加,忍冬叶片中SOD 活性均显著高于对照,在Cd 添加量为100 mg/kg 时活性最高,比对照增加了164.00%;POD活性在Cd 添加量为50 和100 mg/kg 时显著高于对照,其余处理与对照相比差异不显著(P>0.05);CAT 活性呈先升后降趋势,在2.5 和5 mg/kg Cd 处理时显著高于对照(P<0.05),在50 和100 mg/kg Cd 处理时显著降低(P<0.05);APX 活性在各处理间差异均不显著(P>0.05)。在各Cd 处理浓度下,忍冬叶片中MDA 含量与对照相比均没有显著差异(P>0.05),表明忍冬植株没有受到明显的过氧化损伤。
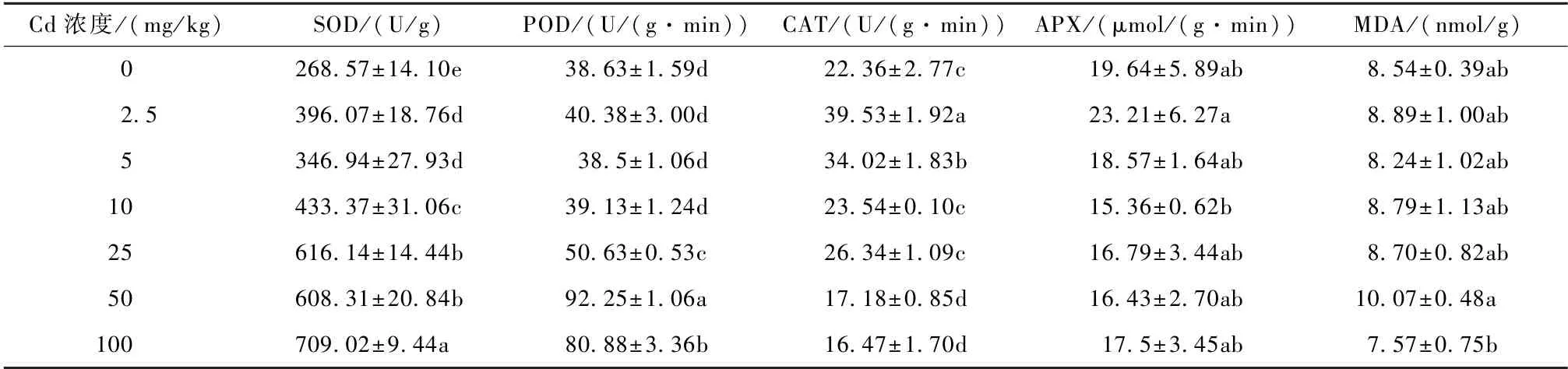
表2 镉胁迫对忍冬叶片中抗氧化酶活性及MDA 含量的影响Table 2 Effects of Cd stress on antioxidant enzyme activities and the content of MDA in the leaves of L. japonica
2.3 镉胁迫对忍冬叶片内源激素含量影响
如图1 所示,随Cd 处理浓度增加,忍冬叶片中GA3和IAA 含量均呈现先升高后降低趋势,当Cd添加量为2.5 mg/kg 时,GA3和IAA 含量达到最大值(P<0.05),分别比对照组增加了25.14% 和51.95%;当Cd 添加量为50 和100 mg/kg 时,IAA含量显著低于对照(P<0.05),降低了12.33%和24.12%;当Cd 添加量为25、50 和100 mg/kg 时,GA3含量比对照组显著降低了29.58%、35.01%和34.30%。由此可见,不同浓度Cd 处理对忍冬叶片中的生长促进型激素表现出了低浓度下的刺激效应和高浓度下的抑制效应。而忍冬叶片中ABA 含量随着Cd 处理浓度增加呈现逐渐升高的趋势,当Cd 浓度超过10 mg/kg 时,ABA 含量显著升 高(P<0.05),达到最大值时比对照增加了55.88%,表明中高浓度Cd 处理对忍冬植株的生长发育产生了一定的毒性效应。
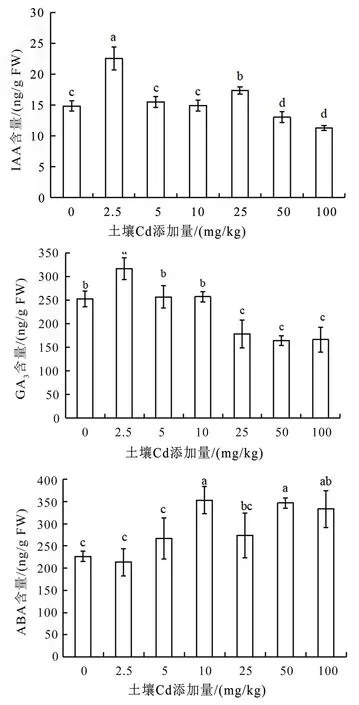
图1 镉胁迫对忍冬叶片中内源激素含量的影响Fig.1 Effects of Cd stress on endogenous hormones content in the leaves of L. japonica
2.4 镉胁迫对忍冬叶片内源激素比值的影响
如图2 所示,随着Cd 处理浓度增加,GA3/ABA和IAA/ABA 的值均呈现先上升后下降的趋势,当Cd 添加量为2.5 mg/kg 时,GA3/ABA 和IAA/ABA显著高于对照(P<0.05),比值分别为1.49 和0.11,比对照增加了33.84%和62.04%,表明低浓度Cd胁迫的刺激效应使植株调节自身保护机制,GA3和IAA 含量显著增加,此时ABA 的合成略有下降,体内激素水平有利于其生长,这与植株的生长发育状况一致。当Cd 添加量为10~100 mg/kg 时,GA3/ABA 的值急剧下降,比值分别为0.731、0.678、0.475 和 0.509,与对照相比降低34.48%~57.47%;当Cd 添加量为10、50 和100 mg/kg 时,IAA/ABA 比值分别为0.042、0.038 和0.034,与对照相比下降35.52%~48.17%,表明高浓度Cd 胁迫下GA3和IAA 含量急剧降低,且ABA 含量积累速度快,对忍冬植株的生长产生了胁迫效应,生理上已有较明显的抵抗性反应。
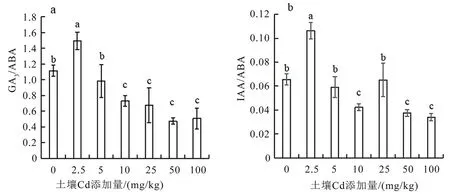
图2 镉胁迫对忍冬叶片中内源激素比值的影响Fig.2 Effects of Cd stress on the ratio of endogenous hormones in the leaves of L. japonica
2.5 镉胁迫下忍冬叶片抗氧化酶活性与内源激素含量相关性分析
由表3 可知,Cd 胁迫下,忍冬叶片中SOD 活性与POD 活性呈极显著正相关(P<0.01),与ABA 含量呈显著正相关(P<0.05);SOD 活性与CAT 活性呈显著负相关(P<0.05),与GA3含量呈极显著负相关(P<0.01)。POD 活性与ABA 含量呈极显著正相关(P<0.01),与CAT 活性和GA3含量呈极显著负相关(P<0.01),与IAA 含量呈显著负相关(P<0.05)。CAT 活性与APX 活性呈显著正相关(P<0.05),与IAA 含量和GA3含量均呈极显著正相关(P<0.01),与ABA 含量呈极显著负相关(P<0.01)。APX 活性与IAA、GA3和ABA 含量均无显著相关性。IAA 和GA3含量呈极显著正相关(P<0.01),且均与ABA含量呈显著负相关(P<0.05)。综上,忍冬叶片中抗氧化酶SOD 或POD 活性与促进生长型内源激素GA3含量存在显著负相关关系,与抑制生长型激素ABA 含量存在显著正相关关系;而CAT 活性则与IAA 和GA3含量存在显著正相关关系,与ABA 存在显著负相关关系。

表3 镉胁迫下忍冬叶片抗氧化酶活性与内源激素含量相关性分析Table 3 Correlation analysis between antioxidant enzyme activity and endogenous hormones in the leaves of L. japonica
3 讨论
重金属Cd 是土壤环境中生物毒性最强的污染元素之一,极易被植物吸收,但并不是植物生长所必需的元素。研究表明,Cd 对植物的生长表现出低浓度促进、高浓度抑制的双相剂量效应[13,26]。本实验结果表明,随着Cd 添加量的增加,忍冬植株生物量先升高后降低,这与许多超富集植物的变化规律相似[11,30]。低浓度Cd 对植物生长表现出一定程度的刺激效应,但产生刺激效应的剂量浓度存在差异。本实验条件下添加2.5 mg/kg Cd 显著的促进了忍冬生物量的积累,低于10 mg/kg Cd 处理下忍冬生物量没有受到抑制,高于25 mg/kg Cd 时,生物量随Cd 添加量的升高而下降,说明忍冬对中低浓度Cd(<10 mg/kg)的耐性很强,具备应用于中低浓度Cd 污染土壤修复的优势。
Cd 毒害的重要机制之一是诱导植物生成大量的活性氧,活性氧的过量积累导致膜脂过氧化,严重时则会造成植物细胞的大量死亡[4]。MDA 是膜脂质过氧化的最终产物,可反映脂质过氧化和细胞膜损伤程度[31]。本研究发现,各Cd 胁迫处理对忍冬叶片中MDA 含量没有显著影响,表明Cd 胁迫没有导致忍冬受到明显的过氧化损伤,其保持膜稳定性的能力较强。这与Kahli 等[32]对滨藜属植物(AtriplexL.)响应Cd 胁迫的研究结果一致,该研究认为植物能够通过激活抗氧化防御机制来中和产生的过量活性氧,从而恢复细胞的稳态。当植物受到重金属胁迫时,植物细胞可以通过刺激抗氧化防御系统中的抗氧化酶活性来抵御氧化损伤,因此抗氧化酶活性的高低可在一定程度上反映植物对重金属的耐受能力。SOD 在植物体内是清除活性氧的第一道防线,能将植物细胞中的氧自由基转变为氧化作用相对较弱的H2O2;POD 和CAT 进一步将H2O2转化成H2O 和O2[21,33]。在本研究中,随着Cd处理浓度增加,忍冬叶片中SOD 和POD 活性显著升高,尤其在高浓度Cd(50 和100 mg/kg)处理下其活性比对照组高出2 倍以上,表明这两种酶在各Cd胁迫处理下同时起作用来去除活性氧,SOD 和POD活性的增加意味着积累的活性氧不足以引起毒性效应,保证了忍冬对Cd 的强耐受性。这与超富集植物滇苦菜对Cd 胁迫的响应结果一致[12]。Shao等[33]的研究表明,耐Cd 性强的植物体内抗氧化酶活性显著提高,而MDA 含量均较低。本研究中,CAT 活性在低浓度Cd 处理(<5 mg/kg)时升高,高浓度Cd 处理(50 和100 mg/kg)时均低于对照,表现出了明显的“低促高抑”剂量效应,而APX 活性在各处理间差异均不显著,这可能与其在清除活性氧自由基中的作用不同有关。
内源激素是植物生长发育的重要调节物质,在受到重金属胁迫时,植物可通过改变内源激素水平来调控适应逆境胁迫时的重要生理过程[17,34]。IAA和GA3是调控植物生长发育的促进型内源激素,Cd胁迫下植物生长受到抑制可能与促进生长型内源激素 IAA 和 GA3含量减少、激素平衡失调有关[22,35]。本研究发现,高浓度Cd 处理(>25 mg/kg)时,忍冬叶片中IAA 和GA3含量显著下降,这可能是Cd 胁迫使IAA 和GA3合成途径遭到破坏所导致,此时植株生物量也显著低于对照,表明高浓度Cd 胁迫下忍冬可能通过降低生长来适应胁迫。低浓度Cd 处理(2.5 mg/kg)时,忍冬叶片中IAA 和GA3含量显著增加,此时植株生物量受到了明显的刺激,表明忍冬在低浓度Cd(2.5 mg/kg)胁迫下可能通过提高IAA 和GA3含量刺激植株的生长。ABA 作为一种胁迫激素,其生理作用主要是抑制生长、促进气孔关闭,从而调节植物对环境胁迫的适应[36]。在本研究中,随着Cd 处理浓度增加,忍冬叶片中ABA 含量逐渐升高,尤其是中高浓度Cd 处理(>10 mg/kg)时,ABA 含量均显著高于对照,此时主要以抑制生长和提高抗性为主,植株生物量显著降低。Cd 胁迫下植株体内ABA 的大量积累,可以诱导抗性基因的转录、调节气孔关闭保持水分平衡,从而减少根对Cd 的直接吸收,降低组织中Cd 的浓度,限制潜在的Cd 毒性[37-38]。
在逆境胁迫条件下,施加植物激素能够增加抗氧化酶活性、改变内源激素含量,从而来维持植物的正常生长发育[39]。有研究发现,外源GA3浸泡处理可以显著提高盐胁迫下植物种子萌发期的SOD、POD 和CAT 活性[40]。本研究中相关性分析表明,叶片中内源激素GA3含量与抗氧化酶CAT 活性呈极显著正相关,低浓度Cd 处理(2.5 mg/kg)诱导了忍冬叶片中GA3含量的显著增加,由此推测低浓度Cd 胁迫下忍冬叶片中GA3含量的增加刺激了CAT活性,从而提高植株对Cd 胁迫的适应性。Cd 胁迫下ABA 可以提高植物体内抗氧化酶基因的表达,增加抗氧化酶活性,从而增强清除活性氧的能力[41]。本研究中,忍冬叶片中内源激素ABA 含量与抗氧化酶SOD、POD 活性呈显著正相关,这也是高浓度Cd胁迫下忍冬叶片抗氧化酶SOD 和POD 活性升高的重要原因。
此外,植物在受到Cd 胁迫时,内源激素平衡被打破,IAA、GA3和ABA 的比值更能反映胁迫条件下植物的响应策略[24]。本研究中,随着Cd 处理浓度增加,忍冬叶片的GA3/ABA 和IAA/ABA 呈现先升高后降低趋势,尤其是在低浓度 Cd 处理(2.5 mg/kg)时,其比值显著高于对照,说明忍冬在低浓度Cd 胁迫下通过调控激素平衡来刺激或维持一定量的地上地下生长及细胞分裂;中高浓度Cd处理(>10 mg/kg)时,GA3/ABA 和IAA/ABA 显 著低于对照,此时植物调节自身分泌更多的ABA 来增强抗逆性,减慢细胞分裂速度,抑制生长发育来尽可能抵御Cd 毒害。
4 结论
1)Cd 胁迫对忍冬生物量产生“低浓度刺激、高浓度抑制”的效应,2.5 mg/kg Cd 处理时,忍冬植株地下部生物量显著增加,高于25 mg/kg Cd 时地下部和地上部生物量均显著降低。忍冬对中低浓度Cd(<10 mg/kg)的耐性很强,具备应用于中低浓度Cd 污染土壤修复的优势。
2)在各Cd 胁迫处理下,忍冬叶片中MDA 含量没有受到显著影响;随Cd 处理浓度增加,叶片SOD和POD 活性增强,CAT 活性先升高后下降,APX 活性在各处理间差异均不显著;结果表明Cd 胁迫下,忍冬没有受到明显过氧化损伤,其保持膜稳定性的能力较强。
3)低浓度Cd 胁迫下,忍冬叶片中CAT 活性、GA3和IAA 含量增加,GA3/ABA 和IAA/ABA 升高,进而刺激了植株生物量的增加;高浓度Cd 胁迫下,IAA 和GA3含量降低,ABA 含量增加,SOD 和POD活性增加,抑制生长应对逆境。
4)不同抗氧化酶与内源激素间存在着直接或间接的相关作用,随着Cd 胁迫处理浓度增加,超富集植物忍冬体内保持着较强的抗氧化酶活性,同时在叶片中大量累积参与抗逆作用的ABA 来调节植物对Cd 的耐受性,这些措施可能是超富集植物忍冬抵御Cd 胁迫的重要保护机制。
