结核病mRNA疫苗的研制策略与展望
2024-04-30杨静肖丽娟方谭玮
杨静 肖丽娟 方谭玮
结核病仍然是严重危害人类健康的重大传染病,据世界卫生组织(World Health Organization,WHO)报告,2022年估算全球约有1060万例新发结核病患者,达到了WHO在全球范围监测结核病以来的最高水平;同时,我国估计结核病发病患者数为74.8万例,位列全球第三[1]。随着全球结核病合并AIDS患者数的增加和耐药结核病的出现,结核病防控形势更加严峻[2]。预防传染性疾病最有效且经济的手段是接种有效的疫苗。目前,卡介苗(bacillus Calmette-Guérin vaccine, BCG)是唯一广泛使用的预防结核病疫苗,对预防儿童结核病,尤其是严重类型的结核病如结核性脑膜炎、粟粒性肺结核等,具有较好的保护效果,但对成人结核病的保护效果不甚理想[3]。因此,研发结核病新型疫苗对于结核病防控具有重要意义。
目前,全球对结核病新疫苗开展了大量的研究,包括基因重组亚单位疫苗、DNA疫苗、病毒载体疫苗、重组BCG疫苗、减毒活疫苗和mRNA疫苗等类型[4],并有16种新型结核病疫苗处于临床试验阶段[5],但至今仍未能获得可以替代传统BCG的更为有效的结核病新型疫苗。其中,mRNA疫苗以其研发周期短、高效、安全和生产成本低等独特的技术优势和保护效果,成为新型疫苗研究的热点[6],在疫苗研发领域得到了广泛的开展。2023年4月,WHO召集结核病相关领域专家进行了基于mRNA疫苗平台的结核病新型疫苗研发的讨论,认为利用mRNA 疫苗技术平台开展结核病新型疫苗的研发,可能会加速更为有效的结核病新疫苗的研制成功[7]。但结核病mRNA(TB-mRNA)疫苗的研发目前还处于起步阶段,相关研究还较少,因此,笔者主要就mRNA疫苗的技术原理、优势、制备技术,以及结核病mRNA疫苗的研制策略和现状等方面,如TB-mRNA疫苗靶抗原的选择及序列优化、转录后的修饰和疫苗的接种途径等进行综述,以期为TB-mRNA 疫苗的研制提供新的思路。
一、mRNA疫苗的技术原理和优势
1990年,Wolff等[8]报道将裸mRNA注射到小鼠骨骼肌内使其表达目的编码蛋白,开启了新型mRNA疫苗的研究。随着mRNA修饰技术和递送载体的突破,克服了mRNA易被核糖核酸酶降解、固有免疫原性和细胞内递送效率低等缺点[9],使得mRNA疫苗技术得到了快速发展,展现出强大的应用前景。
mRNA疫苗的主要原理是根据目标靶抗原设计相应的基因序列,在体外转录合成特定抗原的mRNA,经修饰、纯化、包载后,再由载体递送系统介导mRNA进入细胞质中,利用机体细胞的蛋白质合成系统翻译出编码的目的蛋白抗原,并将其水解成小分子肽,再通过与主要组织相容性复合体Ⅰ类(MHC-Ⅰ)和MHC-Ⅱ类分子结合,诱导机体产生特异性CD8+和CD4+T细胞免疫反应,达到预防和治疗特定病原体感染的目的[10]。随着技术创新的发展,为进一步增强疫苗的免疫效能,在mRNA疫苗设计中,选取某种佐剂蛋白的编码序列,利用连接多肽(linker polypeptide)将与靶抗原的编码序列相连接构建mRNA疫苗[11]。其中,最关键的是有效免疫保护的靶抗原选择[12],最核心的技术是mRNA 的分子优化和递送系统,而佐剂的选择和免疫途径等则会影响免疫效果[13]。
目前的mRNA疫苗主要有自我扩增型(self-amplifying)、非复制型(non-replicating)和环状mRNA疫苗[14]。其中,自我扩增型mRNA编码靶抗原,并编码复制酶复合物,使疫苗RNA在细胞内扩增并增强蛋白质表达;而非复制型mRNA疫苗仅编码靶抗原,含有5′和3′非翻译区(untranslated region,UTR),可全面刺激适应性和先天免疫[15]。环状RNA(circRNA)是一类具有头尾共价连接拓扑结构的单链RNA,而结合内部核糖体进入位点(IRES)和开放阅读框(ORF)的环状RNA疫苗提供了一种改进的RNA疫苗的接种方法,具有安全性、稳定性、制造简单性和可扩展性的特点。人工circRNA已成为一类新型疫苗,用于疾病的治疗和预防,然而,circRNA疫苗的开发尚处于早期阶段,其优化、交付和应用还有待进一步开发和评估[16]。
作为创新技术的mRNA疫苗,具有以下独特的优势:(1)可诱导机体产生体液和细胞全面的免疫应答。(2)具有自佐剂效应,一些mRNA本身可刺激免疫细胞分泌某些细胞因子,如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-12、IL-1β和α/β-干扰素(IFN)等,特异性诱导免疫应答发挥其免疫增强作用[17]。(3)安全性好。mRNA无CpG岛,仅需进入细胞质中便可发挥作用,避免了DNA核酸疫苗插入细胞基因组而发生潜在生物安全风险[12, 18-19]。(4)mRNA理论上可以编码所有蛋白,具有广适性,还可以通过优化mRNA序列增加编码蛋白的免疫原性[17]。(5)mRNA在体内存留时间短,可通过正常细胞代谢迅速降解,对机体造成的毒性风险相对较小[12, 18-19]。(6)mRNA生产纯化过程大体相似,生产流程通用性高。因此,研究一种可用于大多数mRNA疫苗生产的流程,可大量减少生产成本[12]。
二、mRNA疫苗的制备技术
mRNA疫苗的制备技术大致分为4步[19]:(1)根据靶抗原的基因序列进行序列设计。(2)RNA体外转录及转录后修饰。将靶抗原序列整合到质粒DNA中,利用噬菌体(如T7、T3、Sp6等)的RNA聚合酶在体外转录mRNA,对转录后的mRNA进行5′端加帽、3′端加尾和去磷酸化。(3)mRNA纯化。通过色谱法去除双链RNA、mRNA不完全转录本等杂质。(4)包载。用脂质纳米颗粒或其他递送载体包裹纯化的mRNA,并通过透析或过滤法进行纯化。
三、TB-mRNA疫苗的研制策略
1. TB-mRNA疫苗靶抗原的选择及序列优化:结核分枝杆菌(Mycobacteriumtuberculosis, MTB)的蛋白抗原种类多样,既有大量的分泌性蛋白,也有丰富的菌体蛋白,还有一些传统疫苗BCG中不含有的差异蛋白[14-15, 20-21]。此外,在体内形成的MTB休眠菌,还会特异性转录表达一组休眠相关蛋白抗原[22]。既往结核病疫苗研究结果显示,只有包含不同阶段、不同类别的MTB蛋白抗原,才能够刺激机体产生全面的抗MTB的保护性免疫[23]。因此,选择多种有效的抗感染免疫的蛋白抗原组合作为疫苗的靶抗原,并保证多个蛋白的免疫原性和协同增强作用,是TB-mRNA疫苗设计的关键。
mRNA技术能够通过改变核酸序列来不断优化编码抗原,从而提高编码抗原的稳定性或增强其免疫原性[20]。密码子优化是其中较常用的优化方法。编码靶抗原的原始密码子在体内可合成氨基酸,一部分密码子的翻译效率不高,可以用宿主细胞中使用频率高的同义密码子去替换外源mRNA序列中的密码子,但需保证外源mRNA序列中的密码子和宿主细胞的密码子使用偏向性更加契合,以避免出现稀有密码子[24]。有研究表明,将第3位是A、U的密码子替换为G、C的密码子,发现降低U密码子的含量可降低mRNA在体内的免疫原性,但可提高所使用密码子的翻译水平[25]。
优化靶抗原编码序列还可以通过突变氨基酸来增强靶抗原的稳定性和免疫原性[20]。MTB是原核生物,其密码子与人体真核细胞密码子在使用偏好上有所不同[26],因此,需要TB-mRNA疫苗编码靶抗原的核酸序列进行优化,提高其在人体细胞中的翻译和表达效率。
2. mRNA的转录后修饰:为保持和发挥同体内自然mRNA一致的效应,且使mRNA更加稳定,应保持体外转录(invitrotranscribed, IVT)mRNA(IVT-mRNA)与体内mRNA的结构一致[27]。因此,TB-mRNA疫苗在体外转录后,IVT-mRNA应添加5′Cap结构、5′UTR和3′UTR及3′聚腺苷酸(Poly A)尾(图1),并在此基础上,对IVT-mRNA进行适当优化,可提高IVT-mRNA的稳定性与翻译效率,从而获得更好的免疫效果[28]。
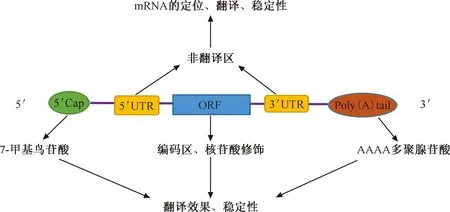
注 5′Cap:5′帽子结构;5′UTR:5′非翻译区;ORF:开放读码框架;3′UTR:3′非翻译区;Poly(A)tail:聚腺苷酸(A)尾
3. mRNA疫苗的递送系统:mRNA疫苗必须进入细胞质内才能发挥作用。只有低于1000 Da的分子才能被动扩散进入细胞膜,而细胞膜表面的磷脂双分子层具有负电荷,mRNA疫苗的裸mRNA也具有负电荷,因此,需要搭配一定的阳离子载体来介导mRNA疫苗进入细胞质[13, 27]。
mRNA的递送载体可分为病毒载体和非病毒载体[29]。常见的病毒载体有腺病毒、甲型肝炎病毒、麻疹病毒等,在将其毒性和复制能力去除后可以作为递送mRNA的载体,但由于体内免疫系统会识别进入机体的病原体并进行消灭,从而影响注入机体的mRNA疫苗的翻译效率,减小其疫苗作用[27]。常见的非病毒载体包括脂质体和阳离子纳米乳等。其中,脂质体是目前最先进的递送系统,其主要由阳离子脂质体和其他辅助脂质体组成,可以将mRNA包封在内核中,避免了mRNA被降解[30];同时,阳离子脂质体与负离子细胞膜静电吸附后与细胞膜融合,可帮助mRNA进入细胞质,完成mRNA的递送[13];另外,阳离子肽鱼精蛋白和聚合物载体如聚酰胺、聚β氨基酯及聚乙烯亚胺等也可用于mRNA的递送,但由于这些物质与mRNA的结合比较紧密,影响了mRNA的表达效率,使其使用率较低[13, 31]。目前,也有一些其他载体用于mRNA疫苗的递送,如胶原蛋白海绵和胞外囊泡等,但均处于初始研究阶段[32]。
4. mRNA疫苗的接种途径:目前,疫苗的接种途径包括皮内、皮下、肌肉、静脉和黏膜等方式。几种一般的生物分布概况和作用机制与特定的给药途径有关,不同接种途径会影响有效的抗原摄取,抗原提呈细胞(APC)的分子活化和独特的生物分布对于疫苗靶抗原引起的特异性免疫应答的强弱和保护力均会不同[33]。而且,相关研究表明,应根据具体疫苗选择其有效的免疫接种方式,如新型冠状病毒感染的两种mRNA疫苗,成人采用肌肉注射方式,而乙型病毒性肝炎mRNA疫苗则以皮下注射的免疫效果更好[34]。MTB主要通过呼吸道感染,呼吸道黏膜免疫系统是机体抵御MTB感染的第一道防线,黏膜免疫是理想的结核病疫苗的免疫途径[3]。因此,设计TB-mRNA疫苗是否适合黏膜免疫,是否能够刺激机体呼吸道黏膜免疫系统产生抗MTB的特异性免疫应答,在很大程度上可以反映TB-mRNA疫苗的高效性。
四、TB-mRNA疫苗的研究现状
目前,针对TB-mRNA疫苗研究的报道还很少。Shahrear和Islam[11]以MTB PstS1蛋白为目标抗原,设计了一种假想的TB-mRNA疫苗(MT.P495)。通过免疫信息学方法对PstS1蛋白进行T细胞表位[包括辅助T细胞(Th细胞)和细胞毒性T淋巴细胞(CTL)细胞表位]和B细胞表位预测,再采用免疫学方法筛选出免疫显性表位作为mRNA的靶抗原,利用人β-球蛋白基因的5′UTR和兔β-球蛋白基因的3′UTR进行结构修饰,同时,以MTB的S核糖体蛋白L7/L12蛋白作为佐剂,利用连接多肽将佐剂蛋白与靶抗原的编码序列相连接(图2),进一步通过调整GC含量、计算稀有密码子的翻译效率和减少不寻常的串联序列等方法对mRNA的序列进行整合优化,以提高mRNA在宿主细胞内的翻译效率,并增加mRNA二级结构的稳定性。研究还采用计算机预测和免疫生物学的方法对该假想mRNA疫苗进行评估,结果表明该mRNA 疫苗编码的T细胞抗原表位能够较好地与MHC分子相识别并结合,所形成的复合物也具有良好的稳定性;B细胞表位也具有较高的保守性、抗原性、非过敏原和非毒性。二者均具有较强的免疫刺激能力,能够刺激不同亚类抗体和细胞因子(如IgG1、IgG2和IgM)及IFN-γ的产生。另外,研究也利用C-ImmSim服务器进行免疫模拟,结果表明该mRNA疫苗编码抗原在初次和第二次免疫后,均可产生强烈的免疫应答,刺激高水平的IgM抗体生成。但在第二次和第三次免疫刺激中,随着IgM抗体水平的降低,IgG抗体水平逐渐升高,表明该抗原可以刺激免疫记忆的产生,包括Th和细胞毒性T细胞(Tc细胞)的免疫记忆。进一步的抗原暴露预测分析表明,诱生的免疫记忆在再次接触抗原后,能够产生高水平的IFN-γ和高比例的Th细胞。综上,抗原表位多肽疫苗能以最小的抗原编码序列来获得足够的免疫原性,而且还能够减少靶抗原内其他抗原表位引起免疫抑制等不良免疫应答现象,表明基于抗原表位多肽的mRNA疫苗,其安全性和翻译效率都能够得到更好的保障。
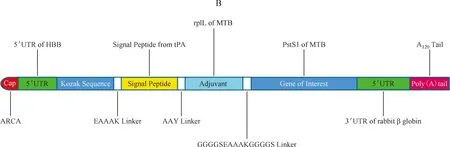
注 Cap:帽子结构;ARCA:抗反向帽类似物;5′UTR:5′非翻译区;5′UTR of HBB:人β-球蛋白基因的5′非翻译区;Kozak Sequence:Kozak序列;EAAAK Linker:EAAAK连接器;Signal Peptide:信号肽;Signal Peptide from tPA: 来自组织型纤溶酶原激活物(tPA)的信号肽;AAY Linker:AAY连接器;Adjuvant:佐剂;GGGGSEAAAKGGGGS Linker: GGGGSEAAAKGGGGS连接器;rpIL of MTB: 结核分枝杆菌的rpIL(50S核糖体蛋白L7/L12);Gene of Interest: 感兴趣基因;Pst1 of MTB:结核分枝杆菌Pst1蛋白;3′UTR:3′非翻译区;3′UTR of rabbit β globin:兔β-球蛋白基因的3′非翻译区;Poly(A)tail:聚腺苷酸(A)尾;A120 tail: A120尾
国内夏敏等[34]结合人更常用的密码子组合、高GC含量和mRNA二级结构等3个因素设计了MTB抗原Ag85B的mRNA序列,利用β球蛋白的UTR、PolyA及假尿苷等修饰方法进行优化,能够成功地在体外转录出稳定的mRNA,优化后的Ag85B-mRNA的半衰期明显延长。采用鱼精蛋白与mRNA 1∶1混合后,免疫小鼠,结果显示,利用鱼精蛋白递送该mRNA,无论是滴鼻免疫,还是肌肉注射免疫,均可在小鼠体内引起细胞免疫,刺激机体产生IFN-γ,但效果不明显。该研究也提示,单纯优化序列还不能够使mRNA产生强效的免疫效果,还需进一步优化mRNA的免疫原性及其递送系统。
近期,WHO报道德国BioNTech公司已研发了两种TB-mRNA疫苗——BNT164a1和BNT164b1,但目前这两种疫苗均处于对疫苗的安全性和免疫原性进行评价的临床Ⅰa期试验阶段[35],作为进展最快的TB-mRNA疫苗,引起极大关注。然而,由于商业原因,目前还难以获得更多疫苗的相关信息。另外,我国目前也有一些科研团队在对TB-mRNA疫苗进行研究,且这些研究主要集中在关键抗原的选择上,并在与生物企业密切合作的基础上积极推进成果转化。目前,筛选出的保护性抗原配合优化的脂质纳米颗粒(LNP)递送载体制备的TB-mRNA候选疫苗,已取得一定的阶段性成果[36]。
五、展望
mRNA疫苗在其他传染病疫苗研究中已取得良好进展,如呼吸道合胞病毒、寨卡病毒和流感病毒等的mRNA疫苗已进入临床试验阶段[37]。在当前传统技术研制新型结核病疫苗的艰难时期,mRNA疫苗的研制技术为结核病新型疫苗的研制带来了希望。然而,明确有效的结核病疫苗靶抗原和有效免疫保护的评价指标一直是传统结核病新型疫苗研发的难题,也将是TB-mRNA疫苗的评价和筛选的障碍。此外,虽然现在mRNA的分子优化和递送系统已经获得了很大进步,但mRNA疫苗仍然面临着免疫原性、稳定性和高效递送等方面的挑战。所以,如何在mRNA疫苗设计时更好地激发靶抗原的免疫原性、降低mRNA分子的固有免疫、提高mRNA分子的稳定性和翻译效率等,将是TB-mRNA疫苗研发时需要重点解决的问题。尽管目前TB-mRNA疫苗的研发面临着巨大的挑战,但随着抗结核保护性免疫的深入阐明,mRNA疫苗研发技术的不断提高,TB-mRNA疫苗终将成为结核病新型疫苗研发的重要方向,并有希望获得更为有效的新型结核病疫苗,为终结结核病流行,保护人类健康提供新的有效手段。
利益冲突所有作者均声明不存在利益冲突
作者贡献杨静和肖丽娟:文献检索和撰写文章;方谭玮:设计文章框架、修改和审校
