江苏葫芦科作物上瓜类褪绿黄化病毒的发生及其分离物全基因组序列分析
2024-04-30杨柳任春梅陆芳缪倩程兆榜季英华
杨柳 任春梅 陆芳 缪倩 程兆榜 季英华
摘要:為了分析瓜类褪绿黄化病毒(cucurbit chlorotic yellow virus,CCYV)在江苏省葫芦科作物上的分布情况、发生趋势以及变异情况,本研究对疑似感染CCYV的葫芦科样本进行采集,覆盖了江苏省8个地区的7种常见葫芦科作物,通过RT-PCR方法对病样进行了分子鉴定,并对在泰州采集的黄瓜分离物CCYV-JSXH进行分段克隆与测序,拼接获得CCYV的全基因组序列后对其进行了序列比对和进化分析。检测结果显示,在建湖采集的西葫芦样本、泰州兴化和南京江宁地区采集的黄瓜样本均有CCYV感染。序列拼接与比对结果显示,分离物CCYV-JSXH的RNA1序列与目前已经公布的各个分离物基因组序列相似度在99.58%以上,在进化树上与山东西葫芦分离物聚为一支;其RNA2序列与各分离株的相似性为99.47%以上,在进化上与广东分离物聚为一支。本研究结果表明,CCYV可能由多个途径传入江苏,并已经扩大蔓延到江苏省多个地区和多种寄主上,对该病毒的监测防控已逐渐扩大为葫芦科作物生产中亟待解决的突出问题之一。
关键词:瓜类褪绿黄化病毒;分布;分子鉴定;基因组;系统进化分析
中图分类号:S436.429 文献标志码:A
文章编号:1002-1302(2024)06-0036-07
收稿日期:2023-04-28
基金项目:国家重点研发计划(编号:2022YFD1401200);江苏省农业科技自主创新资金[编号:CX(19)3108]。
作者简介:杨柳(1984—),女,江苏徐州人,博士,助理研究员,主要从事蔬菜作物病毒病研究。E-mail:suiyangy@126.com。
通信作者:季英华,研究员,主要从事蔬菜病毒病研究。E-mail:jiyinghua@jaas.ac.cn。
瓜类褪绿黄化病毒(cucurbit chlorotic yellows virus,CCYV)属于长形病毒科(Closteroviridae)毛形病毒属(Crinivirus)。它最早于2009年在日本甜瓜上被发现[1],随后在许多国家都有报道,包括苏丹、黎巴嫩、伊朗、希腊、土耳其、沙特阿拉伯、塞浦路斯、以色列、美国、阿尔及利亚、西班牙、韩国和印度等[2-14]。2010年,CCYV于我国台湾地区首次被发现[15],而后在山东、北京、上海、河南、湖南、广西、乃至海南、新疆和贵州等省份逐渐被报道,并且其危害地区还在不断扩大[16-25]。
CCYV是烟粉虱以半持久方式进行传播的,在自然情况下主要感染葫芦科作物,目前已经报道的以甜瓜、西瓜、黄瓜、南瓜、西葫芦等常见作物居多,但室内试验显示该病毒能够侵染19种葫芦科作物[1]。此外CCYV 还可以侵染本氏烟、甜菜、紫花苜蓿、曼陀罗等植物,Orfanidou等明确了13种杂草为CCYV的寄主[6],庄新建等报道CCYV可以感染药用作物地黄[26],韦建明等报道CCYV可以感染山药[25]。这些结果表明,CCYV的寄主范围也在不断扩大。
被CCYV感染的植株在早期会出现中部或基部叶片的褪绿黄化,而后逐步向上发展逐渐蔓延至植株顶部,叶片最初呈现褪绿症状,随着病情发展,叶片黄化,同时仍能看见保持绿色的叶脉等局部组织,最后导致整个植株黄化,在大田生产中严重影响了葫芦科作物的产量和产品品质,已逐渐扩大为葫芦科作物生产中亟待解决的突出问题之一[27]。
CCYV的基因组由2条正单链RNA (RNA1和RNA2)组成,其中RNA1约 8 607 nt,可编码甲基磷酸转移酶、依赖RNA的病毒解旋酶、依赖 RNA 的 RNA 聚合酶,P6-1蛋白和P22 蛋白;RNA2约 8 041 nt,可编码外壳蛋白、小外壳蛋白、70 ku 类热激蛋白、P59蛋白、P26蛋白、P9蛋白、P6-2蛋白和P4.9蛋白。在病毒的侵染、复制和传播过程中,这些蛋白都发挥了重要的功能[23]。
江苏地区的设施蔬菜和露地蔬菜在我国蔬菜生产中均占有重要地位,但病毒病的发生也一直威胁着省内蔬菜产业的发展,根据目前已有报道,在我国许多葫芦科作物种植区都出现了CCYV的感染,但在江苏地区尚未有针对性的报道。笔者所在课题组于2022年在江苏省内针对葫芦科作物CCYV感染进行了普查,并对在主要感染区(泰州兴化)采集的CCYV分离物进行了全基因组序列分析。
1 材料与方法
1.1 病原材料
2022年6—11月在江苏省多个葫芦科作物生产地采集到各种葫芦科作物疑似病毒病感染样品,主要为植株叶片,少部分为果实,症状表现为斑驳、褪绿、黄化、皱缩、畸形等。需要保存的样品经液氮速冻存于-80 ℃冰箱。
1.2 RNA提取和cDNA的合成
取0.5 g病叶样品,如果是病果则切取果皮部分,于液氮中充分研磨成粉末,使用多糖多酚植物RNA试剂盒(上海浦迪生物科技有限公司)按说明书步骤操作提取RNA。而后取2 μL RNA使用HiScriptⅡ Q RT SuperMix试剂盒(南京诺唯赞生物科技股份有限公司)按说明书步骤反转录成cDNA,用于PCR和克隆。
1.3 PCR检测分析
采用引物CCYV-dtF (5′-AGAACATGATCAAGTCGTGAGTC-3′)和CCYV-dtR (5′-GGTAGGAATGAACTCAGTGTCVG-3′)对反转录后的病样cDNA进行PCR扩增。扩增体系为2×Taq Master mix(南京诺唯赞生物科技股份有限公司)12.5 μL,前后引物各0.5 μL,模板cDNA 1 μL,ddH2O补足至 25 μL。反应程序:94 ℃预变性2 min;94 ℃变性 20 s,55 ℃退火20 s,72 ℃延伸1 min,30个循环后再 72 ℃ 延伸5 min。若电泳后在约792 bp处出现目的条带则将PCR产物送至南京擎科生物科技有限公司进行序列测定。
1.4 CCYV基因组序列克隆与测序
根据干射香等设计的引物[28]分段扩增并通过拼接获得CCYV1和CCYV2序列全长。扩增体系:2×phanta PCR mix(南京诺唯赞生物科技股份有限公司)25 μL,前后引物各1 μL,模板cDNA 2 μL,ddH2O补至50 μL。反应程序:94 ℃预变性2 min;94 ℃变性20 s,52 ℃退火20 s,72 ℃延伸2 min 30 s,30个循环;72 ℃延伸10 min。产物经1%的琼脂糖凝胶电泳后,在紫外灯下切取凝胶上的目的条带,使用Axygen胶回收试剂盒(爱思进生物技术有限公司)根据说明书步骤进行回收。回收产物连接至pEASY-Blunt载体(北京全式金生物技术有限公司),转化大肠杆菌感受态细胞DH5α(南京擎科生物科技有限公司),挑取单克隆经PCR筛选后送至南京擎科生物科技有限公司测序。
1.5 序列比对分析
将测序测得的所有序列利用Invitrogen软件里的ContigExpress功能进行拼接获得CCYV1和CCYV2全长序列。比对分析使用NCBI网站的BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)和ClustalX软件,聚类分析和进化树的构建使用MEGA6软件。
2 结果与分析
2.1 江苏省CCYV的发生情况
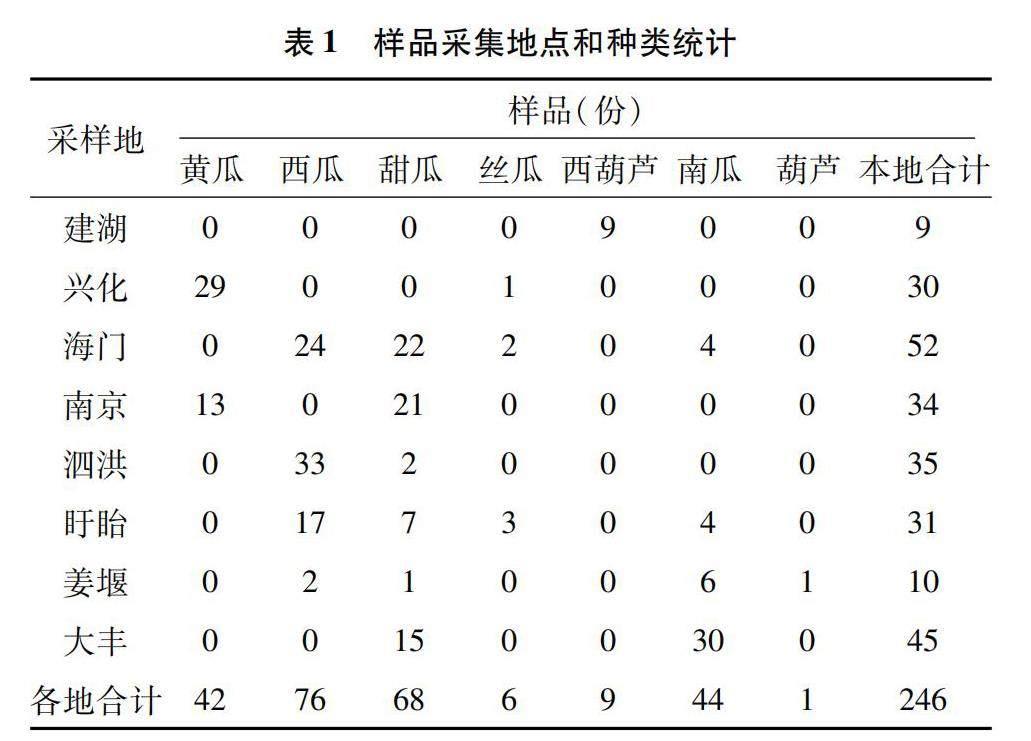
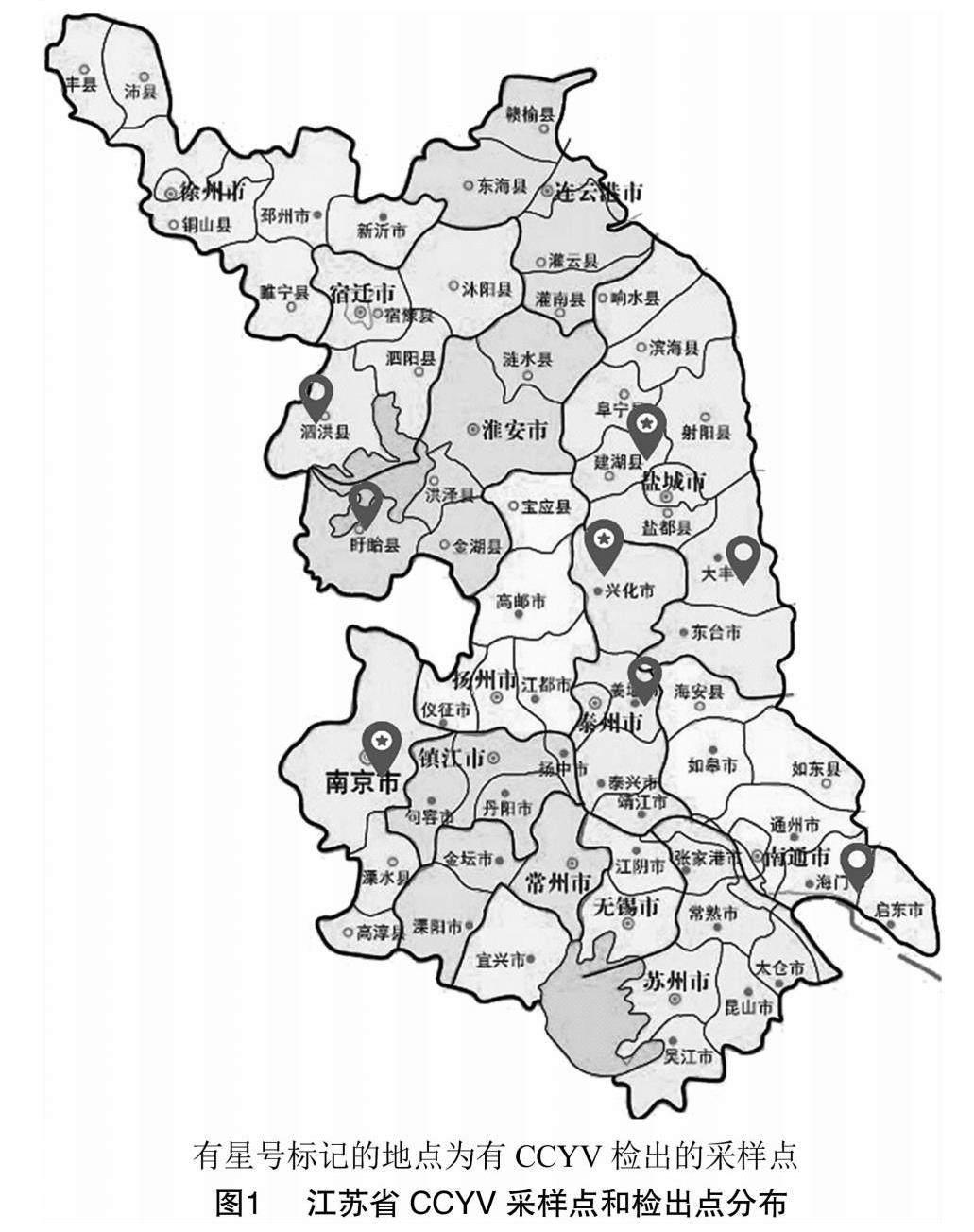
本研究于2022年在江苏省内共采集样本246份,分别来自于8个地区的7种常见葫芦科作物(表1),寄主植物样品大多数来源于种植面积较大的葫芦科作物,如西瓜、甜瓜、南瓜和黄瓜。对所采样品提取RNA,经过RT-PCR检测后发现在建湖、兴化、南京采集的样品中均检测出了CCYV,其他地区样品中均未检出(图1)。在南京江宁采集的21份甜瓜中有3份检出CCYV,13份黄瓜样品中有7份检出,总检出率为29.4%。在兴化采集的30份样品中黄瓜占29份,丝瓜1份,其中包括丝瓜在内的26份样品检出CCYV,检出率为86.7%。在建湖采集的9份西葫芦样品中全部检出CCYV。在全部246份样品中,CCYV总检出率为18.3%。
2.2 CCYV泰州兴化分离物基因组特征分析
采用分段克隆拼接的策略,对CCYV泰州兴化
黄瓜分离物CCYV-JSXH的每条链分别分4段进行克隆,通过软件拼接获得CCYV-JSXH全基因组序列。对CCYV-JSXH序列信息进行分析比对发现,该分离物的RNA1序列全长共计8 607个碱基,包含4个开放阅读框(ORF),其中74~6 034位碱基为ORF1a,编码1个由1 987个氨基酸组成、分子量约226.5 ku的蛋白,6 036~7 553位碱基为ORF1b,编码1个由505个氨基酸组成、分子量约 58.7 ku的蛋白,7 629~7 787位碱基编码1个由52个氨基酸组成、分子量约6.1 ku的蛋白 P6,7 791~8 357位碱基编码1个由188个氨基酸组成、分子量约22.1 ku的蛋白P22,5′UTR和 3′UTR 的长度分别为73 nt和250 nt。
RNA2序列全长共计8 041个碱基,编码8个蛋白,其中1 035~1 166位碱基编码由43个氨基酸组成、分子量约4.9 ku的蛋白P4.9,1 207~2 877位碱基编码由556个氨基酸组成、分子量约62.4 ku的蛋白HSP70h,2 878~3 042位碱基编码1个由54个氨基酸组成、分子量约6.6的蛋白P6,3 036~4 589 位碱基编码由517个氨基酸组成、分子量约59.7 ku的蛋白P59,4 571~4 810 位碱基编码由79个氨基酸组成、分子量约9.3 ku的蛋白P9,4 941~5 693位碱基编码由250个氨基酸组成、分子量约28.7 ku的蛋白CP,5 693~7 117位堿基编码由474个氨基酸组成、分子量约54.5 ku的蛋白CPm,7 179~7 820位碱基编码由213个氨基酸组成、分子量约24.9 ku的蛋白P26,5′UTR和3′UTR的长度分别为1 034 nt和221 nt。
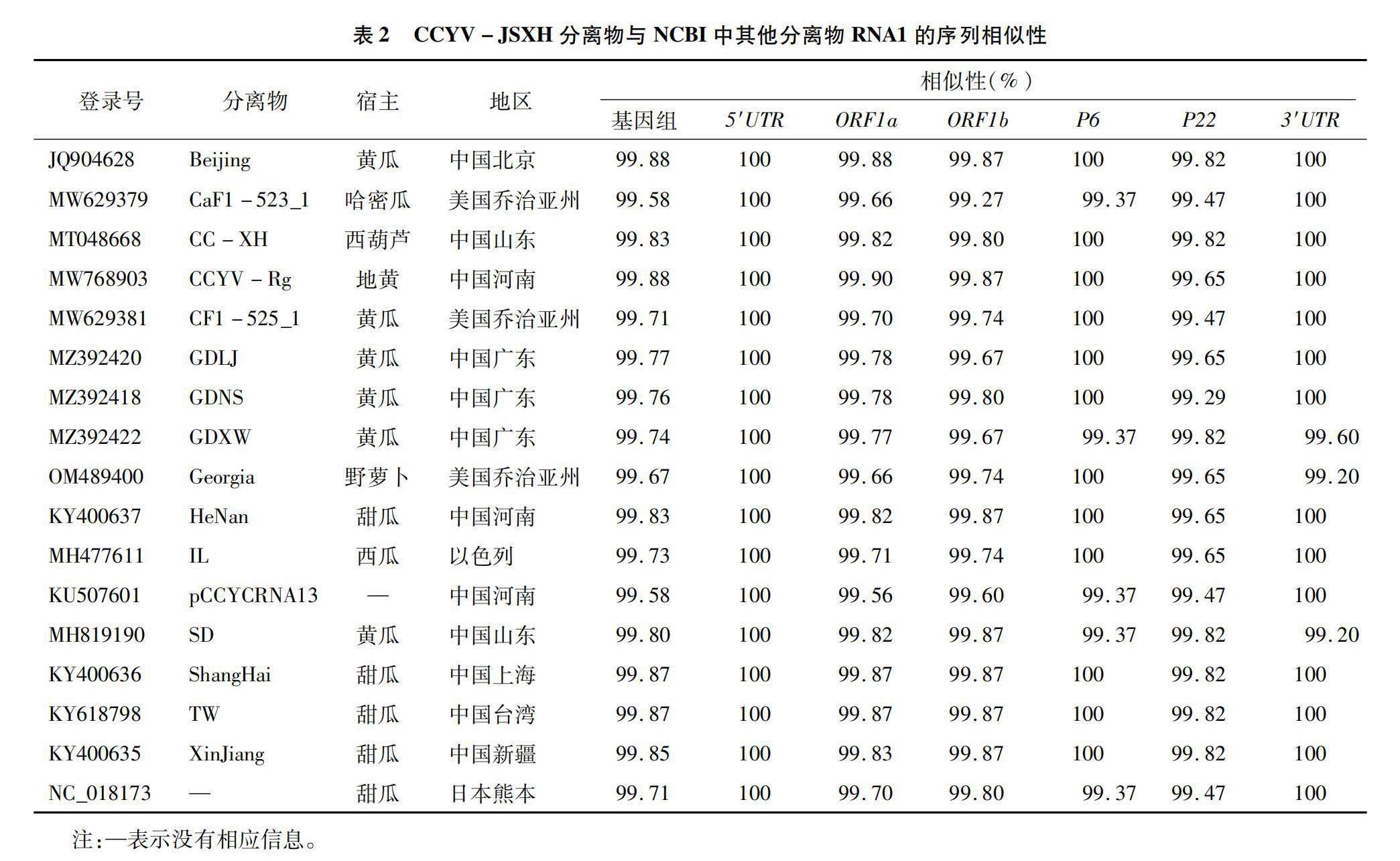
BLAST分析结果表明,CCYV-JSXH的RNA1序列与目前已经公布的各个分离物基因组序列的相似度在99.58%以上,其中与北京分离物JQ904628和河南分离物MW768903的相似度最高,序列一致性达99.88%。但CCYV-JSXH RNA1的各编码基因和非编码序列与已知CCYV分离物的各序列相似度不完全一致,其中5′UTR、3′UTR和 P6基因序列保守性较高,大多数分离物的相似性为100%,碱基变化较多存在于ORF1a、ORF1b 和P22基因上,它们的一致性在99.27%~99.90%之间(表2)。
CCYV-JSXH的RNA2序列与目前已公布的分离物基因组序列相似度在99.47%以上,其中与广东分离物GDLJ(MZ392421)相似度最高,序列一致性达99.80%。CCYV-JSXH RNA2的各编码基因和非编码序列与已知CCYV分离物的各序列相似度也不完全一致,其中P4.9、P6、P9和 3′UTR序列保守性较高,许多分离物的相似性高达100%,而5′UTR、HSP70h、 P59、CP、CPm和P26上的变异较多,其一致性在99.09%~99.94%之间(表3)。
将本研究获得的分离物CCYV-JSXH与已经公布的和其一致性较高的3个分离物(JQ904628、MW768903、MZ392420)的序列进行比较分析。结果(表4)显示,这4个分离物中共有51个位点存在碱基变化,RNA1中有21个差异碱基位点,RNA2中有30个。JSXH与其他3个分离物均不相同的位点有23个,RNA1中8个,RNA2中15个。RNA1上的差异碱基位点共有13个为同义突变,8个位点为错义突变;RNA2上有9个位点为同义突变,12个错义突变,另外还有9个突变位点处于RNA2的UTR区域。错义突变存在的位置分别位于ORF1a、ORF1b、P22、HSP70h、CP、CPm和P26上。
將NCBI中有全基因组序列报道的CCYV RNA1和RNA2序列分别使用邻接法(neighbor-joining,NJ)进行聚类分析,将毛形病毒属成员莴苣褪绿病毒(LCV)(NC012909)作为外群,进化树分支置信度(Bootstrap)使用1 000次自导复制验证,由此构建的Bootstrapconsensustree结果(图2)显示,CCYV-JSXH与其他CCYV分离物聚在一起,表明该分离物确实为CCYV成员之一。根据RNA1序列的系统进化树拓扑结构分析可以看出CCYV-JSXH与山东分离物CC-XH聚为一支(图2-A),说明它们之间RNA1亲缘关系较近。但从RNA2序列的系统进化树拓扑结构可以看出CCYV-JSXH与广东分离物GDLJ聚为一支(图2-B),表明这2个分离物的RNA2亲缘关系较近。
3 讨论与结论
CCYV 最初在2009年被发现,后来在世界许多国家的葫芦科作物上均有发生报道,近些年来出现越来越多的报道,2010年该病毒在我国台湾地区被发现,而后在多个省市陆续被发现。刘放等调查发现湖南省南瓜CCYV检出率呈上升趋势,并且对CCYV分离物的CP基因进行选择压力和中性检测分析,结果显示,我国种群受到正向选择压力或多样化选择作用,其种群多态性较低,正处于扩张趋势,但从世界范围来看,CCYV维持相对稳定状态[21]。本研究团队在前期研究普查中,曾于2019年在山东寿光的黄瓜上发现CCYV感染[29],后于2019—2020年在江苏7个地区的7种葫芦科作物调查中发现丰县、睢宁、南京、苏州采集的样品中出现该病毒,感染寄主有黄瓜、西瓜和甜瓜,总感染率为6.64%[30],这是首次在江苏省境内发现CCYV的侵染。2022年在对南京市、泰州市姜堰区和另外6个地区进行葫芦科作物调研的过程中,又发现了该病毒的侵染,除了黄瓜和甜瓜外,丝瓜和西葫芦也检出CCYV,本次样品CCYV总检出率为18.3%。该病毒在江苏省内的传播可能也呈现逐渐扩大的趋势。
烟粉虱的流行暴发本身就会给蔬菜产业造成损失,而且烟粉虱又可以同时携带多种病毒,再加上它们食性繁杂、寄主广泛,这就给相关病毒的扩
展蔓延提供了很多机会[31]。走访调查发现该病毒病的暴发时间与烟粉虱的暴发时间相吻合,条件适宜的温室环境下随时可能暴发;而露地作物在 8—10 月期间也有可能集中暴发。不仅烟粉虱向周边地区的扩散会造成病毒的蔓延,蔬菜作物和种子的贸易往来等也会造成病毒长距离的传播[32]。图2为分别基于NCBI中不同CCYV分离物的RNA1和RNA2全序列分析构建的系统进化树,该类型的进化树是很多次Bootstrap得到的平均结果。从图2可以看出,无论是RNA1还是RNA2,来自国外的分离物(美国分离物、日本分离物和以色列分离物)都聚在一个大分支上,这说明CCYV的进化具有一定的地域性。在国内分离物中,江苏分离物JSXH的RNA1与山东分离物CC-XH亲缘关系最近,但是其RNA2却与广东分离物GDLJ亲缘关系最近,这可能意味着该病毒通过多种途径传入江苏,并在不同毒株之间发生了复制重组。
实验室条件下发现该病毒能感染19种葫芦科作物,本研究在葫芦科作物集中生产地采集的黄瓜、甜瓜、丝瓜和西葫芦上均发现了该病毒,这说明该病毒在自然状态下确实可以感染多种作物导致生产问题。目前已有报道该病毒在自然情况下侵染西甜瓜、西葫芦、黄瓜等多种葫芦科作物,其中CCYV感染丝瓜还未有详细报道。因此该病毒是葫芦科作物生产中的巨大威胁。还有研究报道其能感染13种杂草,这更加大了该病毒的防控难度,在生产中不仅要注意作物本身的防控还要注意田边杂草的管理。此外,相似度和系统进化分析发现来源于同一寄主的分离物并没有聚在一起(图2),表明该病毒的进化不受寄主的影响。
参考文献:
[1]Okuda M,Okazaki S,Yamasaki S,et al. Host range and complete genome sequence of cucurbit chlorotic yellows virus,a new member of the genus Crinivirus[J]. Phytopathology,2010,100(6):560-566.
[2]Hamed K,Menzel W,Dafalla G,et al. First report of cucurbit chlorotic yellows virus infecting muskmelon and cucumber in Sudan[J]. Plant Disease,2011,95(10):1321.
[3]Abrahamian P E,Sobh H,Abou-Jawdah Y. First report of cucurbit chlorotic yellows virus on cucumber in Lebanon[J]. Plant Disease,2012,96(11):1704.
[4]Bananej K,Menzel W,Kianfar N,et al. First report of cucurbit chlorotic yellows virus Infecting cucumber,melon,and squash in Iran[J]. Plant Disease,2013,97(7):1005.
[5]Orfanidou C,Maliogka V I,Katis N I. First report of cucurbit chlorotic yellows virus in cucumber,melon,and watermelon in Greece[J]. Plant Disease,2014,98(10):1446.
[6]Orfanidou C G,Cara M,Merkuri J,et al. First report of cucurbit aphid-borne yellows virus in cucumber in Albania[J]. Journal of Plant Pathology,2023,105(1):367-368.
[7]Al-Saleh M A,Al-Shahwan I M,Amer M A,et al. First report of cucurbit chlorotic yellows virus in cucumber in Saudi Arabia[J]. Plant Disease,2015,99(5):734.
[8]Orfanidou C G,Papayiannis L C,Pappi P G,et al. Criniviruses associated with cucurbit yellows disease in Greece and Cyprus:an ever-changing scene[J]. Plant Pathology,2019,68(4):764-774.
[9]Luria N,Smith E,Sela N,et al. Insights into a watermelon virome contribute to monitoring distribution of whitefly-borne viruses[J]. Phytobiomes Journal,2019,3(1):61-70.
[10]Jailani A K,Iriarte F,Hochmuth R,et al. First report of cucurbit chlorotic yellows virus affecting watermelon in USA[J]. Plant Disease,2021,106(2):774.
[11]Kheireddine A,Sáez C,Sifres A,et al. First report of cucurbit chlorotic yellows virus infecting cucumber and zucchini in Algeria[J]. Plant Disease,2020,104(4):1264.
[12]Chynoweth R,Jimenez D,Liberti D,et al. First report of cucurbit chlorotic yellows virus infecting cucumber plants in Spain[J]. Plant Disease,2021,105(8):2258.
[13]Kwak H R,Byun H S,Choi H S,et al. First report of cucurbit chlorotic yellows virus infecting cucumber in South Korea[J]. Plant Disease,2021,105(6):1862.
[14]Kumar A,Rout B M,Choudhary S,et al. First report of cucurbit chlorotic yellows virus infecting pumpkin in India[J]. Plant Disease,2022,106(6):1767.
[15]Huang L H,Tseng H H,Li J T,et al. First report of cucurbit chlorotic yellows virus infecting cucurbits in Taiwan[J]. Plant Disease,2010,94(9):1168.
[16]Gu Q S,Liu Y H,Wang Y H,et al. First report of cucurbit chlorotic yellows virus in cucumber,melon,and watermelon in China[J]. Plant Disease,2011,95(1):73.
[17]孫晓辉,赵静,代惠洁,等. 瓜类褪绿黄化病毒在山东省的流行调查及西葫芦分离物全基因组扩增与序列分析[J]. 植物病理学报,2023,53(3):375-385.
[18]臧连毅,孙晓辉,苏文敏,等. 瓜类褪绿黄化病毒山东分离物全基因组序列扩增及分析[J]. 植物保护学报,2019,46(6):1195-1202.
[19]刘珊珊,彭斌,吴会杰,等. 海南省和河南省发生甜瓜褪绿黄化病的分子鉴定[J]. 果树学报,2013,30(2):291-293.
[20]唐鑫,张德咏,李凡,等. 瓜类褪绿黄化病毒(cucurbit chlorotic yellows virus)在湖南省的首次报道及其流行动态研究[J]. 植物病理学报,2017,47(4):573-576.
[21]刘放,刘勇,张德咏,等. 瓜类褪绿黄化病毒自然侵染南瓜及分子进化分析[J]. 植物病理学报,2021,51(1):1-10.
[22]杨世安,李战彪,秦碧霞,等. 广西三种甜瓜病毒分离物的分子检测与鉴定[J]. 植物保护,2017,43(3):83-89,102.
[23]彭斌,刘莉铭,刘珊珊,等. 瓜类褪绿黄化病毒新疆分离物基因组分析[J]. 植物病理学报,2017,47(6):730-737.
[24]潘卫萍,张以和,吉艳玲. 吐鲁番首次发生甜瓜褪绿黄化病毒病[J]. 蔬菜,2017(2):60-61.
[25]韦建明,岳宁波,李云洲. 贵州首次报道瓜类褪绿黄化病毒侵染山药[J]. 植物病理学报,2023,53(3):550-552.
[26]庄新建,郭枭,丁诗文,等. 河南温县地黄上瓜类褪绿黄化病毒的鉴定及其CP序列分析[J]. 植物病理学报,2022,52(2):296-300.
[27]古勤生,彭斌,刘珊珊,等. 瓜类新病毒病害(一):瓜类褪绿黄化病[J]. 中国瓜菜,2011,24(3):32-33,71.
[28]干射香. CCYV山东黄瓜分离物基因组结构特征及致病相关蛋白研究[D]. 荆州:长江大学,2021.
[29]干射香,涂丽琴,吴淑华,等. 山东寿光黄瓜上瓜类褪绿黄化病毒的分子鉴定[J]. 江苏农业学报,2019,35(5):1047-1053.
[30]杨柳,况佳颖,任春梅,等. 江苏省主要葫芦科作物病毒种类及分布[J]. 江苏农业学报,2022,38(1):65-72.
[31]Legg J P,Shirima R,Tajebe L S,et al. Biology and management of Bemisia whitefly vectors of cassava virus pandemics in Africa[J]. Pest Management Science,2014,70(10):1446-1453.
[32]Dinsdale A,Cook L,Riginos C,et al. Refined global analysis of Bemisia tabaci(Hemiptera:Sternorrhyncha:Aleyrodoidea:Aleyrodidae) mitochondrial cytochrome oxidase 1 to identify species level genetic boundaries[J]. Annals of the Entomological Society of America,2010,103(2):196-208.
