基于网络药理学方法探讨杞蓉片治疗早发性卵巢功能不全的作用机制*
2024-04-29南楠杜小利
南楠,杜小利
1 宁夏医科大学,宁夏 银川 750000; 2 宁夏区域高发病中西医结合防治研究重点实验室,宁夏 银川 750000; 3 宁夏少数民族医药现代化教育部重点实验室,宁夏 银川 750000
早发性卵巢功能不全(premature ovarian insufficiency,POI)指女性在40岁以前出现卵巢功能减退,主要表现为月经异常、FSH水平升高、雌激素波动性下降[1],发病率1%~4%[2]。杞蓉片在临床上广泛用于治疗月经病和不孕症,但其治疗POI的机制尚不清楚。本研究应用网络药理学分析方法,通过构建药物与疾病的靶蛋白互作关系,探索杞蓉片对卵巢功能的影响,寻求杞蓉片治疗卵巢功能不全的药效理论基出,为临床应用杞蓉片防治POI提供理论依据。
1 资料与方法
1.1 杞蓉片活性成分及靶点的获取 首先对杞蓉片中的9味中药活性成分及作用靶点进行检索。登录中药药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology,TCMSP)(http://tcmspw.com)[3],检索关键词:“锁阳”“肉苁蓉”“淫羊藿”“菟丝子”“枸杞子”“金樱子”“女贞子”“北五味子”和“蛇床子”,将口服生物利用度(oral bioavailability,OB)≥30%和药物相似性(drug likeness,DL)≥0.18,以此来筛选出符合条件的中药活性成分,得到杞蓉片活性成分的ID和靶基因名称等数据。对于未能从TCMSP检索出的药物,先通过中国知网、维普等平台检索其所有活性成分,再通过TCMSP查阅相关活性成分所对应的基因信息。对于未能检索出“Mol ID”的活性成分,通过Pubchem数据库确定所有筛选出来分子的三维结构,然后将Canonical Smile号输入小分子药物靶点预测在线平台,获得上述药物的全部潜在靶点基因。运用Uniprot数据库(http://www.uniprot.org)及Perl(http://www.perl.org/ger.html/)语言脚本进行蛋白基因的转换,剔除非人源基因,删除无效重复靶点,得到标准化的基因名。
1.2 POl疾病靶点的获取 使用关键词“premature ovarian insufficiency”在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、DrugBank(https://go.drugbank.com/)数据库中进行检索,得到POI相关的靶点,将5个数据库所有靶点整合在Excle中,剔除重复基因,并经Uniprot数据库进行校正,得到疾病靶点基因信息。
1.3 构建靶蛋白相互作用网络 登录Venn 2.1.0网站,在LIST1与LIST2中分别输入药物与疾病的靶点,平台自动生成药物与疾病的靶点,绘制出韦恩图(Venn图)。将获得的杞蓉片与POI的共同靶点进行转换后登录STRING平台(https://string-db.org/),选择“homo sapiens”,构建蛋白质相互作用网络(protein-protein interactions,PPI)图。
1.4 GO分析和KEGG通路富集分析 通过Bioconductor(http://www.bio-conductor.org/)数据库进行GO分析和KEGG通路富集分析,使用Cytoscape软件,构建出“药物-活性成分-靶点”网络并分析其核心靶点,利用DAVID6.8 GO基因功能从生物过程(biological process,BP)、细胞成分(cellular component,CC)、分子功能(molecular function,MF)三方面描述杞蓉片治疗POI的作用靶蛋白在基因功能中的作用。选取GO功能条目前10条,KEGG通路条目与POI有关的20条通路(P<0.01)作为杞蓉片治疗POI的主要基因功能富集过程和信号通路,预测杞蓉片治疗POI的作用机制。
2 结果
2.1 杞蓉片的主要活性成分及作用靶点 使用TCMSP数据库分别检索“锁阳”“肉苁蓉”“淫羊藿”“菟丝子”“枸杞子”“金樱子”“女贞子”“北五味子”和“蛇床子”的活性成分,以药动学参数OB≥30%和DL≥0.18为筛选条件,剔除无效成分后,筛选收集到有效成分肉苁蓉6个、淫羊藿21个、菟丝子10个、枸杞子35个、金樱子6个、女贞子8个、五味子7个、蛇床子18个,锁阳经过文献整理后通过Swiss Target Prediction,筛选条件为Probability>0.1,获得11个成分,其中共有成分10个。剔除重复后总共得到药物102个有效成分。见表1。

表1 药物活性成分
2.2 疾病靶点的筛选 合并GeneCards、OMIM、DrugBank数据库分别获得的4411、212、54个靶点,去重后共获得4589个与POI相关的靶点,将得到的基因经UniProt数据库校正。
2.3 韦恩图的绘制 将获得的药物成分靶点与疾病靶点相互映射,然后作Venn图,从而获得交集基因。然后使用Cytoscape 3.8.2软件构建“药物-成分-作用靶点”网络。见图1—2。
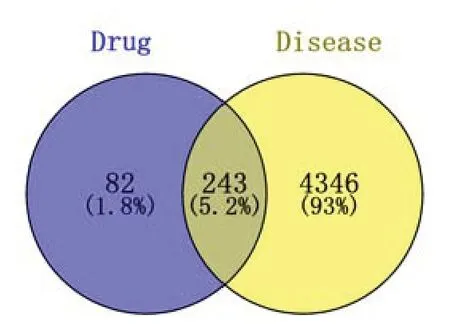
图1 潜在共同靶点Venn图
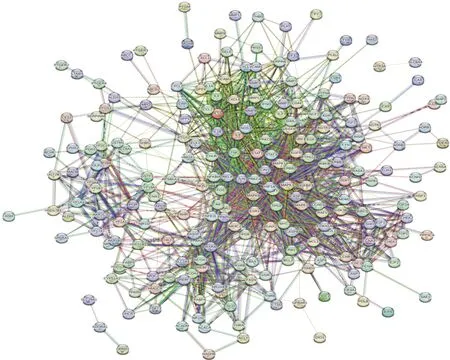
图2 共同靶点蛋白互作PPI网络图
2.4 药物-成分-靶点预测结果 利用药物-成分-靶点数据,构建“network.xlsx”文件以及“type.xlsx”文件,将文件导入Cytoscape 3.8.2进行作图。共有成分为黄色表示。见图3。
2.5 蛋白相互作用网络 使用Cytoscape 3.8.2软件绘制蛋白相互作用网络,对网络进行拓扑分析,以Degree值反映靶点大小及颜色,以combined score值反映边的粗细,从而构建蛋白-蛋白相互作用网络。其中TP53、AKT1、STAT3、TNF、JUN、EGFR、MAPK3、IL-6、MAPK1、VEGFA为核心靶点。见图4。

图4 PPID网络
2.6 GO基因生物过程 将243个交集靶点导入DAVID数据库进行GO富集分析与KEGG通路注释分析,以P-Value<0.01为条件筛选后,我们共得到437个BP,53个CC和93个MF,得到药物作用POI的作用机制可能与细胞凋亡过程、转录的正调控、基因表达的正向调控、信号转导、药物反应、炎症反应、细胞增殖的积极调控等生物过程有关,同时与细胞质、质膜、核、核质、胞质溶胶、胞外间隙等细胞组分参与,涉及蛋白质结合、同蛋白结合、酶结合、锌离子结合、DNA结合、蛋白质二聚化活性、RNA聚合酶Ⅱ转录因子活性等分子功能。见图5。
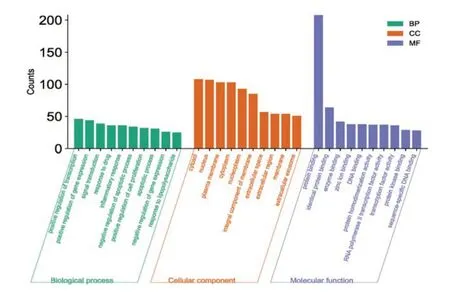
图5 GO分析图
2.7 KEGG通路富集分析 利用DAVID数据库进行通路富集分析,共富集到172条与复方杞蓉片治疗POI相关的通路,根据P<0.01筛选出复方杞蓉片与治疗POI的通路145条,筛选出与POI相关的通路,分别是:PI3K-Akt、HIF-1、高级糖基化终末产物-受体(AGE-RAGE)、白细胞介素17(IL-17)、肿瘤坏死因子(TNF)、C-型凝集素(C-type Lectins)、细胞凋亡、T细胞受体、Th17细胞分化、Toll样受体(TLR)、Janus激酶(JAK)-信号转导和转录激活因子(STAT)、表皮生长因子受体(EGFR)、酪氨酸激酶抑制剂耐药性等通路。见图6。
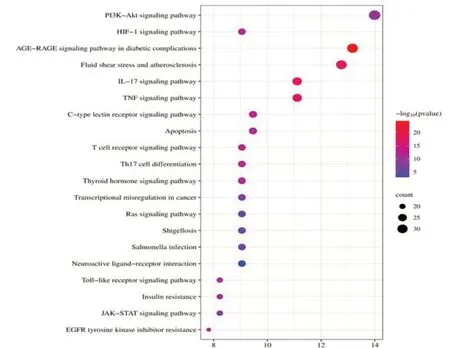
图6 KEGG富集分析图
3 讨论
随着人们对生活质量和女性权益的重视,女性生殖健康越来越受到社会关注。POI属于妇科常见病及疑难病,其病因复杂,有50%以上的患者病因不明[4]。卵巢功能的过早减退严重危害着女性的身心健康,常会引起神经及代谢功能失调[5-7]。根据临床表现,中医学将POI归于月经不调、闭经、胎漏、血枯、经断前后诸症等范畴。肾为先天之本,藏精,主生殖。多数医家认为,POI与肾精亏虚关系密切,在治疗时多以补肾益精为主。杞蓉片由宁夏枸杞子、肉苁蓉、锁阳、淫羊藿、菟丝子、金樱子、蛇床子、女贞子、五味子组成。
随着卵泡的发育,颗粒细胞增殖,会降低卵巢内微环境中的氧分压(PO2)[8]。PO2水平的降低使卵巢组织处于缺氧状态,无法满足卵巢组织或卵细胞的生理需求[9]。持续的缺氧会进一步触发细胞的各种死亡[10-12]。在卵泡发育的过程中,卵巢颗粒细胞作为其营养和能量的来源,发挥着极其重要的作用,缺氧、氧化应激等会诱导卵泡自噬、凋亡和坏死等多种细胞死亡途径,进而导致卵巢功能衰退[13]。调查显示,原发性POI患者的氧化应激水平升高[14]、老年女性颗粒细胞中缺氧特异性基因表达上调[15],说明缺氧是卵巢功能下降的主要机制之一。因此,改善卵母细胞的氧化应激状态,增强卵母细胞的抗氧化能力是恢复POI患者卵巢功能的重要措施之一[16]。
本研究共筛选整理出杞蓉片102个药物活性成分,与POI疾病的共同靶点243个。其中核心蛋白有TP53、MAPK、Akt、STAT3、TNF、EGFR、IL-6、VEGFA等,其中TP53是影响卵巢功能的重要因子之一[17]。研究显示,化疗药物介导的卵巢颗粒细胞中的TP53基因表达明显升高[18]。MAPK能够诱导其下游效应因子P53的激活,从而促进TP53介导的细胞凋亡[19]。蛋白激酶(AKT1)磷酸化能够提高POI模型小鼠的生育能力,因为它可以促进卵巢中次级卵泡的生长速度,增强卵巢分泌性激素的功能[20-22]。STAT3可以调节细胞的增殖、凋亡等,在多种疾病中已被证实[23]。TNF在卵巢中的表达随着机体的衰老而增多[24]。TNF既可以诱导炎症,促进细胞的凋亡与分化,又可促进细胞存活和增殖,其不同的效应应该与组织类型、含量、作用时间等有关[25]。研究发现,EGFR基因能够调控细胞自噬和代谢[26]。ERBB2 mRNA在原始卵泡启动的生长过程中呈现出阳性表达,在原始卵泡启动生长中起重要的促进作用[27-28]。卵巢局部产生的IL-6可能是颗粒黄体细胞分化和激素分泌的卵巢内调节环节之一,以旁/自分泌的形式在局部调节卵巢功能[29]。血管内皮生长因子A(VEGFA)能够改善卵巢内的血液供应状态,进而修复受损的组织[30]。
由“药物-活性成分-靶点网络图”可见,染料木素、槲皮素、芹菜素、β-谷固醇等化合物在杞蓉片治疗POI中有重要意义。染料木素具有抗氧化、抗癌、抗炎作用及抗菌活性。研究表明,染料木素可延迟大鼠卵巢寿命的衰竭,维持卵细胞的功能和稳态[31]。槲皮素可通过调节体内谷胱甘肽的含量,氧化应激相关酶的活性及氧化应激信号传导通路来发挥抗氧化活性[32]。芹菜素可通过抑制PI3K/Akt、激活MAPK等信号通路发挥预防肿瘤、抗菌、抗氧化等作用[33]。β-谷甾醇可通过PI3K/Akt信号通路促进人卵巢颗粒细胞增殖,抑制凋亡[34]。
KEGG通路富集分析结果显示,杞蓉片治疗POI主要涉及PI3K/Akt、HIF-1、AGE-RAGE、IL-17、TNF信号通路等。PI3K/Akt信号通路与细胞增殖、凋亡、侵袭、迁移及自噬等密切相关[35]。研究证实,缺氧状态下PI3K/Akt信号通路会被激活,可能是细胞在缺氧条件下适应和存活的一种机制[36]。HIF-1是低氧环境中的核心因子[37],缺氧条件下HIF-1的合成依赖于P13K/Akt通路。AGERAGE信号通路可激活下游一系列分子反应,从而诱导炎症反应、氧化应激等的产生[38]。TNF与IL-17信号均为炎症相关通路,能够诱发和引起自身免疫性和炎症类型的疾病,从而导致POI的形成[39]。
本研究基于网络药理学,初步探索了杞蓉片治疗POI的潜在作用机制,其中研究结果涉及很多药物的活性成分、药物作用疾病的重要靶基因、疾病的靶基因、药物作用的关键信号通路等,为今后的进一步相关研究提供依据和思路。
