软坚清脉颗粒促进骨髓间充质干细胞迁移的实验研究*
2024-04-29宗媛张永康曹烨民
宗媛,张永康,曹烨民,,马 斌
1 上海中医药大学,上海 201203; 2 上海中医药大学附属上海市中西医结合医院,上海 200082;3 上海交通大学MED-X研究院,上海 202402
动脉硬化闭塞症(arteriosclerosis obliterans,ASO)是一种较为严重的缺血性周围血管疾病,临床上主要表现为肢体局部发凉、怕冷、缺血性静息痛和间歇性跛行,严重的患者肢体发黑或坏死坏疽[1]。针对ASO的西医治疗方法[2-5]主要有:药物治疗、血管腔内治疗、手术治疗,近年来干细胞疗法成为血管类疾病治疗的重要补充。骨髓间充质干细胞是非造血和成纤维细胞样的细胞群体,占骨髓有核细胞的0.001%~0.01%[6]。实验发现BMSCs在合适的体外环境下可以分化为HUVECs[7-8],广泛用于血液系统疾病、循环系统疾病、神经系统疾病及骨科疾病等多种系统疾病的治疗[9]。通过增加迁移至靶器官的BMSCs细胞数量可以提高临床疗效[10]。通过静脉内注射的干细胞在体内示踪显示体内分布特点与其质量、数量、组织类型、损伤程度、血管分布,对损伤和炎症情况有一定的趋向性[11-12]。而植入的干细胞异常衰老持续影响移植效果[13]。既往研究表明,软坚清脉颗粒含药血清可以促进内皮细胞的损伤修复[14],其是否可以促进间充质干细胞增殖与趋化值得深入研究。
1 材料与方法
1.1 实验设计 本实验为体外细胞学实验,2020年3月至10月在上海市中西医结合医院实验动物中心及上海交通大学MED-X研究院完成。
1.2 实验动物 10周龄SPF级雄性SD大鼠40只,体质量约200 g,用于软坚清脉颗粒含药血清的制备。新生两周内SPF级乳鼠10只由上海西普尔-必凯实验动物有限公司提供,实验动物合格证书编号:2018000610995,经上海市实验动物质量检测检验站质检,用于BMSCs细胞的提取。均由上海中医药大学附属上海市中西医结合医院伦理委员会批准,动物饲养于上海中医药大学附属上海市中西医结合医院SPF级动物房。
1.3 细胞株 HUVECs细胞由上海交通大学MEDX研究院高维强课题组馈赠,细胞培养于完全培养基并置于正常培养箱内培养,隔天换液,细胞融合至80%时按1∶3传代,取P3代细胞用于后续实验。
1.4 仪器与设备 D180型CO2培养箱(瑞沃德)、酶标仪(Multiskan™ FC)、-80℃冰箱(Thermo);DW-40W255J型-20 ℃冰箱(中国海尔公司);FACSCanto II型流式细胞仪(BD公司);Optima MAX-XP型超速离心机(美国Beckman公司);1658040型电泳仪(美国Bio-Rad公司);Quant-Studio3型RT-PCR仪(美国ABI公司)。
1.5 药品与试剂 DMEM培养基、胰蛋白酶、胎牛血清(Gibco);青霉素、链霉素、4%甲醛、细胞裂解液、台盼蓝、蛋白质浓度测定试剂盒(上海碧云天公司);CD29、CD44、CD73、CD90(BD公司)CD11b、CD19、CD3、CD34(e Bioscience公司);CCK-8试剂盒(日本同仁);TRIzol试剂、PrimeScript TM逆转录试剂盒、SYBR Premix Ex Taq TM试剂盒(日本TaKaRa);pcr反应引物由金唯智生物科技(北京)有限公司合成;CCND1抗体、MYC抗体、erk1/2抗体(Cell Signaling Technology),β-actin抗体(abcam);Transwell小室(美国康宁公司)。软坚清脉颗粒(上海中医药大学附属上海市中西医结合医院药剂科提供,规格:6 g/袋)。将1 g颗粒溶解于1 mL蒸馏水中,制得溶液。
1.6 实验方法
1.6.1 软坚清脉颗粒含药血清的制备 健康10周龄SD大鼠40只,适应性喂养10天后,将其随机分为4组,分别为正常对照组和软坚清脉颗粒低、中、高剂量组,每组10只。正常对照组灌胃给予等体积0.9%NaCl溶液,软坚清脉颗粒各剂量组分别灌胃0.275 g/(kg·d)、0.550 g/(kg·d)(临床等效量)、1.100 g/(kg·d)。连续灌胃10天,早上8点30给药一次,下午3点30给药一次,第10天末次给药完成后1.5 h腹主动脉采血。静置一个小时后2500 r/min离心10 min,吸取上清,过滤除菌后分装,-80 ℃保存。利用高效液相色谱仪研究软坚清脉颗粒含药血清与正常对照组血清的色谱,其中入血的主要成分为软坚清脉颗粒的主要药物活性成分。
1.6.2 BMSCs细胞的分离与培养 将SPF级新生两周内乳鼠脱臼处死后在75%乙醇中泡10 min后分离股骨及胫骨,在完全培养基中剪去骨骺。用完全培养基反复冲洗骨髓腔直至变白。反复吹打细胞悬液使其悬浮后置于培养皿中。将其置于正常培养箱中培养,此代细胞为原代。在培养箱中培养48 h后半换液,丢弃未贴壁的细胞,2天后全换液待细胞融合至80%时加入胰酶消化细胞,在离心管中1000 r/min离心5 min,弃掉上清后重悬细胞,按1∶2传代后标记为1代。待细胞融合至80%重复上述步骤,取P3代细胞进行流式鉴定及后续实验。
1.6.3 BMSCs细胞的鉴定 取P3代BMSCs细胞待融合至80%时,胰酶消化细胞后重悬。在检测管中放入细胞离心5 min,加入PBS洗涤细胞后,取P3代进行后续实验。将细胞编号为1-10号。1号不加任何抗体,2号加入PE同型对照,3号加入CD29-PE,4号加入CD44-PE,5号加入CD73-PE,6号加入CD90-PE,7号加入CD11b-PE,8号加入CD19-PE,9号加入CD31-PE,10号加入CD34-PE,全程避光条件下进行流式检测。用流式细胞仪检测相关表达。
1.6.4 实验分组及细胞处理 取P3代BMSCs细胞随机分为六组,用完全培养基将其稀释,在正常培养箱中将其培养24 h。1)正常组更换为完全培养基,置于体积分数为5% CO2饱和湿度培养箱中培养;2)模型组更换为无血清无糖DMEM培养基置于低氧装置中培养;3)空白血清组更换为无血清无糖DMEM培养基加入“1.6.1”项中正常对照组血清置于低氧装置中培养;4)中药低剂量组换为无血清无糖DMEM培养基加入“1.6.1”项中中药低剂量组血清置于低氧装置中培养;5)中药中剂量组换为无血清无糖DMEM培养基加入“1.6.1”项中中药中剂量组血清置于低氧装置中培养;6)中药高剂量组换为无血清无糖DMEM培养基加入“1.6.1”项中中药高剂量组血清置于低氧装置中培养。
1.6.5 CCK-8法检测细胞增殖能力 取P3代BMSCs细胞,用完全培养基调整细胞浓度,取100 uL接种于96孔板,每孔细胞数为6000个,设置6个复孔。置于正常培养箱中培养24 h后按“1.6.4”项条件进行细胞处理。各组细胞分别培养6、12、18、24 h,加入(ck-8)检测液,培养2 h后,酶标仪测定吸光度值。
1.6.6 qRT-PCR检测CCND1、MYC、ERK1/2 mRNA的相对表达量 取P3代BMSCs细胞用完全培养基将其稀释,按“1.6.4”项中意见的六个分组进行造模、给药。各组分别培养24 h后,收集BMSCs细胞。用Rrizol提取总RNA,检测RNA的纯度和浓度后,取1ug RNA为模板进行反转录,合成DNA进行实时荧光定量检测,以人β-actin为内参。引物序列见表1。
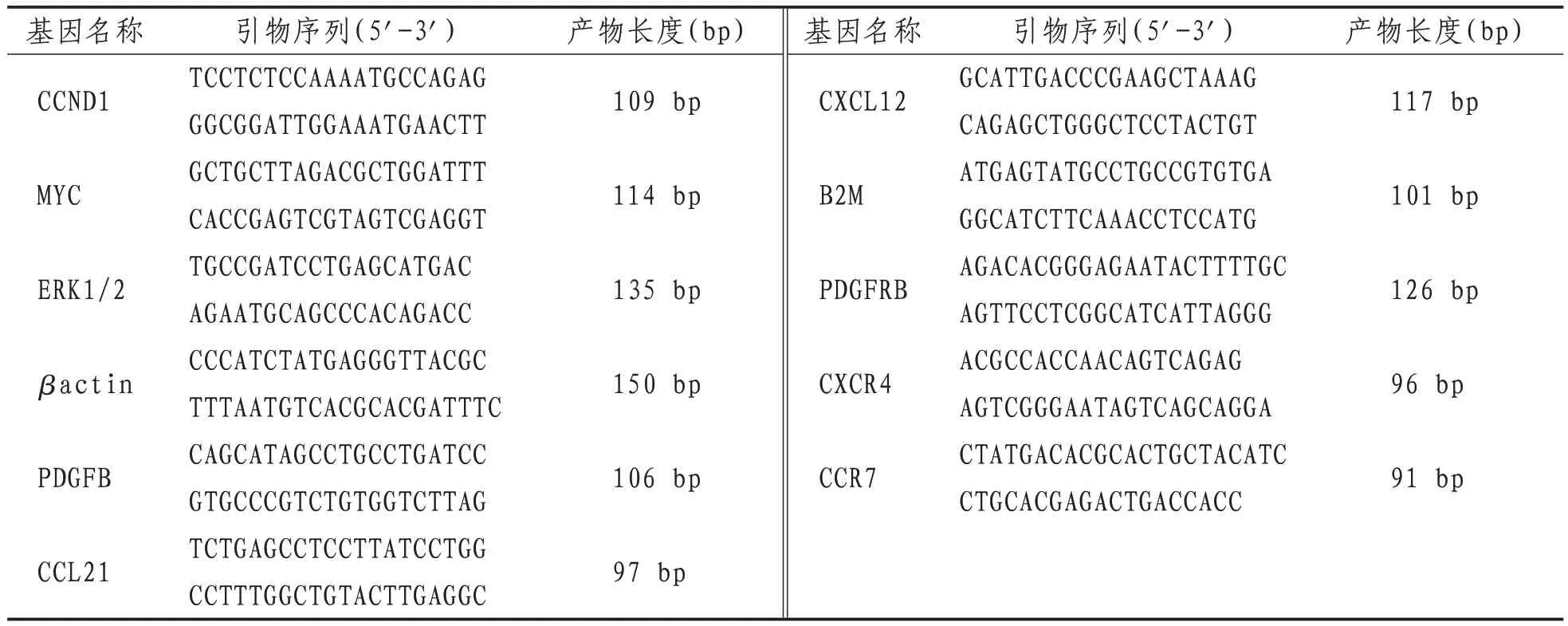
表1 PCR引物序列
1.6.7 Western blot 检测CCND1、MYC、ERK1/2蛋白的表达 取P3代BMSCs细胞按“1.6.4”项分组处理后培养24 h。吸取细胞培养液后加入裂解液。冰上裂解30 min后,于4 ℃下14 000 r/min离心10 min后提取总蛋白。采用BCA法测定各组蛋白浓度,采用SDS-PAGE电泳及蛋白进行电转,将PVDF膜封闭于4 ℃过夜;TBST洗膜5 min洗3次;加入相应的一抗4 ℃过夜,TBST洗膜5 min共3次后加入二抗稀释液孵育1 h;TBST洗膜5 min共3次;蒸馏水漂洗膜2 min,洗3次。将发光液加至膜表面后孵育5 min,去除发光液后至暗盒显影。
1.6.8 Transwell迁移实验 此实验用于鉴定预处理后的BMSCs细胞向HUVECs细胞迁移的能力,将BMSCs与HUVECs分别按“1.6.4”项中空白血清组与中药中剂量组处理方式培养后将其置于低氧培养箱中处理24 h。将5×104个BMSCs细胞重悬于“1.6.4”项中空白血清组或中药中剂量组的100 μL培养基中并接种于Transwell上室。将5×104个HUVECs重悬于“1.6.4”项中空白血清组或中药中剂量组的600 μL培养基中并接种于Transwell下室。孵育12 h后,BMSCs迁移到膜下侧,将迁移的细胞用多聚甲醛固定20 min。用PBS洗涤后用1%结晶紫溶液染色30 min。用棉签从小室上侧擦除非迁移细胞后在显微镜下计数迁移的细胞。
1.6.9 qRT-PCR检测HUVECs细胞PDGFB、CXCL12、CCL21的相对表达量 取第三代内皮细胞用完全培养基将其稀释,按“1.6.4”项条件中空白血清组与中药中剂量组处理后将其置于低氧培养箱中处理24 h。加入Trizol试剂提取总RNA后按照逆转录试剂盒进行反转录qRT-PCR反应体系置于PCR仪中,程序设置为95 ℃ 5 min,95 ℃ 10 s,60 ℃ 10 s,72 ℃ 10 s,循环40次,72 ℃延伸10 min。PDGFB、CXCL12、CCL25以b2m为内参基因,以2-ΔΔCt方法计算相对表达量。扩增引物序列及长度见表2。
1.6.10 qRT-PCR 检测BMSCs细胞PDGFRB、CXCR4、CCR7的相对表达量 取P3代BMSCs用完全培养基将其稀释,按“1.6.4”项条件中空白血清组与中药中剂量组处理方式将其置于低氧培养箱中处理24 h。加入Trizol试剂提取总RNA后按照逆转录试剂盒进行反转录后将qRT-PCR反应体系置于PCR仪中,程序设置为95 ℃ 5 min,95 ℃10 s,60 ℃ 10 s,72 ℃ 10 s,循环40次,72 ℃终延伸10 min。PDGFRB、CXCR4、CCR9以b2m为内参基因,以2-ΔΔCt方法计算相对表达量。扩增引物序列及长度见表1。
1.7 统计学方法 采用SPSS 21.0软件进行分析,计量资料以表示,采用单因素方差分析,组间多重比较采用Bonferroni法。P<0.05为差异有统计学意义。
2 结果
2.1 BMSCs细胞的鉴定 利用流式细胞仪对骨髓间充质干细胞表面抗原进行鉴定,发现P3代细胞能够表达CD29、CD44、CD73、CD90,而不表达CD11b、CD19、CD31、CD34,符合间充质干细胞的特点。
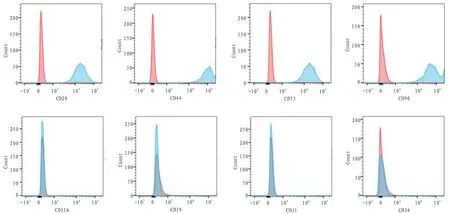
图1 大鼠骨髓间充质干细胞的流式细胞鉴定结果
2.2 对糖氧剥夺条件下BMSCs细胞增殖的影响 分别将BMSCs细胞于“1.6.4”项条件下进行处理6、12、18、24 h后,CCK-8实验结果得出:糖氧剥夺6 h时,与正常组相比,模型组增殖效果显著,组间差异显著(P<0.01);与模型组相比,空白血清组增殖效果不显著,差异无统计学意义(P>0.05);与空白血清组相比,中药低、高剂量组增殖效果较差,差异有统计学意义(P<0.01)。糖氧剥夺12 h时,与正常组相比,模型组增殖效果显著,组间差异显著(P<0.01);与模型组相比,空白血清组增殖效果不显著,差异无统计学意义(P>0.05);与空白血清组相比,中药各剂量组差异不显著(P>0.05)。糖氧剥夺18 h时,与正常组相比,模型组增殖效果不显著,组间差异不显著(P>0.05);与模型组相比,空白血清组增殖效果不显著,差异没有统计学意义(P>0.05);与空白血清组相比,中药各剂量组差异不显著(P>0.05)。糖氧剥夺24 h时,与正常组相比,模型组抑制效果显著(P<0.01);与模型组相比,空白血清组增殖效果显著(P<0.01);与空白血清组相比,中药各剂量组增殖效果显著(P<0.01);与低剂量组相比,中药中、高剂量组增殖效果显著(P<0.01);与中剂量组相比,中药高剂量组增殖效果较差,差异有统计学意义(P<0.01)。见表3。
表3 各组大鼠不同时间点BMSCs细胞增殖比较()

表3 各组大鼠不同时间点BMSCs细胞增殖比较()
注:a表示与正常组比较,P<0.01;b表示与模型组比较,P<0.01;c表示与空白血清组比较,P<0.01;d表示与中药低剂量组比较,P<0.01;e表示与中药中剂量组比较,P<0.01
24 h 1.316±0.027 1.036±0.032a 1.114±0.041b 1.221±0.031c 1.363±0.036cd 1.293±0.019cde组别正常组模型组空白血清组中药低剂量组中药中剂量组中药高剂量组鼠数软坚清脉颗粒剂量(g/kg)8 8 8 8 8 8 O2(%)21 0 0 0 0 0--0 0.275 0.550 1.100 6 h 0.490±0.011 0.569±0.013a 0.584±0.041 0.549±0.018c 0.567±0.008 0.545±0.008ce 12 h 0.625±0.225 0.873±0.014a 0.786±0.019 0.780±0.014 0.760±0.010 0.787±0.013 18 h 0.892±0.321 0.877±0.009 0.909±0.008 0.960±0.006 0.967±0.006 0.937±0.005
2.3 糖氧剥夺条件下24 h BMSCs细胞CCND1、MYC、ERK1/2 mRNA表达的影响 与正常组相比,模型组细胞CCND1、MYC、ERK1/2 mRNA表达降低(P<0.01);与模型组相比,空白血清组MYC mRNA表达水平升高(P<0.01);与空白血清组相比,软坚清脉颗粒各剂量组细胞CCND1、MYC、ERK1/2 mRNA表达水平升高(P<0.01);与低剂量组相比,软坚清脉颗粒中、高剂量组CCND1、ERK1/2 mRNA表达水平升高(P<0.01),中剂量组MYC mRNA表达水平升高(P<0.01);与中剂量组相比,高剂量组CCND1 mRNA表达水平升高(P<0.01),MYC、ERK1/2 mRNA表达水平降低(P<0.01)。见图2。
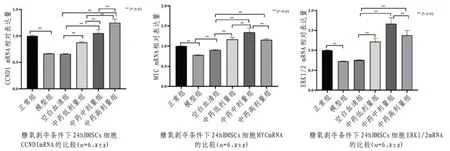
图2 糖氧剥夺条件下24 hBMSCs细胞CCND1、MYC、ERK1/2 mRNA及蛋白表达比较
2.4 糖氧剥夺条件下24 h BMSCs细胞CCND1、MYC、ERK1/2蛋白表达的影响 与空白组相比,模型组细胞CCND1、MYC、ERK1/2蛋白表达水平下调;与空白血清组相比,软坚清脉颗粒各剂量组细胞CCND1、MYC、ERK1/2蛋白表达水平上调。见图3。

图3 糖氧剥夺条件下24 h BMSCs细胞ERK1/2蛋白表达情况
2.5 糖氧剥夺条件下24 h软坚清脉颗粒含药血清对BMSCs迁移的影响 Transwell结果显示:软坚清脉颗粒可以显著促进BMSCs向HUVECs迁移,同对照组比较,BMSCs细胞加药组,HUVECs细胞加药组或同时加药组所迁移的细胞数量具有统计学意义(P<0.01)。见图4。
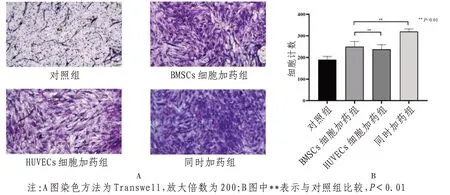
图4 软坚清脉颗粒含药血清对BMSCs向HUVECs迁移的情况
2.6 糖氧剥夺条件下24 h软坚清脉颗粒含药血清对HUVECs细胞趋化因子表达的影响 同空白血清组相比,中药中剂量组细胞表面PDGFB、CXCL21表达水平显著升高。见图5A。

图5 糖氧剥夺条件下24 hHUVECs表面趋化因子及BMSCs表面趋化因子受体表达的情况
2.7 糖氧剥夺条件下24 h软坚清脉颗粒含药血清对BMSCs细胞表面趋化因子受体表达的影响 同空白血清组相比,中药中剂量组细胞表面PDGFRB、CXCR4、CCR7表达显著升高。见图5B。
3 讨论
动脉硬化闭塞症对应中医外科学里的“脱疽”病属。关于脱疽的记载,最早见于《灵枢·痈疽》篇,其中生动描述了该病的临床特点,提出了截肢治疗方法,曰:“发于足趾,名脱痈。其状赤黑,死不治;不赤黑,不死。不衰,急斩之,不则死矣”。其病机以饮食不节为主要病因,脾虚为本,寒湿外伤为标,血脉瘀阻为其基本病机[15]。
奚九一教授多年临证总结本病病机不离“痰湿致瘀”,该病患者基本为中老年,加之饮食起居不节致脾肾亏虚、中焦运化失衡,后渐聚湿生痰、痰血互结、阻络成瘀;又或痰湿郁而化热、灼血成瘀。因此,奚九一教授认为湿、热、痰三邪为该病的主要致病因素[16-17]。进而提出“因邪致瘀”的观点,即邪入脉络,致瘀之表象,湿、热、痰为邪之主要,此三种邪可兼容转化瘀阻脉络,又可独立与血搏结致瘀。故本病“内生痰湿为本,外感化热之邪为标”为病机关键,临证注意血瘀为表征,不可遵从,当究其本源三邪,治疗应遵循“因邪致瘀,祛邪为先”[18]。中医学里的血管属于“脉”的范畴,在中医学中自古以来就认为血脉是可以新生的,虽历代文献中没有明确提出生脉(指血管新生,而非生脉饮之生津复脉之意)概念,但既往“生肌”“生新”“生血”三词即已包含此意[19]。如“祛瘀生新”就包括祛瘀血生新络这一含义,强调络脉的存在补充了经脉线性分布的不足,具有无限可分性和潜在再生性[20]。软坚清脉方因其针对ASO的“软坚化痰、祛风除湿、清热通络”,当为祛瘀生新的延伸,有着良好的生脉理论基出。临床应用效果促进侧支循环效果显著[21]。实验研究显示软坚清脉方含药血清可以通过稳定基质金属蛋白酶(matrix metalloproteinase,MMP)抑制缺氧诱导的HUVECs细胞凋亡[22]动物实验表明软坚清脉方能够促进下肢缺血性小鼠血流增加,剂量性的促进VEGF和CD31的表达,对VEGF和PDGF表达具有促进作用,促进下肢血管新生并建立侧支循环[23]。
对于ASO的治疗中医学界主要运用活血化瘀法治疗,同时辅以“清热”“化湿”“益气”“行气”“温经”和“健脾”等治法,随证加减。其多以“活血化瘀”为主要治则,虽然亦有佳效,但是长期使用则活血太甚,轻则出现不适症状,重则动血伤正[24];加之血管狭窄闭塞导致局部组织血流减少,而正常血管过度扩张,导致“盗血”,致使局部缺血愈甚,疗效难再提高。探索有效修复侧支循环治疗手段是十分需要的。骨髓间充质干细胞在各种趋化因子的作用下可动员归巢至缺血部位参与血管的修复和新生[25]。并且在临床上有报道显示,骨外科常运“骨搬移”技术来促进骨缺损,诱导BMSCs可分化为HUVECs参与血管生成[26]。骨髓间充质干细胞的归巢率直接决定了其治疗效果,所以只有在治疗中有一个可观的归巢率,才能保证其疗效。
SDF-1/CXCR4轴的主要功能之一是调节前体细胞的移植、趋化及归巢至损伤部位,是介导BMSCs迁移分布的关键信号[27]。相关研究表明,BMSCs在治疗缺血性疾病在跨内皮细胞迁移时CCL25,CCL19表达都又显著升高[28],更有研究表明msc表面可以表达趋化因子受体CCR9、CCR7、CXCR6等[29]。PDGF促进骨髓间充质干细胞迁移并形成新生血管[30-31]。
本次在实验中采用CCK-8法观察骨髓间充质干细胞的增殖情况,统计结果显示模型组在6、12 h时增殖显著,但中药对BMSCs的干预无明显作用,差异无统计学意义。但在24 h时,药物的增殖作用出现了显著性差异,骨髓间充质干细胞自身能量消耗后,中药维持了其数量。且中高剂量组效果明显,说明药物需要达到一定浓度时才能体现其作用。同时在Transwell实验中,当BMSCs与HUVECs同时加药时,迁移效果显著。证明软坚清脉颗粒含药血清对于BMSCs的迁移作用可能是对两种细胞同时发挥作用的。因此我们认为软坚清脉颗粒可能通过促进BMSCs细胞增殖迁移从而促进血管新生、建立侧支循环进而改善缺血肢体远端组织血供。
不足之处:此实验为体外细胞实验,软坚清脉颗粒在体内是否促进BMSCs的实验有待进一步验证:软坚清脉方为成方,有效成分复杂,在发生增殖及趋化作用中起具体作用的成分有待进一步探寻。
