乳腺癌患者放射治疗前后血清肝代谢酶CYP1A2水平和临床特征与放射性皮炎的相关性分析
2024-04-29陈梓林,罗莲,周娜,颜磊,黄嘉琪,陈勇
陈梓林,罗莲,周娜,颜磊, 黄嘉琪,陈勇
摘要:目的探討乳腺癌患者放射治疗前后血清中肝代谢酶CYP1A2水平和临床特征与放射性皮炎的相关性。方法选取本院2022年10月至2023年8月收治的IIA期乳腺癌放射治疗患者120例为研究对象。收集患者年龄、卡氏功能状态评分标准(kamofsky performance status,KPS)、体重指数(body mass index,BMI)资料。采用酶联免疫法检测患者放射治疗前后血清中CYP1A2的表达水平。根据放射性皮炎程度分为重度组(n=21)、轻度组(n=81)、正常组(n=18)。采用χ2检验分析放射治疗后放射性皮炎发生率与临床特性的相关性。采用Wilcoxon符号秩检验比较放射治疗前后血清CYP1A2水平的差异。采用Kruskal-Wallis H检验比较放射治疗后放射性皮炎程度不同组的血清CYP1A2水平的差异。结果放射治疗后放射性皮炎发生率为85%。放射治疗后重度组的血清CYP1A2水平为(5.43±0.99) ng/mL,轻度组为(3.67±1.08) ng/mL,正常组为(2.06±0.91) ng/mL。年龄、KPS、BMI与放射性皮炎发生率具有相关性,年龄≥60岁,KPS≤80分,BMI<18.5 kg/m2的患者更容易发生放射性皮炎,差异有统计学意义(P<0.05)。放射治疗后血清CYP1A2水平较放射治疗前升高,差异具有统计学意义(P<0.05)。放射治疗后血清CYP1A2水平与放射治疗后放射性皮炎分级呈正相关(r=0.665,P<0.05)。结论乳腺癌患者年龄、KPS、BMI与放射治疗引起的放射性皮炎发生率有关,放射治疗后血清CYP1A2水平升高,且与放射性皮炎严重程度有关。
关键词:乳腺癌;肝代谢酶CYP1A2;放射治疗;放射性皮炎
中图分类号:R737.9 文献标志码:A
Correlation of the level of hepatic metabolic enzymes CYP1A2 in serum before and after radiotherapy and clinical characteristics with
the radiation dermatitis in patients with breast cancer
CHEN Zilin, LUO Lian, ZHOU Na, YAN Lei, HUANG Jiaqi, CHEN Yong
(Department of Hematology and Oncology Shaoyang Hospital Affiliated of University of South China,
Shaoyang 422000, China)
Abstract: Objective To explore the correlation of the level of hepatic metabolic enzymes CYP1A2 in serum before and after radiotherapy and clinical characteristics with the radiation dermatitis in patients with breast cancer. Methods A total of 120 patients with stage IIA breast cancer radiotherapy admitted to our hospital from October 2022 to August 2023 were selected as the study subjects. The patients age, KPS and BMI information were collected. The expression level of CYP1A2 in serum before and after radiotherapy was detected by enzyme-linked immunoassay. According to the severity of radiation dermatitis, the patients were divided into severe group (n=21), mild group (n=81) and normal group (n=18). The correlation between the degree of radiation dermatitis and clinical characteristics after radiotherapy was analyzed by chi square test. The differences in serum CYP1A2 levels before and after radiotherapy were compared by Wilcoxon signed rank test. The differences in serum CYP1A2 levels among groups with different degrees of radiation dermatitis after radiotherapy by Kruskal Wallis H test were compared. Results The incidence of radiation dermatitis after radiotherapy was 85%. The serum CYP1A2 levels of radiation dermatitis after radiotherapy were (5.43±0.99) ng/mL in the severe group, (3.67±1.08) ng/mL in the mild group, and (2.06±0.91) ng/mL in the normal group. There was a correlation of age, KPS, BMI, with the incidence of radiation dermatitis. Patients aged ≥ 60 years, KPS≤80 scores, and BMI<18.5 kg/m2 were more likely to develop radiation dermatitis, and the differences were statistically significant (P<0.05). The serum CYP1A2 level increased after radiotherapy compared to before radiotherapy, and the difference was statistically significant (P<0.05). The serum CYP1A2 level after radiotherapy was positively correlated with the severity of radiation dermatitis after radiotherapy (r=0.665, P<0.05). Conclusion Age, KPS and BMI of breast cancer patients are related to the incidence of radiation dermatitis caused by radiotherapy. The serum CYP1A2 level increases after radiotherapy, and is related to the severity of radiation dermatitis.
Key words: breast cancer; hepatic metabolic enzymes CYP1A2; radiotherapy; radiation dermatitis
乳腺癌是世界上女性发病率和病死率较高的恶性肿瘤,严重影响着女性健康。放射治疗是肿瘤的主要治疗方法之一,肿瘤被各种放射线照射,使得癌细胞被杀灭,放射治疗可以根治40%的癌症[1]。乳腺组织处于体表,对放射线敏感。通过指南推荐的放射治疗,原发性乳腺癌患者可以明顯改善总体生存率和乳癌的局部控制率,特别是对于不能耐受手术、失去手术机会、保乳术、术后复发等患者。放射治疗是乳腺癌治疗中非常重要的治疗方法之一,是50%以上的乳腺癌患者不可或缺的治疗项目[2]。放射治疗是一种极具成本效益的治疗方法,是有效癌症服务的重要组成部分[3]。但是放射治疗过程中仍然不可避免地会对正常组织造成损伤,引起一系列的毒副作用,其中,放射性皮炎是一种在接受放射治疗后可能发生的严重皮肤反应,如今已成为放射治疗中重要的临床挑战,给患者带来痛苦,严重影响患者的生活质量及治疗依从性[4]。肝脏是对辐射敏感的器官之一,放射治疗后大部分患者肝功能会异常,考虑为肝受损后细胞凋亡引起,同时也会出现纤维化等病变导致酶蛋白表达系统受损所致。既往研究发现辐射可诱导部分肝代谢酶CYP450超家族酶系的蛋白质表达及药物代谢活性改变,如CYP1A2蛋白表达和药物代谢活性会升高[5-6]。肝代谢酶CYP1A2 mRNA表达水平同时也与药疹性皮炎及免疫性皮炎等发病机制相关,而放射性皮炎的发生机制与这些皮炎的发病机制有许多类似的共同点,如细胞凋亡在不同程度皮炎中表现的情况不同、均有细胞的抗氧化损伤、感染、炎症介质变化等[7-9]。也总结了许多与放射性皮炎相关的风险因素如年龄、卡氏功能状态评分标准(karnofsky performance status,KPS),体重指数(body mass index,BMI),吸烟习惯,患者放射治疗前皮肤是否有破损、感染、皮肤的特点、照射的具体部位,内分泌,营养状况等[7-9]。本研究分析了乳腺癌患者年龄、BMI、KPS与放射性皮炎发生率的关系,放射治疗前后血清肝代谢酶CYP1A2水平的表达变化情况,放射治疗后血清肝代谢酶CYP1A2水平与放射性皮炎严重程度的相关性。通过动态检测各项临床特征和血清中肝代酶CYP1A2水平来预测放射治疗进行中及完成后发生放射性皮炎的概率和严重程度,可以提前干预放射治疗产生的放射性皮炎这一相关毒副作用,可以有效减轻患者的痛苦并且增强治疗意愿,这也是目前精准医疗的一个长期目标。
1资料与方法
1.1一般资料
选取2022年10月至2023年8月在邵阳市中心医院初诊为乳腺癌,分期为IIA期,行乳腺癌根治术后再行胸壁野+锁骨上野放射治疗的患者120 例为研究对象。根据放射性皮炎程度分为重度组(n=21)、轻度组(n=81)、正常组(n=18)。纳入标准:(1)病理确诊为乳腺癌,分期为IIA期的患者;(2)乳腺癌根治术后行胸壁野+锁骨上野放射治疗,剂量为50 Gy/25F的患者;(3)病历资料完整;(4)无重要器官功能严重受损,血常规、肝肾功能、凝血功能等均在正常范围内。排除标准:(1)合并其他恶性肿瘤患者;(2)合并其他结缔组织和皮肤病的患者;(3)放射治疗前皮肤有破损、感染的患者;(4)存在放射治疗禁忌证,合并其他器官功能损伤不能行放射治疗的患者。本研究经邵阳市中心医院伦理委员会审批通过,所有患者及家属均知情同意。
1.2方法
1.2.1临床资料收集
收集患者年龄、KPS、BMI,可用于分析患者生活质量、营养状况的资料。
1.2.2放射治疗及样本收集
IIA期乳腺癌患者,行乳腺癌根治术后再行胸壁野+锁骨上野放射治疗,剂量为50 Gy/25F。患者放射治疗计划开始前1 d及结束后第1天,收集清晨6:00外周血10 mL,离心得到上清液,保存于-80 ℃冰箱,待检测。
1.2.3血清CYP1A2水平
使用酶联免疫吸附试验检测待测血清样本中CYP1A2水平情况。
具体步骤:(1)设置标准品孔和样本孔,标准品孔各加不同浓度的标准品50 μL;(2)分别设空白孔(空白孔不加样品及酶标试剂)、待测样品孔。在待测样品孔中先加样品稀释液40 μL,然后再加待测样品10 μL;(3)标准品孔和样本孔中每孔加入酶标试剂100 μL,用封板膜封板后置37 ℃水浴锅或恒温箱温育60 min;(4)揭掉封板膜,弃去液体,吸水纸上拍干,每孔加满洗涤液,静置30 s后弃去,吸水纸上拍干,如此重复洗板5次;(5)每孔加入显色剂A、B各50 μL,37 ℃避光显色15 min;(6)每孔加入终止液50 μL,15 min内使用贵阳沃尔森生物技术有限公司试剂盒在450 nm波长处依序测量各孔的OD值。
1.3观察指标及判定标准
1.3.1放射性皮炎
根据美国肿瘤放射治疗协作组织(radiation therapy oncology group,RTOG)分级标准,放射性皮炎分为0级、1级、2级、3级、4级共5种级别。0级皮肤无变化;1级皮肤出现水疱红斑,干性脱皮,毛发脱落,出汗减少;2级皮肤出现触痛,明显红斑,片状湿性脱皮,中度水肿;3级皮肤出现融合性湿性脱皮,重度水肿;4级皮肤出现溃疡,出血,坏死。将其分为正常组(0级)、轻度组(1~2级)、重度组(3~4组)。
1.3.2放射治疗前后血清CYP1A2 水平
在 Excel工作表中,以标准品的浓度为横坐标,OD 值为纵坐标,绘制标准品线性回归曲线,按曲线方程计算各样本浓度值。
1.4统计学处理
使用SPSS 23.0统计学软件分析数据,采用χ2检验分析放射治疗后放射性皮炎发生率与临床特性的相关性。采用 Wilcoxon符号秩检验比较放射治疗前后血清CYP1A2水平的差异。采用Kruskal-Wallis H检验比较放射治疗后放射性皮炎程度不同组的血清CYP1A2水平的差异。以P<0.05为差异有统计学意义。
2结果
2.1放射性皮炎发生情况分析
根据RTOG分级标准,0级为无放射性皮炎,共18例(15.0%);1~4级为阳性共有102例,放射性皮炎发生率为85%。1~2级为轻度,共81例(67.5%);3~4级为重度,共21例(17.5%)。
2.2放射性皮炎发生率与临床特征的关系
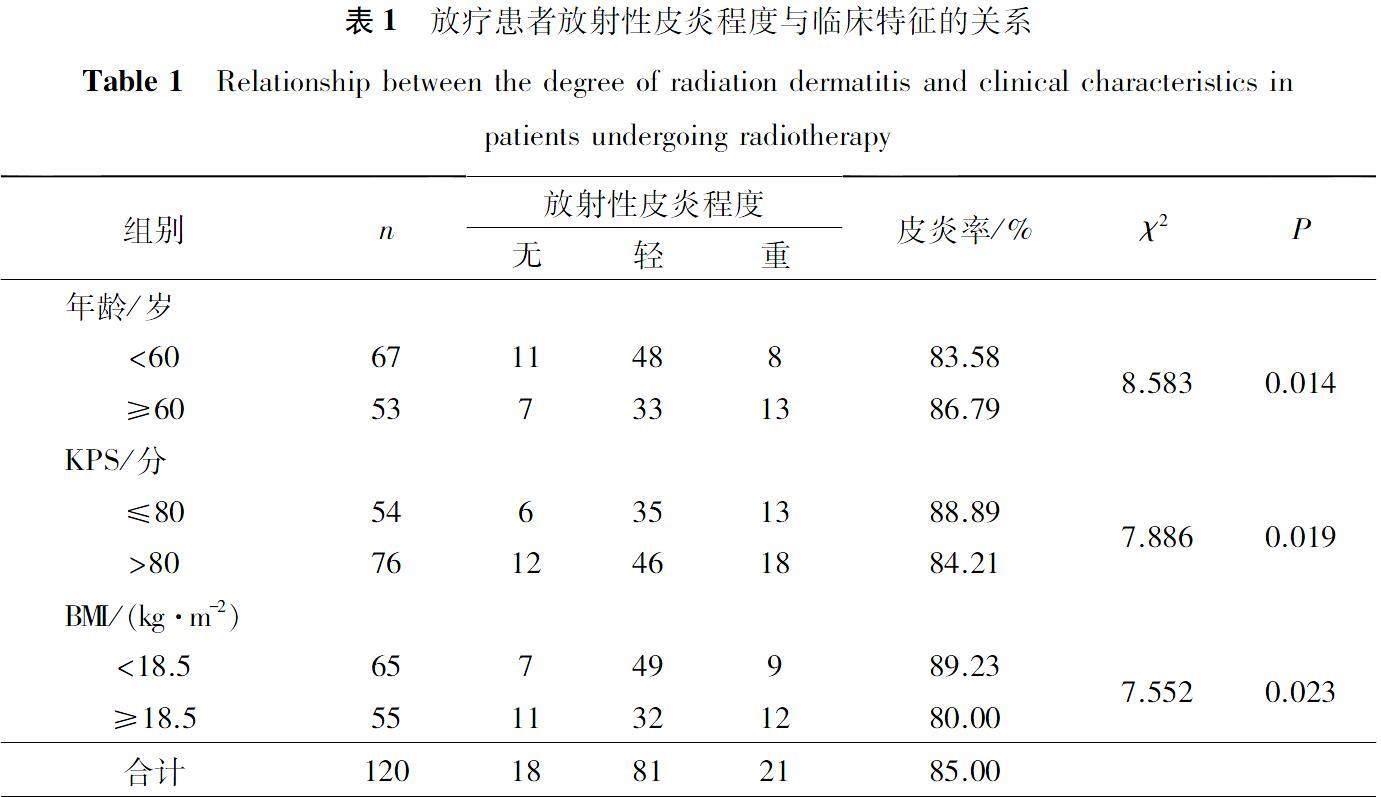
年龄、KPS、BMI与放射性皮炎发生率具有相关性,年龄≥60岁,KPS≤80分,BMI<18.5 kg/m2的患者更容易发生放射性皮炎,差异有统计学意义(P<0.05),见表1。
2.3放射治疗后血清CYP1A2水平与放射性皮炎程度的相关性分析
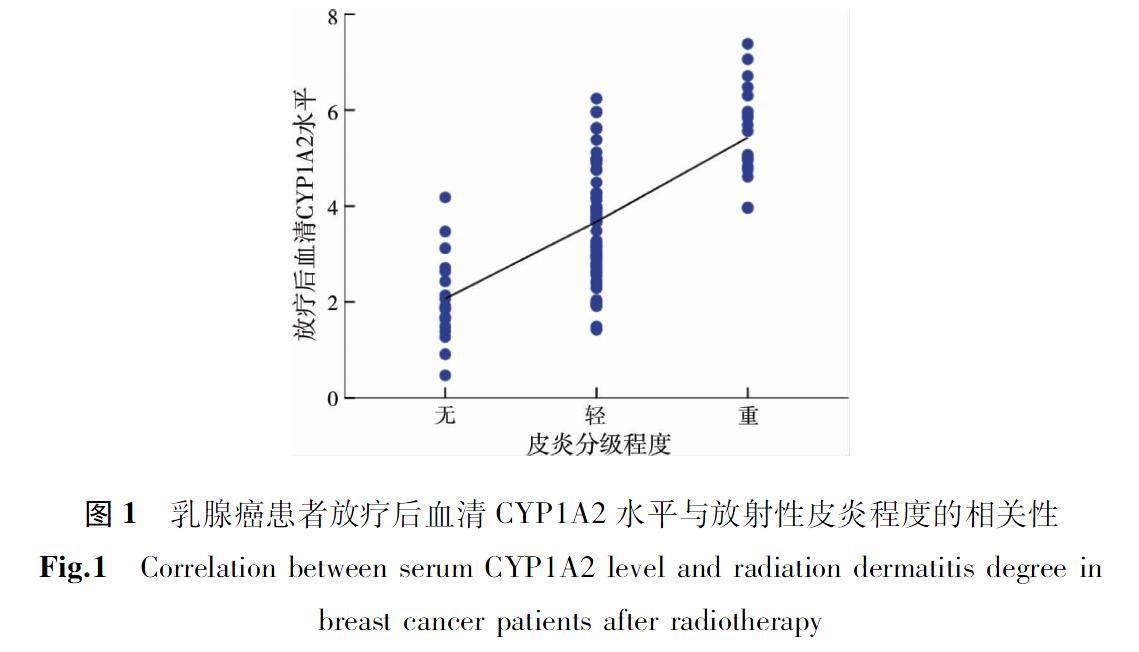
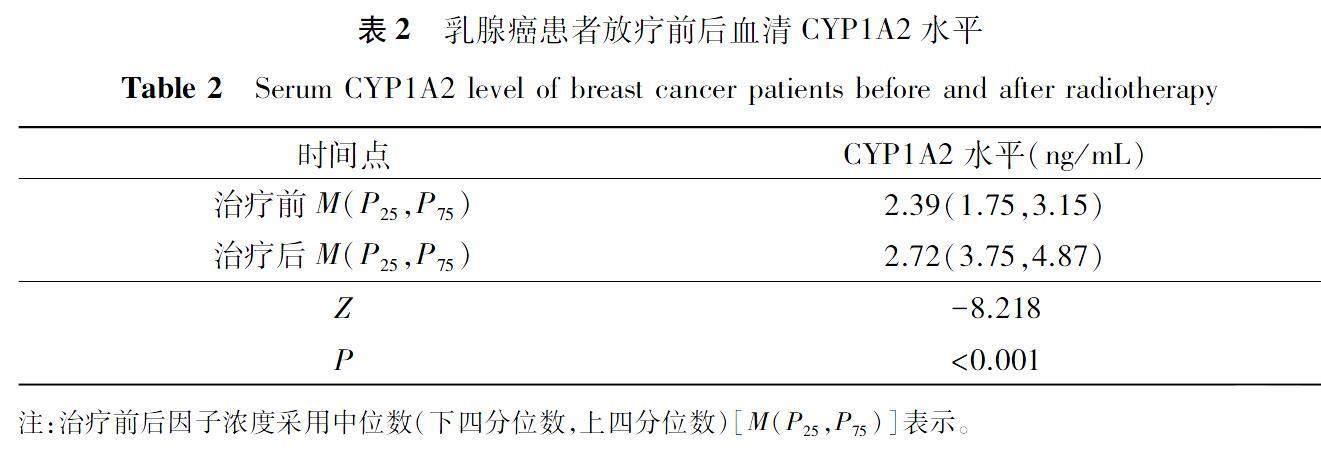
放射治疗后血清CYP1A2水平较放射治疗前升高,具有统计学意义(P<0.05),见表2。放射性皮炎程序不同的三组乳腺癌患者放射治疗后血清CYP1A2水平差异有统计学意义(P<0.05),见图1。放射性皮炎程度与放射治疗后血清中CYP1A2水平呈正相关(R=0.665,P<0.05),见表3。
3讨论
目前放射治疗是乳腺癌治疗中非常重要的治疗方法之一,但放射治疗过程中出现的不良反应如放射性皮炎在不同程度上影响着乳腺癌患者的治疗依从性及生活质量。因此,若能通过简单的方法如动态检测各项临床特征和血清中肝代酶CYP1A2水平来预测放射性皮炎的发生概率及严重程度,对于临床上防治放射性皮炎及放射治疗其他相关毒副作用十分重要。
放射性皮炎发病机制复杂,风险因素有年龄、KPS、BMI,目前虽尚无明确定论,但是既往有研究表明放射性皮炎发生机制主要有氧自由基生成、放射线引起DNA双链破坏、自噬、感染、细胞凋亡、炎症介质等。放射线照射皮肤组织后,导致DNA双链断裂,引起直接DNA损伤[10]。KOLE等[11]研究指出,放射线照射后诱导细胞产生活性氧,如自由基,超氧阴离子和过氧化氢,造成氧化应激损伤,进一步损伤DNA,诱发间接DNA损伤。放射性皮炎相关的皮肤损伤的原因是表皮和真皮基底层中自由基和活性氧中间体的产生。这些会导致DNA损伤和皮肤大分子成分的变化,包括对基底角质形成细胞的损伤[12]。此外,皮肤的表皮屏障因辐射暴露而受损,因此感染风险增加[13]。放射治疗后的急性皮肤变化是直接组织损伤和同时发生的局部炎症反应共同导致的结果。治疗前 24 h后出现短暂性红斑可能是由于毛细血管扩张和炎症介质(如白三烯和前列腺素)导致的血管通透性增加所致。有研究表明促炎和促纤维化细胞因子如肿瘤坏死因子 -α、白细胞介素 1 和 6、肿瘤生长因子-β、血小板衍生生长因子和结缔组织生长因子等也可引起短暂性红斑[14]。肿瘤生长因子-β和血小板衍生生长因子通过激活成纤维细胞和诱导细胞外基质蛋白和基质金属蛋白酶的合成来促进纤维化[15]。在扩张的血管周围还可以发现血管周围炎症分子和水肿的内皮细胞。此外由于新细胞的生长速度比旧死细胞的脱落速度更快,因此会导致干脱屑[16]。皮脂腺和皮脂腺的破坏毛囊也会导致皮肤干燥和脱毛[17]。放射性皮炎的发生机制与药疹性皮炎及免疫性皮炎的发病机制有许多共同点,如细胞凋亡在不同程度皮炎中的表现情况不同、均有细胞的抗氧化损伤、均有促炎和促纤维化因子参与等[7-9]。细胞色素P450(CYP450S)为一类由多种同工酶组成的亚铁血红素蛋白的超家族酶系,分布于全身各个组织,肝细胞中CYP450含量最丰富,对内、外源性物质的代谢失活或活化起关键作用。其中的肝代谢酶CYP1A2 mRNA表达水平与药疹性皮炎及免疫性皮炎等发病机制相关。另外辐射可在一定程度上诱导肝药物代谢酶表达和活性,使CYP1A2的活性提高,蛋白及mRNA表达增加[5-6]。机体中 CYP1A2酶主要存在于肝脏,部分肝外细胞也有分布,而肝脏也是对辐射敏感的器官之一,放射治疗前后血清CYP1A2水平的变化考虑为肝受损后细胞凋亡从而引起肝功能异常、纤维化等病变,导致酶蛋白表达系统受损所致。CYP1A2主要参与芳香族化合物、杂环胺和硝基芳香化合物等的代谢,能将环境中的多环芳香烃等激活产生活性氧和自由基等有毒物质,造成氧化应激损伤,从而诱发DNA损伤,增加感染风险,导致皮肤炎症。在长时间的高辐射剂量下,皮肤的基底层无法正常愈合,被破坏的真皮成纤维细胞和胶原蛋白生成不足导致真皮变薄、萎缩,甚至放射治疗结束后数月至数年,真皮坏死仍然可能会发展,放射性皮炎的严重程度会持续加重[18]。因此,肝代謝酶CYP1A2可能在放射性皮炎的发生上起重要作用。
本试验收集患者年龄、KPS、BMI数据,以外周血血清为标本,运用酶联免疫吸附实验测定外周血中CYP1A2水平,以RTOG分级标准评估放射性皮炎严重程度。结果显示,依据RTOG分级标准,放射性皮炎发生率为85%,年龄、KPS、BMI与放射性皮炎发生率具有相关性,年龄≥60岁,KPS≤80分,BMI<18.5 kg/m2的患者更容易发生放射性皮炎(P<0.05),放射治疗后血清CYP1A2水平较放射治疗前升高(P<0.05),且与放射性皮炎程度呈正相关(r=0.665,P<0.05)。
综上,年龄、KPS、BMI是放射性皮炎的风险因素,与放射性皮炎的发生率有关。血清中CYP1A2水平是乳腺癌患者简单易得的反映肝代谢酶的指标之一,与多种类型的皮炎相关,与放射性皮炎严重程度呈正相关。但是本试验并不能得出临床特征及血清CYP1A2水平能作为预测放射性皮炎的指标的结论,还有待今后的研究证实,这与本试验样本量小及偏倚,且未动态监测放射治疗过程中血清CYP1A2水平的变化及放射治疗结束后放射性皮炎的转归有关。因此,该试验结果后续尚需扩大样本量、增加放射治疗期间采集的标本和放疗后的随访来进一步验证以明确临床特征和血清CYP1A2与放射性皮炎的关系,辐射对 CYP1A2的诱导作用是否会对机体产生放射性皮炎等除辐射损伤外的二次损伤,也需要后续的试验中进一步验证。虽然国内外对放射性皮炎进行了大量研究,但其发病机制尚不清楚,本研究结果为进一步阐明该疾病发病机制和防治放射性皮炎提供了基础。
參考文献:
[1]田静, 韩丹, 周涛. 肿瘤放射治疗技术的发展及应用研究[J]. 中国医刊, 2022, 57(10): 1064-1067.
[2]ATUN R, JAFFRAY D A, BARTON M B, et al. Expanding global access to radiotherapy[J]. Lancet Oncology, 2015, 16(10): 1153-1186.
[3]DELANEY G, JACOB S, FEATHERSTONE C, et al. The role of radiotherapy in cancer treatment: estimating optimal utilization from a review of evidence-based clinical guidelines[J]. Cancer, 2005, 104(6): 1129-1137.
[4]贾移娜, 王丽娟, 牟宽厚. 乳腺癌放疗后放射性皮炎的预防和治疗[J]. 临床医学研究与实践, 2020, 5(25): 47-49.
[5]董航, 张海晖, 窦桂芳, 等. γ射线辐射对大鼠肝药物代谢酶CYP1A2, CYP2C9和CYP2D6蛋白表达及药物代谢活性的影响[J]. 中国药理学与毒理学杂志, 2021, 35(4): 290-296.
[6]辛元尧. X射线辐射对药物代谢酶CYP1A2和CYP2E1活性及蛋白和mRNA表达的影响[D]. 西宁: 青海大学, 2019.
[7]隆岚, 刘国红, 万彦彬. 三氯乙烯药疹样皮炎患者血清微量元素含量及肝代谢酶基因表达水平的测定[J]. 中国皮肤性病学杂志, 2014, 28(12): 1233-1235.
[8]廖日炎, 徐新云. 三氯乙烯对肝细胞凋亡基因和肝代谢酶基因表达水平的影响[J]. 实用预防医学, 2015, 22(7): 873-877.
[9]XU X, KE Y, YUAN J, et al. Trichloroethylene-induced hypersensitivity dermatitis was associated with hepatic metabolic enzyme genes and immune-related genes[J]. Chemical Research in Toxicology, 2016, 5(2): 633-640.
[10]NICKOLOFF A, SHARMA N, TAYLOR L. Clustered dna double-strand breaks: Biological effects and relevance to cancer radiotherapy[J]. Genes (Basel), 2020, 11(1): 99.
[11]KOLE A J, KOLE L, MORAN M S. Breast cancer-targets and therapy dovepress acute radiation dermatitis in breast cancer patients: challenges and solutions[J]. Breast Cancer (Dove Med Press), 2017, 5(9): 313-323.
[12]RENAUDIN X. Reactive oxygen species and DNA damage response in cancer[J]. International Review of Cell and Molecular Biology, 2021, 364: 139-161.
[13]SCHMUTH M, SZTANKAY A, WEINLICH G, et al. Permeability barrier function of skin exposed to ionizing radiation[J]. Archives of Dermatology, 2001, 137(8): 1019-1023.
[14]WICKLINE M M. Prevention and treatment of acute radiation dermatitis: a literature review[J]. Oncology Nursing Forum, 2004, 31(2): 237-247.
[15]HEGEDUS F, SCHWARTZ R A, Cutaneous radiation damage: updating a clinically challenging concern[J]. Giornale Italiano Di Dermatologia E Venereologia, 2019, 154: 550-556.
[16]BERNIER J, BONNER J, VERMORKEN J B, et al. Consensus guidelines for the management of radiation dermati-tis and coexisting acne-like rash in patients receiving radiotherapy plus EGFR inhibitors for the treatment of squamous cell carcinoma of the head and neck[J]. Annals of Oncology, 2008, 19: 142-149.
[17]SCHMUTH M, SZTANKAY A, WEINLICH G, et al. Permeability barrier function of skin exposed to ionizing radiation[J]. Archives of Dermatological Research, 2001, 137(8): 1019-1023.
[18]BHANGOO R S, BHANGOO M S, MANGOLD A R, et al. Radiation recall dermatitis after the use of pralatrexate for peripheral T-cell lymphoma-science direct[J]. Advances in Radiation Oncology, 2018, 4(1): 31-34.
