锡林河流域滨河带湿地植物功能性状及差异研究
2024-04-28寇欣刘华民张景慧苑鹏云曹晓霭温璐于晓雯刘东伟王立新
寇欣, 刘华民, 2, 3, 张景慧, 2, 3, 苑鹏云, 曹晓霭, 温璐, 2, 3, 于晓雯, 刘东伟, 2, 3, 王立新, 2, 3,*
锡林河流域滨河带湿地植物功能性状及差异研究
寇欣1, 刘华民1, 2, 3, 张景慧1, 2, 3, 苑鹏云1, 曹晓霭1, 温璐1, 2, 3, 于晓雯1, 刘东伟1, 2, 3, 王立新1, 2, 3,*
1. 内蒙古大学生态与环境学院, 呼和浩特 010021 2. 草原生态安全省部共建协同创新中心, 呼和浩特 010021 3. 蒙古高原生态学与资源利用教育部重点实验室, 呼和浩特 010021
作为河流景观重要组成部分的滨河带, 是河流水体系统与相邻陆地之间的界面或生态过渡区。湿地植物及其群落在维系湿地生态系统稳定性及功能方面具有重要作用。本文通过对比锡林河流域滨河带上游、中游、下游以及放牧干扰下湿地植物20种功能性状, 在流域尺度上探究滨河带湿地植物功能性状对环境和放牧强度的响应, 研究表明: 锡林河流域滨河带不同河段湿地植物各功能性状变异系数波动范围较大, 其中叶片碳含量()变异系数最小为0.05, 变异系数最大的是光合速率(), 其值为2.64; 湿地植物的结构性状与生理性状之间通过互补与替代、在功能上的平衡实现对环境的适应; 湿中生草本、中生草本、旱生草本植株高度在退化样地显著低于轻微退化样地; 植物株高、叶片()()在五种共有植物种芦苇()、扁穗草()、鹅绒委陵菜()、小糠草()、疗齿草()群落之间均存在显著差异; 锡林河流域滨河带湿地植物在不同放牧梯度下, 无论是在功能群水平还是植物共有种水平, 对退化程度均表现出不一致的响应。
锡林河流域; 滨河带; 植物功能性状; 放牧干扰
0 前言
作为陆地与河流水体系统之间的界面或生态过渡带的滨河带湿地, 具有调蓄洪水、截污和净化、保护生物多样性、控制沉积和防止侵蚀、提供野生动植物栖息地等重要的生态功能[1]。滨河带湿地植物群落作为滨河带湿地重要组成部分, 其空间分布格局影响着湿地生态系统的功能表达, 维系着滨河带生态系统的稳定性[2]。近年来, 由于全球气候变化及过度放牧等人为干扰的加剧, 许多滨河带湿地生态系统处于严重退化状态, 亟待恢复与重建。植物功能性状是指能够表征和指示生态系统功能的植物属性, 包括形态、生理、物候等属性[3], 是连接植物与外界环境的重要桥梁[4], 其在不同环境梯度表现出的敏感变化展现了对异质环境的适应机制, 能够承载一定环境变化信息[5], 广泛应用于植物对环境的适应及生态系统功能的维持机制等研究中[6]。
目前, 关于植物功能性状的研究大多集中在荒漠[7]、草原[8]、森林[9]等生态系统中, 分析植物功能性状对土壤水分或肥力、光照、气候、海拔等环境因子的响应, 或以植物功能性状为指标, 研究植物群落对土地利用、放牧干扰等外界环境变化的抗逆性和适应性, 进而探寻荒漠、草原、森林等生态系统的恢复策略。然而, 目前关于湿地生态系统植物功能性状的研究较少, 以河流连续体为对象也鲜有相关研究[10]。本研究在内蒙古草原区锡林河流域开展, 通过选取植物高度(PH)、叶干重(LW)、叶面积(LA)、叶厚度(LT)、比叶重(LMA)、比叶面积(SLA)、比根长(SRL)、叶片碳、氮、磷含量(LCC、LNC、LPC)、植株碳、氮、磷含量(TC、TN、TP)、光合速率(Pn, Photosynthetic Rate)、气孔导度(Gs, Stomatal conductance)、胞间CO2浓度(Ci, Intercellular CO2concentration)等20种植物功能性状, 从植物物种和水生生态类型探讨滨河带湿地植物对锡林河流域不同河段及不同放牧干扰的响应和适应机理, 为深入理解滨河带湿地植物功能性状与环境和生态系统功能的关系提供科学依据。
1 材料与方法
1.1 研究区概况
锡林河流域位于内蒙古高原中部, 赤峰市克什克腾旗与锡林郭勒盟锡林浩特市境内, 地理坐标为43°26′—44°39′N、115°32′—117°12′E, 总面积约1.0786×108hm2, 属大陆性温带半干旱气候, 地势东南高西北低。流域内土壤呈黑钙土带—暗栗钙土亚带—淡栗钙土亚带地带性分布, 滨河带湿地植被分布有柳灌丛、沼泽、湿草甸、盐地草甸。年平均气温–1.3—2.1℃, 年降水量250—400 mm, 降雨多集中在7—8月。本研究分别于2016年7月、2017年7月开展, 采样地点如图1所示。分别选取锡林河上游、中游、下游滨河带湿地进行采样, 在上游选取轻微退化样地, 根据群落优势物种、植株高度以及生物量的变化, 在中游与下游分别确定轻微退化、退化两个放牧梯度样地, 共设置5个采样点。
1.2 研究方法
野外采样时每种植物分别选取长势良好且无病虫害的成熟完整植株15株, 另采集完整叶片20片, 要求处于植株中部且代谢旺盛。应用便携式光合作用测量系统(LI-6400XT)在光照充足条件下测量植物光合速率、气孔导度、胞间CO2浓度等指标, 在自然光源下, 每种植物在上午9: 00—11: 00进行测量, 测量时选择叶片的中部。光合速率的测定是在限制低CO2浓度进行的, 因此在测量中出现负值。结构性状中植物高度、细根长、叶片厚度在采集后立刻测量, 用游标卡尺(精确到0.01 mm)测量叶厚度, 沿主叶脉方向上、中、下重复测量三次。叶面积的测量是用数码相机拍摄有网格纸当垫板的叶片照片, Photoshop软件处理照片后, 用Excel计算出叶面积,测量方法参照Cornelissen等关于植物功能性状测量的简易标准手册[11]。采集的植物样品在105 ℃杀青1 h后, 65 ℃烘干至恒重, 将植物粉碎后过100目筛制成供试样品。用元素分析仪(vario MACRO cube)测定叶片和植株的碳、氮含量, 微波消解仪 (Multiwave 3000)消解植物后用全自动间断化学分析仪(SmartChem 140)测定叶片和植株的磷含量, 文中各植物功能性状的缩写、单位和计算公式如表1所示。
Figure 1 Research area profile and sampling point location
1.3 数据处理
使用Excel 2007、SPSS 19对数据进行统计分析; 采用单因素方差(one-way ANOVA)分析优势种在功能群水平下不同植物功能性状在不同退化序列下的差异; 采用Pearson相关性检验(双尾检验)进行相关性分析; 应用Origin 2017软件制图。

表1 植物功能性状缩写、单位、计算公式
2 结果与分析
2.1 锡林河滨河带湿地植物功能性状在流域尺度上对环境的响应
2.1.1 湿地植物功能群划分
依据植物水生生态类型功能群将锡林河滨河带湿地植物物种划分为水生草本(Aquatic herb)、湿生草本(Hygrophilous herb)、湿中生草本(Mesic herb)、中生草本(Mesophilous herb)、旱生草本(Xerophilous herb)五种功能群。锡林河流域上游轻微退化、中游轻微退化、退化, 下游轻微退化、退化五个样地不同功能群的调查物种如表2所示。
2.1.2 湿地植物在不同河段的性状差异特征
在锡林河上游、中游、下游选取轻微退化样地进行采样测量, 由表3可知植物各性状在河流不同河段之间的差异情况。变异系数最小为0.05,变异系数为0.06, 说明两者作用相对稳定; 其余各性状值的变异系数均大于0.2;和变异系数最大, 分别为2.64和2, 说明其波动性较大;、、、的变异系数均大于1,、、、、、、、、、、、性状指标的变异系数在0.24和1之间。各性状的最大值和最小值之间差异较大。
2.1.3 湿地植物功能性状在流域尺度上对环境的响应
湿地植物功能性状是在长期适应环境过程中, 通过调节和改变叶片、细根部、植株的自身结构性状和营养物质含量形成了一系列适应特定环境的功能性状组合, 来达到改变资源利用效率的目的。由表4可知,与、、、呈显著正相关, 与、,、、、、、、呈显著负相关; 锡林河流域湿地植物叶片厚度增加时, 植物会增加叶片干重、增大叶片面积、提高植株总磷含量, 增强光合速率来适应外界环境的变化。与、、、呈显著正相关, 与、、呈显著负相关;与、、、、呈极显著正相关, 与、、、、、呈极显著负相关;与呈极显著负相关;与、呈显著负相关, 与、、、呈极显著负相关; 锡林河流域湿地植物比根长增大时, 植物会降低植物高度、减弱光合速率、减小叶面积、叶厚度、叶片干重和叶片磷含量以适应外界环境的变化。

表2 锡林河流域不同河段不同植物功能群调查物种
注: U为锡林河上游轻微退化样地; Mw为中游轻微退化样地; Mt为中游退化样地; Dw为下游轻微退化样地; Dt为下游退化样地

表3 锡林河流域不同河段湿地植物功能性状特征
2.2 锡林河滨河带湿地植物功能性状对放牧强度的响应
2.2.1 滨河带不同生态功能群植物功能性状对放牧强度的响应
株高因其直观和便捷在植物功能性状权衡中对放牧响应具有重要指示意义。如表5所示, 根据植物株高将锡林河流域中游河漫滩划分为轻微退化样地和退化样地。湿中生草本、中生草本、旱生草本植株高度在退化样地显著低于轻微退化样地。
如图2所示, 不同放牧强度下, 滨河带中生草本在退化样地显著高于轻微退化样地(<0.05) (图 2a)。湿生草本和旱生草本、湿中生草本在轻微退化和退化样地之间具有显著差异。 (图 2b, 2d), 四种水生生态功能群、在轻微退化与退化样地之间存在显著差异(图 2c, 2l), 湿生草本和湿中生草本和在轻微退化与退化样地之间有显著差异(图 2e, f)。湿生草本在轻微退化和退化样地有显著差异, 且退化样地大于轻微退化样地(图 2g)。湿中生草本在轻微退化和退化样地有显著差异, 且轻微退化样地大于退化样地(图 2h)。湿中生草本、中生草本、旱生草本, 均表现为退化样地显著低于轻微退化样地(图 2i)。湿生草本、中生草本、旱生草本在轻微退化与退化样地具有显著差异(图 2j)。湿中生草本和旱生草本在轻微退化和退化样地有显著差异(图 2k)。
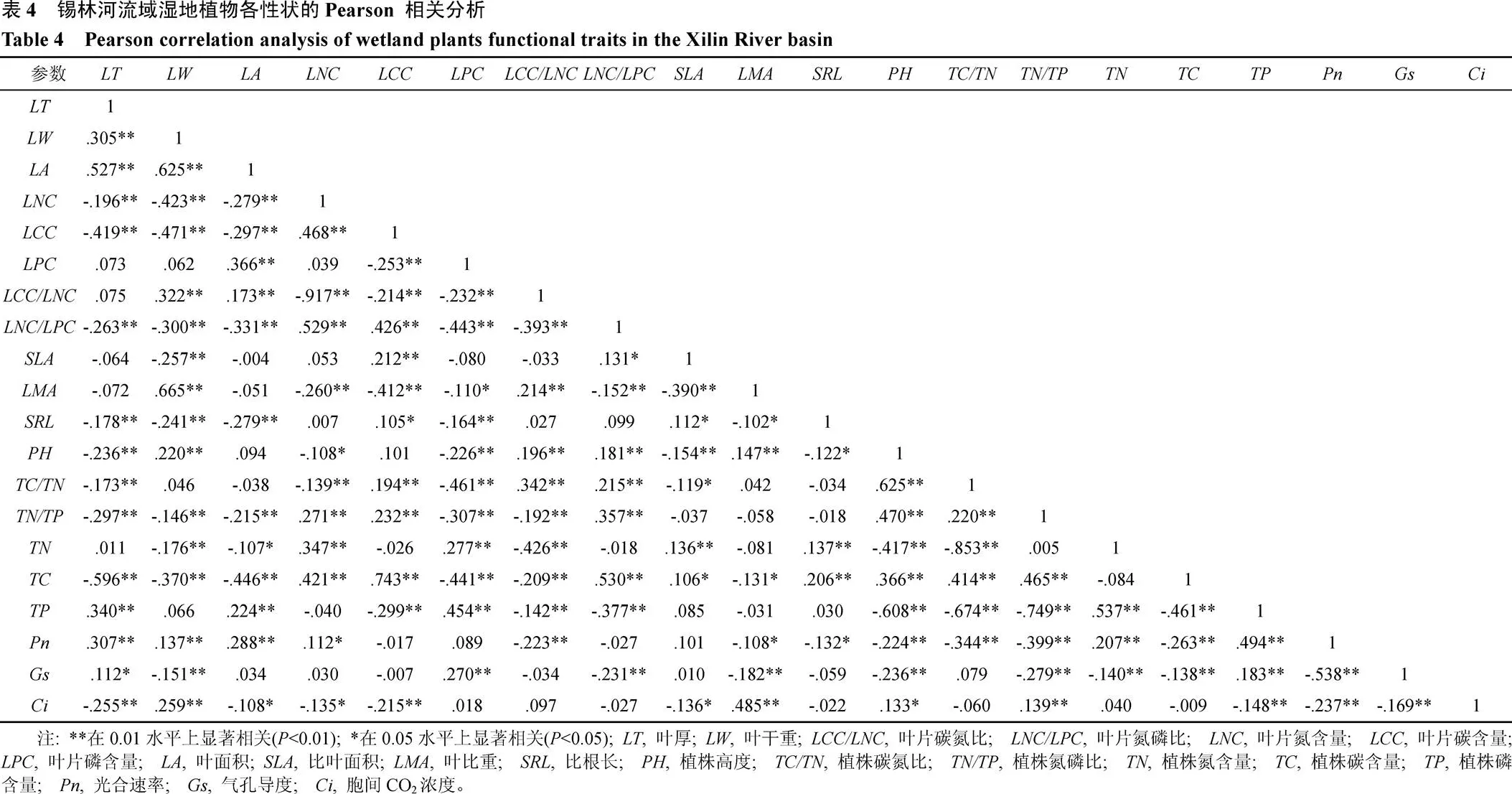

表5 锡林河流域中游河漫滩不同样地的植株高度(cm)
2.2.2 滨河带共有物种植物功能性状对放牧强度的响应
在滨河带两个放牧强度样地选取共有植物种芦苇、扁穗草、鹅绒委陵菜、小糠草、疗齿草。从图3中可以看出, 芦苇、鹅绒委陵菜、小糠草群落之间有显著差异, 且轻微退化样地叶面积均大于退化样地(图3 a); 扁穗草群落在退化样地显著高于轻微退化样地(图3b); 芦苇群落、鹅绒委陵菜群落在轻微退化样地显著高于退化样地, 扁穗草群落在退化样地显著高于轻微退化样地(图3c)。芦苇群落和鹅绒委陵菜群落有显著差异, 且均为退化样地高于轻微退化样地(图3d)。芦苇、扁穗草、小糠草群落在轻微退化样地显著高于退化样地(图3f), 轻微退化和退化样地五种共有物种植株高度之间均具有显著差异, 除疗齿草外均为轻微退化样地植物株高较高(图3g), 扁穗草、鹅绒委陵菜、小糠草、疗齿草群落植物光合速率均具有显著差异(图3h)。、在五种共有植物种之间均具有显著差异(图3i, j)。
3 讨论
3.1 锡林河流域不同河段植物功能性状的相互作用
锡林河流域不同河段植物各性状值的变异系数表明, 植物叶片碳含量表现的极为稳定(变异系数0.05),、、、、的变异系数在0—1之间, 这与道日娜[12]在内蒙古呼伦贝尔克氏针茅草原的研究结果一致。通过对锡林河流域不同河段植物各功能性状相关分析表明, 各功能性状之间关系密切, 说明植物在适应环境变化的过程中会通过各性状功能之间的相互作用实现对环境的适应。叶片是植物进行光合作用获取资源的主要器官, 作为能够联系植物生理适应性和环境梯度间桥梁的叶片功能性状,影响着叶片的水分供应、存储以及光合作用中物质和能量的交换过程[13]。研究表明, 锡林河流域滨河带湿地植物、、、与呈极显著正相关关系,、、、与呈极显著正相关关系。植物在干旱地区为适应水分胁迫环境形成相对较厚的表皮[14]和降低植物干重[15]防止水分过度流失。植物叶片和呈极显著正相关。张晶等[16]对科尔沁沙地典型草地植物功能性状研究也表明植物叶片碳氮含量呈极显著正相关。比叶面积是与植物生长和生存对策有紧密联系并且能反映植物对周围环境适应特征的重要指标[17-19]。冯秋红等[20]研究表明, 植物为适应多种共存的竞争环境, 在增大比叶面积时会增强光合速率。Bernard-Verdi等研究表明[21], 植物为高效地利用有限的资源, 在减小比叶面积时会增大叶片厚度和降低植物叶片的氮含量。在我们的研究中,与、、、呈显著负相关, 与、、呈极显著负相关, 与和呈极显著正相关, 比叶面积减小时植物通过增大比根长、增加植物叶片碳氮磷和植株碳含量、增强植物光合速率和气孔导度实现对环境的适应。植物通过根系获取水分和营养物质, 根系的吸收能力决定了植物的长势与繁殖。与、、、呈极显著负相关, 与含量呈极显著正相关, 与呈显著正相关; 钟巧连等对黔中喀斯特木本植物功能性状的研究表明, 比根长与比叶面积呈显著负相关[22]; 陈明月对鄱阳湖湿地22种常见植物的研究表明比根长与比叶面积呈显著正相关[23]。这是由于植物根系的分支较多, 不同级别的根性状在结构和功能上差异较大[24, 25], 从而导致这两种结构特征不平行性。植物氮磷比<14, 植物受到氮的制约; 植物氮磷比>16, 植物受磷的制约。锡林河流域各河段植物氮磷比最大值为12.07, 说明研究区滨河带湿地植物受到氮的制约, 环境中可以提供植物直接吸收和利用的活性氮比磷更少。不同的湿地植物功能性状属性值所表现出来的差异性以及不同属性值之间的相关性表明了湿地植物对于环境的适应策略, 通过性状间的互补与替代使植物更好的适应当前环境, 在有限的资源中合理分配。
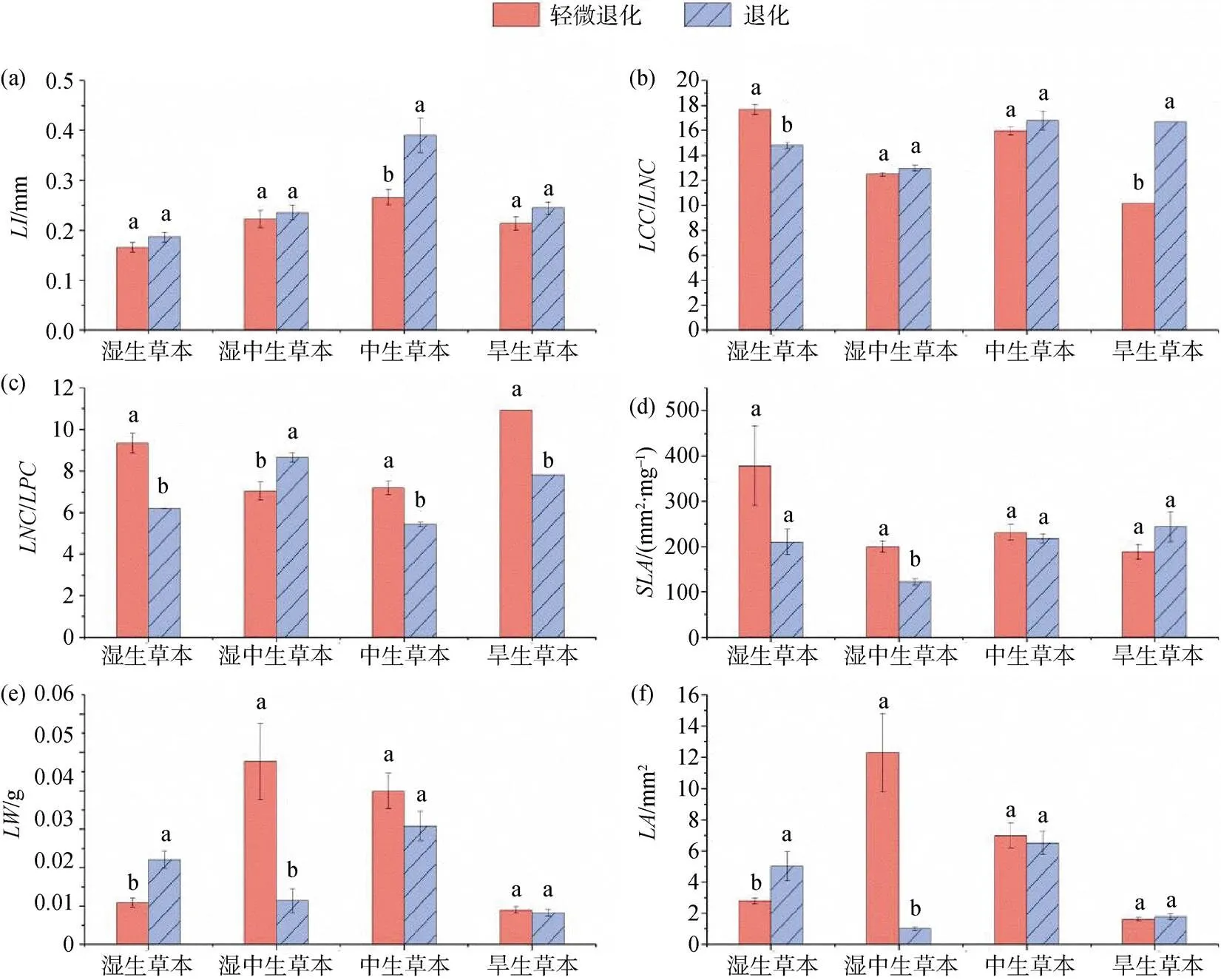
Figure 2 Variation in plant functional traits of different aquatic ecological functional groups in slightly degraded and degraded plots
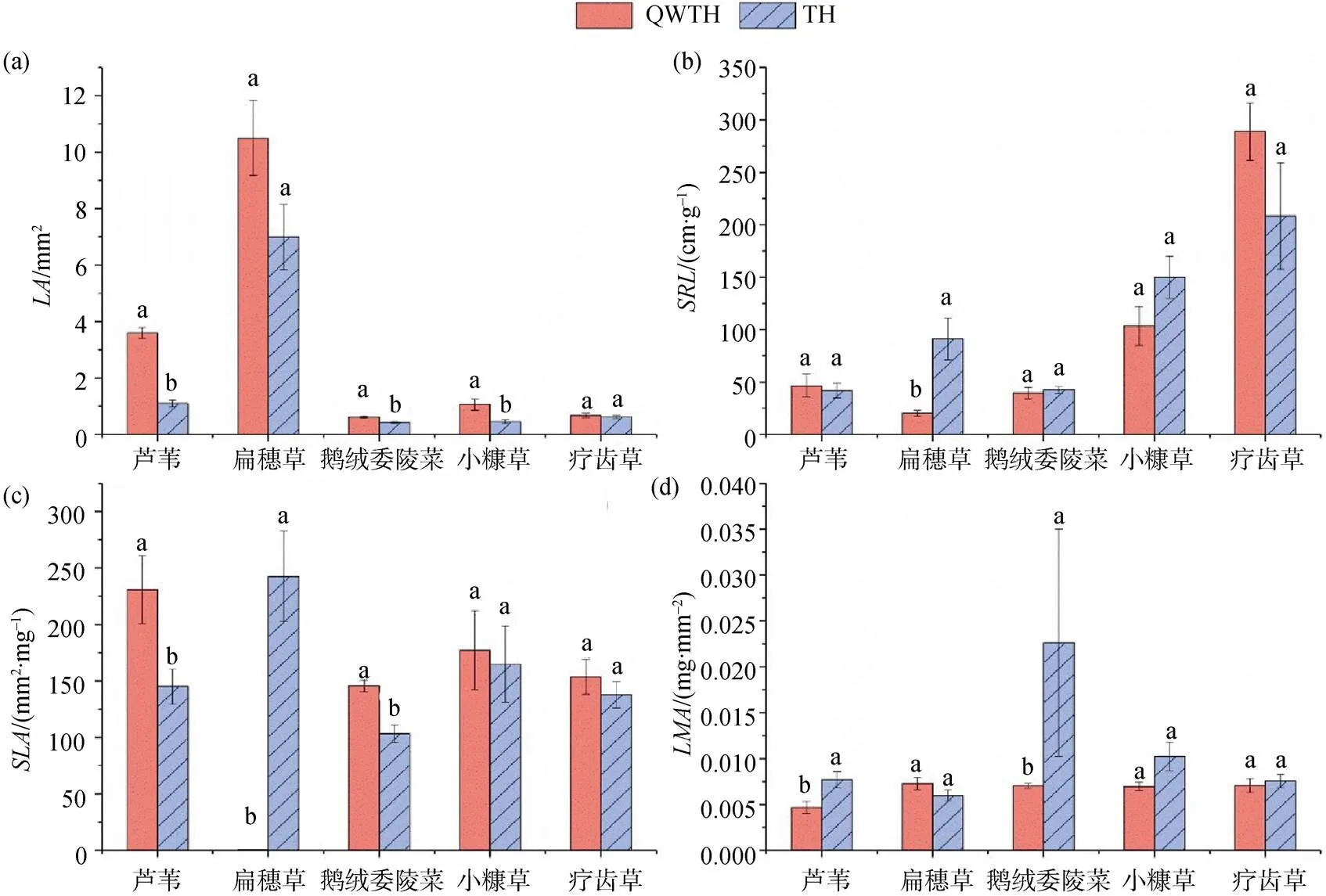
Figure 3 Variations in plant functional traits of common species in slightly degraded and degraded plots
3.2 锡林河流域植物功能性状对放牧的适应策略
植物功能群是对环境有相同响应和对主要生态系统过程有相似作用的物种组合[26], 能够反映植被随环境动态变化[27], 有效的解释生态系统构建机制[28]。植物通过功能性状的改变来表达其对环境的耐受度和对生境的需求, 进而决定物种在何处生存、与其他物种产生何种关系以及对生态系统功能的贡献[29]。植物高度影响植物获取光源、热量负荷、湿度和种子扩散。为达到生产力的最大化, 在放牧胁迫下植物会将体内营养物质运输到地下部分或增加单位根系干物质含量[30], 地上部分因得不到充足的养分供应导致植株变矮; 同时植物为躲避牲畜的采食也会产生个体小型化[31-32]。在放牧影响下, 滨河带湿地植物在不同功能群湿中生、中生、旱生群落、共有植物种芦苇、扁穗草、鹅绒委陵菜、小糠草中, 退化样地植物高度均小于轻微退化样地。放牧导致植物矮小化过程中, 不同阶段叶片具有不同适应对策[33]。放牧干扰下, 作为植物重要功能器官的植物叶片先表现出反应, 进而将干扰效应传递给其它器官, 并驱动整个植株的反应。湿生草本和湿中生草本的和在轻微退化和退化样地之间有显著差异。湿中生草本的和在轻微退化和退化样地有显著差异。湿生、中生、旱生草本的、在轻微退化和退化样地之间具有显著差异。通过植物功能性状分析锡林河流域湿地植物水分生态类型功能群在不同样地的差异特征, 可以认识环境变化及放牧人为干扰对滨河带湿地生态系统的影响及变化趋势。适度的动物采食可以刺激叶片再生生长, 新叶生产能力提高, 叶片衰老时间发生推迟[34], 过度放牧后植物叶片受损, 影响光合作用导致光合产物减少, 使植物资源分配策略改变, 植物功能性状之间为适应环境变化产生级联效应[35]。研究样地五种共有植物的、、在轻微退化和退化样地之间具有显著差异, 芦苇、扁穗草、鹅绒委陵菜群落在轻微退化和退化样地之间有显著差异, 芦苇、鹅绒委陵菜、小糠草群落在轻微退化和退化样地之间有显著差异, 芦苇、扁穗草、鹅绒委陵菜、小糠草群落在轻微退化和退化样地之间有显著差异。通过对不同退化样地植物功能性状的研究表明, 放牧驱动下植物功能性状发生了改变, 且在不同的植物种间表现不同, 这也验证了相关学者基于植物性状的植物群落构建理论[36-37], 既在特定环境, 与其他群落物种相比, 群落内的物种具有性状趋同性[38], 构成群落的物种个体之间存在差异。李西良等[39]对草甸草原羊草茎叶功能性状对长期过度放牧的影响表明, 在放牧干扰下羊草性状之间表现协同变化机制, 矮化型变是羊草的避牧适应对策, 放牧是羊草表型变异的重要调控因子。相关学者在内蒙古草原生态系统研究站放牧草地研究表明[40], 地上生物量显著降低后, 在演替早期根系形态特征没有明显变化, 根系性状表现出滞后效应和稳定效应[41]。本研究中只有在中游的湿中生草本群落有显著差异。
4 结论
本文以内蒙古草原区锡林河流域滨河带湿地为研究对象, 探讨了锡林河流域上游、中游、下游不同河段以及在放牧干扰下湿地植物功能性状对环境变化的响应, 结果表明锡林河流域叶性状间均存在相关性, 不同器官间的结构性状与生理性状也存在一定相关性, 比叶面积减小时植物通过增大比根长、增强植物光合速率和气孔导度、增加叶片碳、氮、磷和植株碳含量实现对环境的适应。湿地退化后植物通过增加叶厚度以实现放牧逃避。放牧干扰下湿地植物通过改变自身的养分利用策略实现对放牧的响应, 以最大程度规避放牧的影响。
[1] 王立新. 内蒙古草原区河流河滨带湿地植被分布格局、过程与功能研究[D]. 呼和浩特: 内蒙古大学, 2012.
[2] 王立新, 刘华民, 刘玉虹, 等. 河流景观生态学概念、理论基础与研究重点[J]. 湿地科学, 2014, 12(2): 228–234.
[3] CARMONA D, LAJEUNESSE M J, JOHNSON M T J. Plant traits that predict resistance to herbivores[J]. Functional Ecology, 2011, 25(2): 358–367.
[4] LAVOREL S, GRIGULIS K, LAMARQUE P, et al. Using plant functional traits to understand the landscape distribution of multiple ecosystem services[J]. Journal of Ecology, 2011, 99(1): 135–147.
[5] FARRISH K W. Spatial and Temporal Fine-Root Distribution in Three Louisiana Forest Soils[J]. Soil Science Society of America Journal, 1991, 55(6): 1752–1757.
[6] 李西良, 刘志英, 侯向阳, 等. 放牧对草原植物功能性状及其权衡关系的调控[J]. 植物学报, 2015, 50(2): 159–170.
[7] 张雪妮, 李岩, 何学敏, 等. 荒漠植物功能性状及其多样性对土壤水盐变化的响应[J]. 生态学报, 2019, 39(5): 1541–1550.
[8] 周鹏, 耿燕, 马文红, 等. 温带草地主要优势植物不同器官间功能性状的关联[J]. 植物生态学报, 2010, 34(1): 7–16.
[9] 唐艳. 东北主要温带植物叶性状的种间差异及其相关关系[D]. 哈尔滨: 东北林业大学, 2011.
[10] 张杰, 李敏, 敖子强, 等. 基于CNKI的植物功能性状研究进展文献计量分析[J]. 江西科学, 2018, 36(2): 314–318.
[11] CORNELISSEN J H C, LAVOREL S, GARNIER E, et al. A handbook of protocols for standardised and easy measurement of plant functional traits worldwide[J]. Australian Journal of Botany, 2003, 51(4): 335–380.
[12] 道日娜. 放牧对克氏针茅()草原植物性状、功能群与生产力的影响[D]. 呼和浩特: 内蒙古大学, 2016.
[13] SCOFFONI C, RAWLS M, MCKOWN A, et al. Decline of Leaf Hydraulic Conductance with Dehydration: Relationship to Leaf Size and Venation Architecture[J]. Plant Physiology, 2011, 156(2): 832–843.
[14] CUNNINGHAM S A, SUMMERHAYES B, WESTOBY M. Evolutionary divergences in leaf structure and chemistry, comparing rainfall and soil nutrient gradients[J]. Ecological Monographs, 1999, 69(4): 569–588.
[15] OHASHI Y, NAKAYAMA N, SANEOKA H, et al. Effects of drought stress on photosynthetic gas exchange, chlorophyll fluorescence and stem diameter of soybean plants[J]. Biologia Plantarum, 2006, 50(1): 138–141.
[16] 张晶, 左小安, 吕朋, 等. 科尔沁沙地典型草地植物功能性状及其相互关系[J]. 干旱区研究, 2018, 35(1): 137–143.
[17] MEZIANE D, SHIPLEY B. Interacting determinants of specific leaf area in 22 herbaceous species: Effects of irradiance and nutrient availability[J]. Plant Cell and Environment, 1999, 22(5) : 447–459.
[18] POORTER H, DE JONG R. A comparison of specific leaf area, chemical composition and leaf construction cost of field plants from 15 habitats differing in productivity[J]. New Phytologist, 1999, 143(1): 163–176.
[19] GARNIER E, SHIPLEY B, ROUMET C, et al. A standardized protocol for the determination of specific leaf area and leaf dry matter content[J]. Functional Ecology, 2001, 15(5): 688–695.
[20] 冯秋红, 史作民, 董莉莉. 植物功能性状对环境的响应及其应用[J]. 林业科学, 2008, 44(4), 125–131.
[21] BERNARD-VERDIER M, NAVAS M L, VELLEND M, et al. Community assembly along a soil depth gradient: Contrasting patterns of plant trait convergence and divergence in a Mediterranean rangeland[J]. Journal of Ecology, 2012, 100(6): 1422–1433.
[22] 钟巧连, 刘立斌, 许鑫, 等. 黔中喀斯特木本植物功能性状变异及其适应策略[J]. 植物生态学报, 2018, 42(5): 50–60.
[23] 陈明月. 鄱阳湖典型湿地常见植物根系性状及与叶性状关联研究[D]. 南昌: 江西师范大学, 2018.
[24] COMAS L H, EISSENSTAT D M. Linking fine root traits to maximum potential growth rate among 11 mature temperate tree species[J]. Functional Ecology, 2004, 18(3): 388–397.
[25] GUO D L, MITCHELL R J, HENDRICKS J J. Fine root branch orders respond differentially to carbon source-sink manipulations in a longleaf pine forest[J]. Oecologia, 2004, 140(3): 450–457.
[26] DIAZ S, CABIDO M. Plant functional types and ecosystem function in relation to global change[J]. Journal of Vegetation Science, 1997, 8(4): 463–474.
[27] 唐海萍, 蒋高明. 植物功能型及其生态学意义[J]. 应用生态学报, 2000, 11(3): 143–146.
[28] DIAZ S, CABIDO M, ZAK M, et al. Plant functional raits, ecosystem structure and land-use history along a climatic gradient in central-western Argentina[J]. Journal of Vegetation Science, 1999, 10(5): 651–660.
[29] CADOTTE M W, CARSCADDEN K, MIROTCHNICK N. Beyond species: functional diversity and the maintenance of ecological processes and services[J]. Journal of Applied Ecology, 2011, 48(5): 1079–1087.
[30] WESTOBY M, FALSTER D S, MOLES A T, et al. Plant ecological strategies: Some leading dimensions of variation between species[J]. Annual Review of Ecology and Systematics, 2002, 33, 125–159.
[31] 王炜, 梁存柱, 刘钟龄, 等. 草原群落退化与恢复演替中的植物个体行为分析[J]. 植物生态学报, 2000, 24(3), 268–274.
[32] 李建玮, 王立新, 王炜, 等. 内蒙古高原典型草原区河漫滩湿地植物群落退化表征[J]. 植物生态学报, 2012, 36(1), 10–18.
[33] CRUZ P, DE QUADROS F L F, THEAU J P, et al. Leaf traits as functional descriptors of the intensity of continuous grazing in native grasslands in the south of Brazil[J]. Rangeland Ecology & Management, 2010, 63(3): 350–358.
[34] MCINTIRE E J B, HIK D S. Grazing history versus current grazing: leaf demography and compensatory growth of three alpine plants in response to a native herbivore ()[J]. Journal of Ecology, 2001, 90(2), 348–359.
[35] 李西良, 刘志英, 侯向阳, 等. 放牧对草原植物功能性状及其权衡关系的调控[J]. 植物学报, 2015, 50(2), 159–170.
[36] DIAZ S, CABIDO M, CASANOVES F. Plant functional traits and environmental filters at a regional scale[J]. Journal of Vegetation Science, 1998, 9(1): 113–122.
[37] DIAMOND J M. Assembly of Species Communities[M]. Cambridge: USA Harvard University Press, 1975: 342–444.
[38] GRIME J P. Trait convergence and trait divergence in herbaceous plant communities: mechanisms and consequences[J]. Journal of Vegetation Science, 2006, 17(2): 255–260.
[39] 李西良, 侯向阳, 吴新宏, 等. 草甸草原羊草茎叶功能性状对长期过度放牧的可塑性响应[J]. 植物生态学报, 2014, 38(5): 440–451.
[40] GAO Y Z, GIESE M, LIN S, et al. Belowground net primary productivity and biomass allocation of a grassland in Inner Mongolia is affected by grazing intensity[J]. Plant Soil, 2008, 307(1–2): 41–50.
[41] MILCHUNAS D G, VANDEVER M W. Grazing effects on aboveground primary production and root biomass of early-seral, mid-seral, and undisturbed semiarid grassland[J]. Journal of Arid Environments. 2013, 92, 81–88.
Study on the functional traits and differences of wetland plants in Xilin River Basin
KOU Xin1, LIU Huamin1, 2, 3, ZHANG Jinghui1, 2, 3, YUAN Pengyun1, CAO Xiaoai1, WEN Lu1, 2, 3, YU Xiaowen1, LIU Dongwei1, 2, 3, WANG Lixin1, 2, 3,*
1. College of Ecology and Environment, Inner Mongolia University, Hohhot 010021, China 2. Collaborative Innovation Center for Grassland Ecological Security (Jointly Supported by the Ministry of Education of China and Inner Mongolia Autonomous Region), Hohhot 010021, China 3. Ministry of Education Key Laboratory of Ecology and Resource Use of the Mongolian Plateau, Hohhot 010021, China
The riparian zone, as an interface or an ecological transition zone between the river water system and adjacent land, is an important part of the river landscape. Wetland plants and their communities play an important role in maintaining stability and function of wetland ecosystems. In this paper, 20 functional traits of wetland plants in the upper, middle and lower reaches of the Xilin River basin and under grazing disturbance were compared to explore the response of plant functional traits to environment and grazing intensity on the basin scale. The results showed that the variation range of functional traits of wetland plants in different reaches of Xilin River was large, the minimum coefficient of variation in leaf carbon content was 0.05 and the largest coefficient of variation was the photosynthetic rate with a value of 2.64. The structural traits and physiological traits of wetland plants could be adapted to the environment through complementation and substitution, and functional balance changes. The plant height of Mesic herb, Mesophilous herb and Xerophilous herb was significantly lower than that in the slightly degraded plot. The plant height and leaf LCC/LNC (leaf carbon concentration/leaf nitrogen concentration) and LNC/LPC(leaf nitrogen concentration/leaf phosphorus concentration) were significantly different among the five common plant species:,,,,. Under different grazing gradients in the Xilin River basin, the response of plant functional traits to different degradation levels was not consistent, either at the functional group level or at the plant common species level.
Xinlin River basin; riparian; plant functional traits; grazing interference
10.14108/j.cnki.1008-8873.2024.01.016
S812
A
1008-8873(2024)01-134-12
2021-08-24;
2021-11-01基金项目:国家自然科学基金项目(32160279, 32161143025, 31960249); 内蒙古自治区重点研发和成果转化项目(2022YFHH0017); 内蒙古科技重大专项项目(2021ZD0011)
寇欣(1993—), 女, 博士研究生, 主要从事湿地生态学研究, E-mail: 923575436@qq.com
通信作者:王立新(1975—), 男, 教授、博士生导师, 主要从事湿地科学研究, E-mail: Lxwimu@foxmail.com
寇欣, 刘华民, 张景慧, 等. 锡林河流域滨河带湿地植物功能性状及差异研究[J]. 生态科学, 2024, 43(1): 134–145.
KOU Xin, LIU Huamin, ZHANG Jinghui, et al. Study on the functional traits and differences of wetland plants in Xilin River Basin[J]. Ecological Science, 2024, 43(1): 134–145.
