近红外二区小动物活体荧光成像系统的研制*
2024-04-27邬丹丹潘力周哲付威威朱海龙董月芳
邬丹丹 潘力 周哲 付威威† 朱海龙 董月芳‡
1) (中国科学院苏州生物医学工程技术研究所,医学影像技术研究室,苏州 215163)
2) (苏州国科视清医疗科技有限公司,苏州 215163)
近年来,小动物活体荧光成像系统被广泛应用于生物医学成像研究.但是,现有的荧光成像系统存在穿透深度有限、图像信噪比低等缺点.因此,利用近红外二区(near-infrared-II,NIR-II,900—1880 nm)荧光成像技术在生物组织中具有的低吸收、低散射和穿透深度深等优点,研制出一套NIR-II 小动物活体荧光成像系统,提出了一种荧光图像增强校正方法,并设计生物组织模拟实验和活体动物实验测试该系统的性能和成像效果.实验结果表明,该系统具有穿透深度深、信噪比高、灵敏度高等优点.结合商用的吲哚菁绿试剂和聚集诱导发光染料,该系统可实时监测小鼠体内的血管分布情况,并对深层组织器官进行持续监测,实现活体小鼠清醒状态下的动态监测研究,有助于推动生物医学成像领域的肿瘤研究和药物开发研究等进入一个新阶段.
1 引言
光学成像技术通过利用光线在生物组织内的传播特性,实现对生物组织的实时监测,具有无电离辐射、安全性高、可视化等优势.活体光学成像主要包括生物发光成像和荧光成像,其中生物发光是通过荧光素酶基因标记细胞或活体动物,利用其产生的蛋白酶与底物荧光素发生生物化学反应,产生光学信号;荧光成像是通过荧光蛋白、荧光染料、量子点及稀土纳米粒子等进行标记,利用外界光源激发产生荧光信号.相比生物发光成像,荧光成像技术的标记能力和光学信号更强,可以实时监测活体动物体内的基因和细胞变化,具有高分辨率、非侵入、操作简单、成像直观、无创等显著优点[1,2],广泛应用于肿瘤研究、基因表达研究、药物开发研究等.
传统的荧光成像位于可见光波段(400—760 nm),此波段内生物组织存在严重的自身荧光,并且对光子的吸收和散射作用较强,导致荧光成像的信噪比和穿透深度较低(1—2 mm),难以获取活体动物体内深层组织的生物信息[3].当荧光成像窗口扩展到近红外一区(near-infrared-I,NIR-I,760—900 nm),生物组织对光的吸收和散射作用以及生物组织的自身荧光有所降低,提高了NIR-I 荧光成像的穿透深度,但是仍未满足临床应用需求[4].2009 年,Welsher 等[5]通过检测“交换”单壁碳纳米管的固有近红外光致发光,首次实现了大于1000 nm的近红外活体荧光成像.从此,近红外二区(nearinfrared-II,NIR-II,900—1880 nm)活体荧光成像成为研究的一大热点[6-8].与可见光和NIR-I 荧光成像相比,NIR-II 荧光成像由于光子波长更长,进一步抑制了光在生物组织内传播时的吸收和散射作用,并且生物组织的自身荧光也随着波长的增大显著下降[9],因此NIR-II 荧光成像的深度大大提高、分辨率和信噪比也较高,更利于活体动物体内深层组织的生物信息监测[10].
近年来,随着荧光探针和成像仪器的不断开发和改进,研究者们围绕NIR-II 活体荧光成像在生物医学成像领域进行了丰富的科学探索和应用研究,如美国国立卫生研究院陈小元教授团队[11]开发了一种多重NIR-II 活体成像系统,利用具有显著抑制的光子散射和零自发荧光的NIR-II 探针实现转移性肿瘤的可视化;浙江大学钱骏教授团队与舜宇光学公司合作开发了一种正置NIR-II 荧光显微成像系统,已应用于宫颈癌治疗[12]等领域.本文基于NIR-II 荧光成像的原理机制,自主研制了一套NIR-II 荧光成像系统.利用商用的吲哚菁绿(indocyanine green,ICG) 试剂和聚集诱导发光(aggregation-induced emission,AIE) 染料,通过小鼠实验实际验证该系统的荧光成像效果.结果表明,该系统具有穿透深度深、信噪比高、灵敏度高的优点,可以实时监测小鼠体内的血管网络分布,对小鼠的深层组织器官进行长期监测,实现活体小鼠清醒状态下的动态监测研究.
2 NIR-II 活体荧光成像
2.1 荧光成像的原理机制
荧光是一种光致发光的冷发光现象,如图1 所示,荧光物质受到外界光源激发,当光子的能量为分子中某两个能级间的能量差时,荧光物质的核外电子会吸收能量,从基态的最低振动能级跃迁到能量较高的高能级(第一或第二激发单重态中各个不同振动-转动能级),此时电子处于不稳定的激发态,会通过内部转换和振动弛豫等非辐射跃迁的方式快速降落至激发单重态的最低振动能级,随后通过辐射跃迁的方式从最低振动能级返回基态,以光子形式释放能量,发射出荧光信号.荧光信号在生物组织内经过吸收和散射作用后,被光学探测器捕获,经过放大处理后传输到电脑中,得到荧光图像,这就是荧光成像的原理.

图1 荧光成像示意图Fig.1.Schematic diagram of fluorescence imaging.
显然,荧光成像的关键点在于荧光物质和荧光信号的采集及处理.通常,利用光学探测器将光信号转换为便于存储和处理的电信号,实现荧光信号的采集及处理.传统的光学探测器是硅基探测器,具有制造工艺成熟和可靠性高等优点[13],但是灵敏度较差,并且硅的带隙能量(1.124 eV)导致硅基探测器的响应波长通常不高于1100 nm,局限在可见光和NIR-I 波段.为了扩展光学探测器的响应波长,近年来出现了使用飞秒激光等技术制备的黑硅探测器[14-16]、窄带隙半导体合金碲镉汞(mercury cadmium telluride,HgCdTe)探测器[17]以及短波红外铟镓砷(indium gallium arsenide,InGaAs)探测器.其中,黑硅探测器在红外波段的响应度仍然未能满足应用需求,HgCdTe 探测器的制造成本高,需要工作在低温条件下[18],并且HgCdTe 材料对人体的毒性很大,因此应用局限性较大;InGaAs探测器的响应波长范围为900—1700 nm,具有工艺成熟、高量子效率、低功耗、低成本等优点,广泛应用于生物医学成像、空间遥感、天文等领域[19,20],可以实现高分辨率、高灵敏度的NIR-II 荧光成像.
2.2 NIR-II 荧光成像的独特优势
生物组织是一种混浊介质,光子在其中传播时同时存在着吸收和散射作用,如图2 所示.光在生物组织内的吸收和散射作用会导致能量损耗,衰减荧光信号,其中,光的吸收决定了荧光信号的强度能否被探测到,而光的散射会降低荧光图像的清晰度[21];同时,生物组织的自身荧光也会影响到荧光图像的信噪比和分辨率.因此,为了获取高质量的荧光成像效果,应尽可能降低激发光在生物组织内的吸收和散射作用,以及可忽略生物组织的自身荧光.
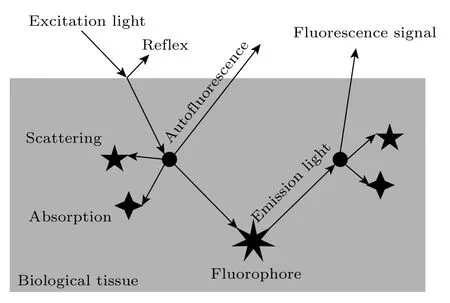
图2 生物组织的吸收和散射作用Fig.2.Absorption and scattering of biological tissues.
生物组织中光的吸收主要是由于水、血液中的脱氧血红蛋白(deoxyhemoglobin,Hb)和氧合血红蛋白(oxyhemoglobin,HbO2)、黑色素[22]等导致.在NIR-II 波段,除1400—1500 nm 处存在的吸收峰外,其他波段内的吸收均较小,对荧光信号的衰减小.血红蛋白在可见光区域存在较高的吸收峰,在NIR-II 波段内的光吸收较小,更利于荧光信号在生物组织内的传播[1].在400—1700 nm 范围内,随着波长的增大,不同生物组织(如脑组织、皮下组织、肌肉)的散射系数呈现出指数性降低的趋势[1],因此生物组织在在NIR-II 波段内的散射作用普遍较小,几乎可以忽略不计.此外,生物组织的自身荧光主要集中在可见光区域和NIR-I 波段,在NIR-II 波段,生物组织的自身荧光较小,可以忽略不计[9].综上,相比可见光区域和NIR-I 波段,生物组织在NIR-II 波段的吸收和散射作用较小,并且可以忽略自身荧光,因此NIR-II 荧光成像具有更大的穿透深度、更高的图像信噪比,更利于生物组织的深度成像检测.
3 NIR-II 荧光成像系统
3.1 系统的设计搭建
基于荧光成像的原理机制,采用反射型成像方式搭建NIR-II 荧光成像系统,其结构示意图如图3(a)所示,活体小动物被固定在恒温台(维持小动物生命体征)上,通过麻醉面罩对其进行持续麻醉,小动物体内已注射荧光试剂或染料,受到外界激发光源照射后发射出荧光信号.荧光信号经过生物组织的吸收和散射作用后到达组织表面,再经过发射滤光片和镜头后被探测器接收,最后传入电脑,处理得到荧光图像.
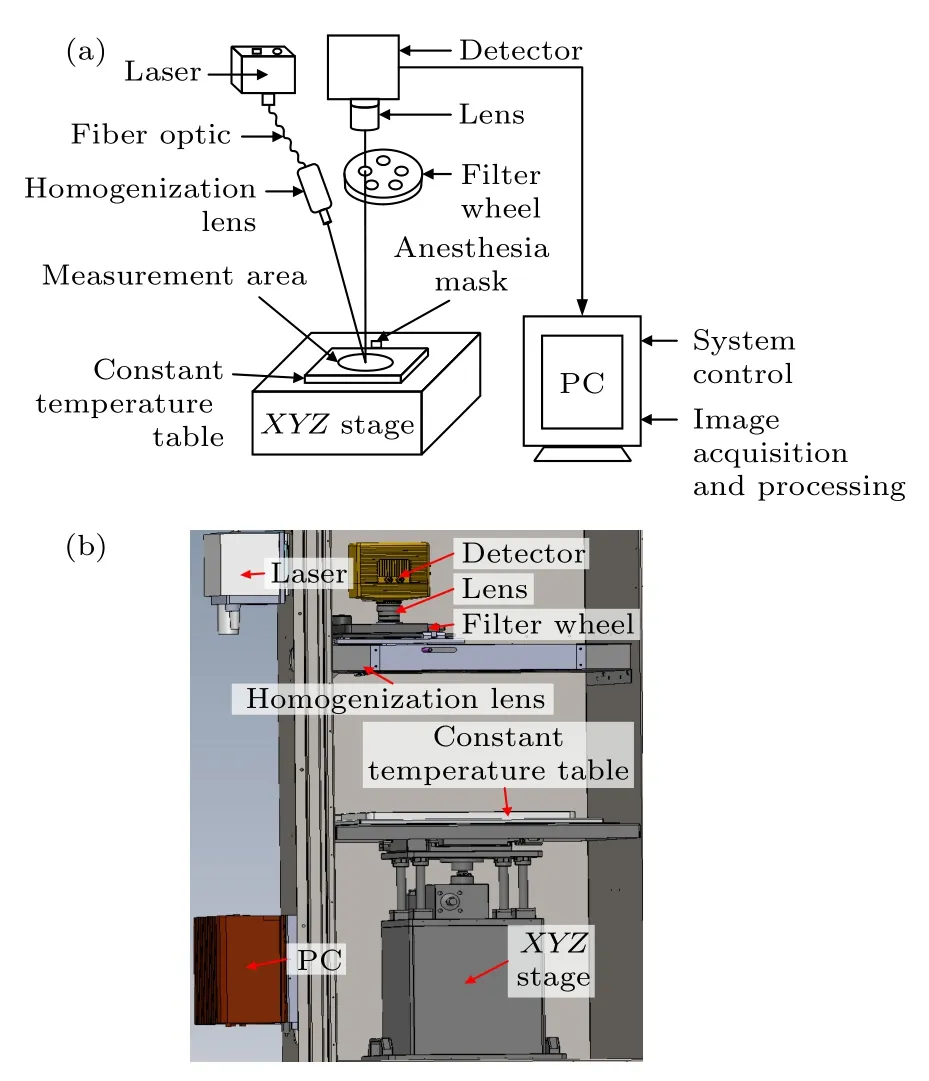
图3 NIR-II 荧光成像系统 (a) 系统结构示意图;(b) 系统三维效果图Fig.3.NIR-II fluorescence imaging system: (a) Schematic diagram of system;(b) 3D design of system.
本系统采用InGaAs 探测器采集荧光信号,该探测器为Raptor Photonics 公司生产的深度制冷近红外探测器,光谱响应范围为900—1700 nm,制冷温度可达-80 ℃,图像像素数量为640×512 pixel,像元尺寸为15 μm,成像速度最快可达97 frames/s.激发光源采用808 nm 高功率半导体激光器(功率0—15 W 可调,功率稳定性rms <3 %),为了使激光器出射的光斑尺寸可以覆盖小鼠,通过匀化镜头对其进行扩束和均匀处理,处理后的均匀光斑直径超过10 cm,可满足小鼠成像尺寸要求.成像镜头采用优质低畸变短波红外镜头,其焦距为40 mm,光圈范围为F2.8—F16,在900—1400 nm 波段内透射率超过94%.发射滤光片采用进口优质长波通滤光片,截止深度OD 值大于5,用于消除激发光源对发射荧光信号的干扰.最终设计搭建的NIR-II荧光成像系统的三维效果图如图3(b)所示.
荧光探针作为荧光成像的关键要素,以荧光物质作为指示剂,通常由识别基团、荧光基团及连接臂组成.目前,NIR-II 荧光探针可以分为无机和有机两大类,与无机荧光探针相比,有机荧光探针具有生物相容性高、毒性小、光学特性可调等优点.有机荧光探针主要包括小分子荧光探针、聚集诱导发光纳米颗粒和共轭聚合物,其中小分子荧光探针具有高灵敏度、低毒性、较高的临床转化潜力等显著优点[23].比如,NIR-I 小分子荧光探针ICG 已经通过美国食品药品监督管理局(Food and Drug Administration,FDA)的认证,被广泛应用于临床研究.近年来,研究者们发现ICG 具有较强的NIR-II 拖尾荧光发射,为NIR-II 荧光成像的临床应用提供了新的研究方向[24].此外,为解决有机荧光团常发生的聚集荧光猝灭(aggregation-caused quenching,ACQ)问题,2001 年,唐本忠院士团队[25]提出了AIE 的概念,此后AIE 分子的设计和开发成为研究的一大热点.相比传统的荧光染料,AIE 荧光染料具有高亮度、光稳定性强、生物安全性高等优点.近年来,可用于NIR-II 荧光成像的AIE 染料也逐渐被开发出来[26].因此,本系统采用具有代表性的商用的ICG 试剂(USP 标准品,CAS NO.3599-32-4)和AIE 染料(AIE1010 荧光纳米颗粒)进行成像研究(对其他染料同样适用,如稀土材料、金属纳米团簇探针等,已于系统前期研制过程中进行相关成像研究).
3.2 荧光信号采集与处理
荧光成像系统采集的原始荧光图像的对比度往往不高,并且由于光源照射不均匀、热效应、探测器暗电流噪声和读出噪声等可能存在雾状噪声及背景噪声,这些噪声会影响荧光图像的成像质量并干扰荧光信号的观测效果.为了增强灰度图像显示效果,去除图像噪声并尽可能保留有效荧光信号,提出了一种荧光图像增强和校正方法,具体流程如图4(a)所示.实际应用中,通常采用自动色阶算法对荧光图像进行对比度拉伸,增强灰度图像中的微弱荧光信号,但是图像中存在较高灰度值的有效荧光信号时,采用同一比例拉伸图像可能会导致过度增强现象,损失部分有效荧光信号.因此,基于自动色阶算法提出自适应对比度拉伸算法,其简要步骤如下.
2.1 患者一般情况及手术方式 两组患者一般情况及合并手术方式如表1所示。骶骨固定术组年龄、绝经概率及术前SUI概率显著低于改良全盆底重建组,差异有统计学意义,骶骨固定术组手术前3个月内有性生活概率显著高于改良全盆底重建组,骶骨固定术组中71例患者合并有阴道前及(或)后壁脱垂,改良全盆底重建组中72例合并有阴道前及(或)后壁脱垂,均给予相应的修补手术治疗。骶骨固定组中,41例SUI患者中36例接受了TVT-O手术;改良全盆底重建组中,53例SUI患者中37例接受了TVT-O手术。见表1。
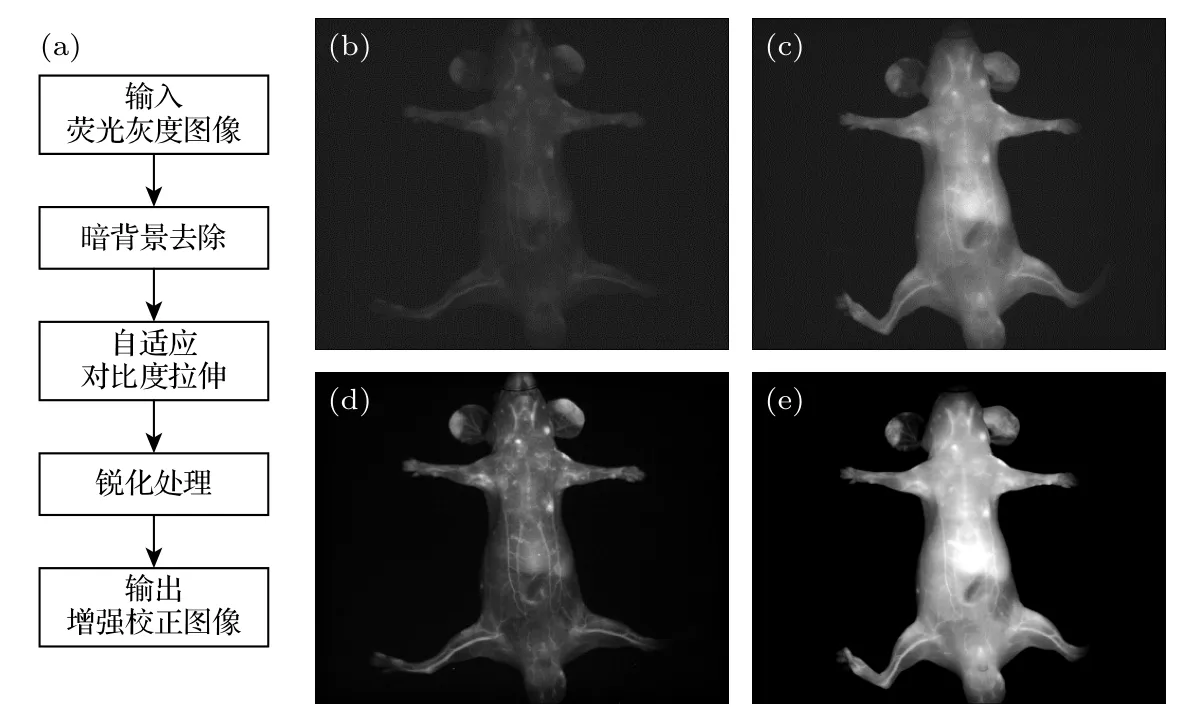
图4 荧光图像处理 (a) 流程图;(b) 原始低荧光图像;(c) 原始高荧光图像;(d) 图(b)的增强图像;(e) 图(c)的增强图像Fig.4.Fluorescence image processing: (a) Flow chart;(b) original low fluorescence image;(c) original high fluorescence image;(d) enhanced image of Fig.(b);(e) enhanced image of Fig.(c).
1)对原始荧光图像进行直方图统计,计算得到各灰度级的像素个数及累积分布函数;通过预设的截断比例对直方图进行左右截断,剔除相应的图像像素;统计截断后图像数据中的最小和最大灰度值,分别作为黑场阈值Gmin和白场阈值Gmax.
2)当荧光图像中不存在较高灰度值的有效荧光信号时(图像最大灰度值Max 不超过灰度级×0.6 时认为不存在),将不超过Gmin的像素灰度值置为0,其他像素灰度值拉伸至[0,M]范围,M为图像灰度级.
3)当荧光图像中存在较高灰度值的有效荧光信号时(图像最大灰度值Max 大于灰度级×0.6 时认为存在),通过迭代阈值法计算得到原始荧光图像的最优阈值Gt,将其与白场阈值Gmax的均值设为C1,并定义C2=Gt×1.5,C2在(Gmin,Gmax)范围内时将C2作为中间阈值Gmid;反之,Gt在(Gmin,Gmax)范围内时将C1作为Gmid,Gt未在(Gmin,Gmax)范围内时将Gmin与Gmax的均值作为Gmid.定义Vmid=M×(Gmid-Gmin)/(Gmax-Gmin),适当放大Vmid后作为Gmid的映射灰度值Gpoint,根据经验将放大系数定为1.2.将不超过Gmin的像素灰度值置为0,(Gmin,Gmid]范围内的像素灰度值拉伸至(0,Gpoint]范围,(Gmid,Gmax)范围内的像素灰度值拉伸至(Gpoint,M)范围,不小于Gmax的像素灰度值设置为M.
针对不同灰度分布的荧光图像进行自适应对比度拉伸,可以较好地增强灰度图像中的微弱荧光信号,提升灰度图像中荧光信号的整体亮度,并避免由于过度拉伸导致部分荧光信号过度增强的情况,优化荧光信号观测效果.此外,为了去除荧光图像中的背景噪声,通常在当前曝光时间下采集暗背景图像,将原始荧光图像与之相减实现暗背景快速扣除.实际应用中,为了提高图像处理效率,取最优阈值Gt的一半作为背景值dark,以扣除图像背景,并保留低荧光信号.
当荧光图像中不存在较高灰度值的有效荧光信号时,将背景值dark 融入拉伸算法模型,此时图像处理的数学模型如(1)式所示,其中max(Gmin,dark)是Gmin和dark 中的较大值:
当荧光图像中存在较高灰度值的有效荧光信号时,将背景值dark 融入拉伸算法模型,此时图像处理的数学模型如(2)式所示:
锐化度s的取值需合理,以免图像轮廓产生过冲或者图像锐化效果不明显.其中,二维函数g(x,y)的拉普拉斯算子表示为
采用上述荧光增强和校正方法分别对如图4(b),(c)所示的原始荧光图像进行处理,获得如图4(d),(e)所示的荧光增强图像.可以明显看出,处理后的图像更有利于荧光信号观测,背景更为干净,并去除了雾状噪声.对处理前后的荧光图像进行量化评价指标分析,结果见表1.不难得出,本文提出的荧光增强和校正方法可以大幅提高荧光图像的清晰度,突出荧光信号,提供更优的显示效果.

表1 图像量化评价指标对比Table 1.Comparison of image quantitative evaluation indicators.
3.3 系统的性能测试
3.3.1 系统的穿透深度
为了测试本系统的穿透深度,设计了生物组织模拟实验.因为Intralipid 与生物组织具有相似的吸收和散射特性,所以采用Intralipid 溶液制备凝胶,用于模拟生物组织,具体制备方法如下: 利用Intralipid 溶液(体积比0.6%)和琼脂糖粉末(质量比0.4%)配制出混合溶液,持续加热使之充分混合,然后倒入定制的圆柱形玻璃器皿中,等待其冷却凝固成凝胶.如图5(a)所示,一根毛细玻璃管(内径1 mm)倾斜固定于玻璃器皿中,倾斜角度固定时,通过统计荧光图像中水平方向上可观测的像素数量,结合定制孔位高度差和玻璃器皿的内径及像素数量,可计算得到穿透深度.实物图如图5(b)所示,玻璃管两端连接软管,通过蠕动泵控制软管内液体流动,管内液体采用浓度1 mg/mL 的商用ICG 试剂.使用本系统拍摄Intralipid 凝胶,拍摄过程中可采用黑色哑光胶布遮挡玻璃器皿反光面,以避免影响荧光成像结果.采集得到的荧光图像经过伪彩处理后如图5(c)所示,此时,相机曝光时间300 ms,镜头光圈F2.8,发射滤光片波长为1000 nm,激光器功率为8 W.通过统计可观测的像素数量,计算得到穿透深度约10.88 mm.实验结果表明,本系统的穿透深度可以达到10 mm以上,可满足小动物活体荧光成像的应用需求.
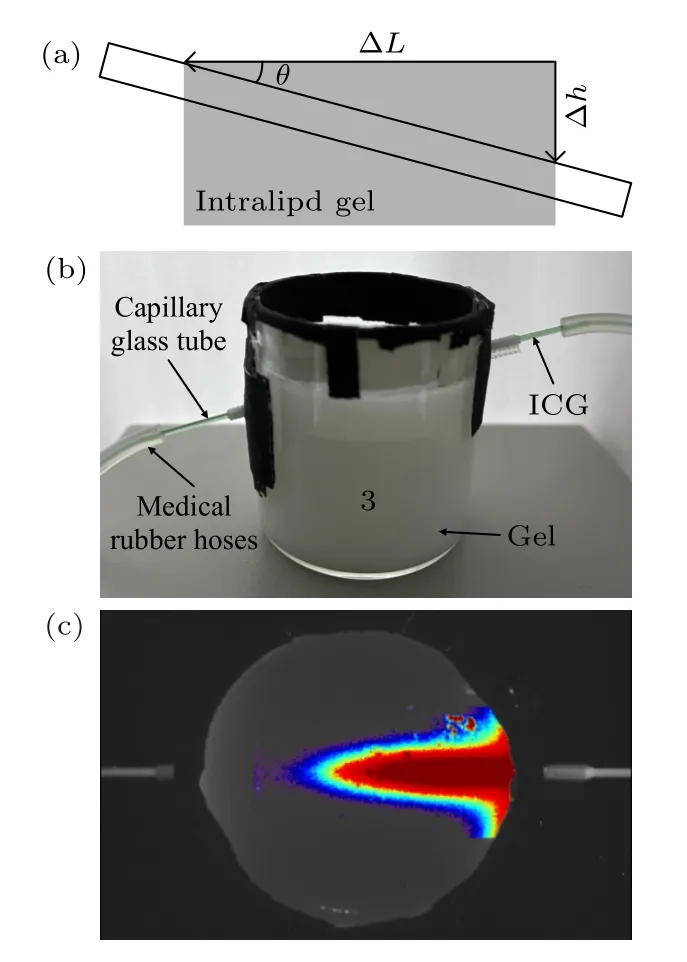
图5 系统的穿透深度测试 (a) 示意图;(b) 实物图;(c)伪彩图像Fig.5.Penetration depth testing of the system: (a) Schematic diagram;(b) physical diagram;(c) pseudo color image.
3.3.2 系统的信噪比
通过计算信噪比(signal to noise ratio,SNR)来评价系统的性能,SNR 定义为目标信号均值与背景标准差的比值,计算公式为
3.3.3 系统的灵敏度
为了测试本系统的成像灵敏度,针对ICG 试剂设置梯度实验,对12 组不同浓度的ICG 试剂及空位进行成像测试.其中,第1 组ICG 试剂的质量浓度为1 mg/mL,并将该浓度持续进行对半稀释以作为第2 组至最后一组的试剂浓度.将多组试剂等剂量(200 μL)放置于标准96 孔板内,各组试剂间隔两个孔位,以避免试剂间成像影响.荧光成像时,相机曝光时间800 ms,镜头光圈F2.8,发射滤光片波长为900 nm 和1000 nm,激光器功率密度约40 mW/cm2.由图6 可知,在当前成像状态下,本系统可探测到质量浓度为0.00048828125 mg/mL的ICG 试剂.该实验验证了本系统具有高灵敏度的优点.
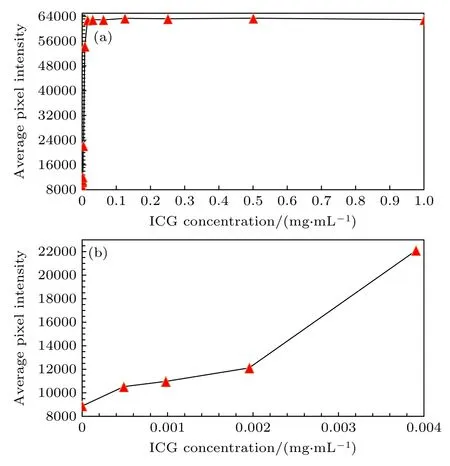
图6 ICG 梯度实验 (a) 12 组的荧光信号强度分析;(b) 最后4 组的荧光信号强度分析Fig.6.ICG gradient experiment: (a) Analysis of fluorescence signal intensity in 12 groups;(b) analysis of fluorescence signal intensity for the last 4 groups.
4 动物实验
4.1 实验对象和方法
本实验使用的小鼠为SPF 级别的BALB/C裸鼠和KM 小鼠,购买自斯贝福(苏州)生物技术有限公司,6—8 周龄.使用KM 小鼠成像时,为避免小鼠毛发对荧光成像结果造成干扰,需利用剃毛膏在小鼠腹部清理出观测区域,如图7 所示.剃毛后将小鼠静置一段时间,等待其生理状态稳定后,对其尾部静脉注射200 μL 质量浓度为1 mg/mL的ICG 试剂/AIE 染料.注射完成后,尽快将小鼠固定在系统载物台上,并调整系统参数对其进行成像.成像过程中,对小鼠进行持续麻醉,并可通过黑色胶带固定小鼠四肢,以优化成像效果.荧光成像时,激光器功率应尽可能低(由于光纤传输等造成的功率损耗,本系统实测功率密度不超过65 mW/cm2,远低于激光产品的安全GB 7247.1—2012 所规定的最大允许照射量330 mW/cm2),以避免对被测活体的本能行为产生影响.实验过程中对小鼠的操作符合《实验动物管理条例》的相关要求及动物伦理学.
图7 脱毛小鼠Fig.7.Depilatory mouse.
4.2 实验结果及分析
4.2.1 血管分布监测
对脱毛小鼠尾部静脉注射200 μL 质量浓度为1 mg/mL 的ICG 试剂,注射结束后,采用本系统对小鼠进行荧光成像,可观测到小鼠体内的血管分布情况,如图8(a)所示,此时,相机曝光时间12 ms,镜头光圈F2.8,发射滤光片波长为900 nm和1000 nm,激光器功率为8 W.图8(a)为相机采集的原始荧光图像,采用基于本系统提出的荧光增强校正算法对其进行处理,得到如图8(b)所示的增强荧光图像.对图8(a),(b)进行感兴趣区域(region of interest,ROI)选取,如图8(c)所示,并分别对图8(a),(b)进行ROI 信背比分析,得到图8(d),(e).可以看出,增强处理后荧光图像的信背比有了明显提升,增强图像更为突出了血管,特别是细小血管,有利于血管分布情况的成像监测.

图8 荧光成像 (a) 原始荧光图像;(b) 增强荧光图像;(c) ROI 选取示意图;(d) 图(a)的ROI 信背比分析;(e) 图(b)的ROI 信背比分析Fig.8.Fluorescence imaging: (a) Original fluorescence image;(b) enhanced fluorescence image;(c) schematic diagram of ROI selection;(d) ROI analysis of signal-to-back ratio in Fig.(a);(e) ROI analysis of signal-to-back ratio in Fig.(b).
4.2.2 组织器官持续监测
对上述脱毛小鼠进行血管分布监测后12 min左右,血管内荧光信号已基本消失(出现漂白现象),ICG 分布到小鼠各组织器官,并被肝脏摄取、代谢和排泄进入小肠,此时采用本系统可以明显观测到小鼠的胃肠道蠕动,如图9 所示.此时,相机曝光时间12 ms,镜头光圈F2.8,发射滤光片波长为900 nm 和1000 nm,激光器功率为5 W.实验结果表明,本系统可以对小鼠肠道中的分布进行无创、实时、可视化追踪,实现对组织器官的持续监测,为小鼠胃肠道蠕动的健康状态、胃肠动力障碍的诊断和评估、药物对肠梗阻的影响等研究提供有力的参考.

图9 组织器官荧光成像持续监测结果Fig.9.Continuous monitoring results of tissue and organ fluorescence imaging.
4.2.3 清醒状态动态监测
对裸鼠尾部静脉注射200 μL 质量浓度为1 mg/mL 的AIE 染料,注射结束一段时间后,将裸鼠放入高透明亚克力盒中,并在亚克力盒内放入一只未注射荧光染料/试剂的空白鼠,作为对照组,在无需麻醉的条件下,采用本系统实时动态监测两只裸鼠整体的荧光成像情况.如图10(a)所示,为本系统采集的原始荧光图像,此时,考虑到裸鼠的自然运动状态(移动、晃头等),相机曝光时间设置为9.8 ms,镜头光圈F2.8、景深约20 mm (基本可覆盖活动裸鼠待观测区域厚度),发射滤光片波长为1000 nm,激光器功率为8 W.如图10(b)所示,为伪彩处理后的荧光图像.可以明显看出,空白鼠无明显荧光反应,AIE 染料裸鼠仍存在较强的荧光反应.实验结果表明,本系统可以较快的成像帧率动态监测活体动物的荧光成像情况,实现活体动物在清醒状态下自由移动时的实时成像监测研究,为活体动物的生物医学成像研究提供非侵入、无需麻醉甚至安乐死的科学仪器.

图10 活体动物动态监测结果 (a) 原始荧光图像;(b) 伪彩增强图像Fig.10.Dynamic monitoring results of living animals: (a) Original fluorescence image;(b) pseudo color enhanced image.
5 结论
利用NIR-II 在生物组织中具有较大的穿透深度、较高的成像信噪比和灵敏度等特点,自主研制开发了NIR-II 小动物活体荧光成像系统,采集得到高分辨率的荧光图像并处理分析,提出了一种荧光增强和校正方法提高荧光图像的信背比和清晰度.该系统具有较高的成像灵敏度、较快的成像速度及较高的系统集成度(与市面上同类商业产品性能相似),可同时进行2—3 只小鼠的成像实验,有助于提高科研成像效率.与商用的ICG 试剂和AIE 染料等结合使用,该系统可以对小鼠进行血管分布情况监测、深层组织器官监测以及清醒状态下的动态监测研究等,可用于实时观察基因在活体动物体内的表达、肿瘤的发展过程、药物的治疗效果等,有望在肿瘤疾病的早期诊断与治疗、药物研制开发等领域内广泛应用.此外,将结合显微成像或内窥成像进行系统跨尺度研究,并结合光声/超声成像模块进行多模态成像研究等.
