外源NO提高玉米瘤黑粉病抗性的效果和作用机制初探
2024-04-27赵文清金梓浩王婷王芳
赵文清 金梓浩 王婷 王芳

摘 要 为探讨一氧化氮供体硝普纳(SNP)提高玉米对瘤黑粉病抗性的效果和作用机制,以高抗玉米瘤黑粉病自交系‘齐319和高感玉米自交系‘掖478为材料,研究不同浓度(0.02、0.05、0.1、0.5 mmol/L)SNP处理对玉米瘤黑粉菌菌丝生长和不同生长时期(0、5、10、15、20 d)玉米叶片生理特性的影响。结果表明:0.02、 0.05 mmol/L浓度SNP对菌丝有明显抑制作用,处理玉米叶片后会产生一定的诱抗效果。外源喷施0.02 mmol/L浓度SNP能够提高玉米叶片中的抗氧化超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、几丁质酶(CHT)、β-1,3-葡聚糖酶活性和游离脯氨酸(pro)含量,而其丙二醛(MDA)含量和脂氧合酶(LOX)活性有所降低。可见,外源NO可在一定程度上缓解瘤黑粉菌对玉米植株造成的伤害,提升玉米对瘤黑粉病的防治效果,其机制可能是通过提高玉米的多种抗氧化酶活性、渗透物质含量和抗病相关酶活性,从而提高玉米对瘤黑粉病的抗性。
关键词 玉米; 外源 NO;叶片;瘤黑粉病; 抗氧化酶
玉米是中国主要的粮食、能源及经济作物,其生产安全在国内粮食生产中具有重要意义。近年来,随着畜牧业和能源相关产业的快速发展对国内玉米需求量提出了更高的要求[1]。玉米瘤黑粉病是影响玉米生产的主要病害之一,当玉米植株遭受瘤黑粉孢子侵染时,会破坏玉米正常生长发育和营养供应,造成玉米产量大幅降低,一般减产10%~30%[2-3],严重时会绝收。此外,随着全球气候不断变化和农业生产对田间秸秆处理不当,使大量瘤黑粉病菌留在土壤和残茬中,造成玉米瘤黑粉病部分地区发生大流行[4]。瘤黑粉病对我国的西北、华北、东北等地区玉米生产造成很大的损失[5]。
一氧化氮(NO)在植物对逆境胁迫的反应中起着重要作用,是植物体中一种重要的信号调节分子[6]。NO可诱导受伤组织的细胞临近凋亡,保护植物体内的正常细胞[7]。已有研究表明,外源NO處理可以有效提高PAL(苯丙氨酸解氨酶)、POD(过氧化物酶)、CHT(几丁质)等酶的活性,从而提高火龙果果实对炭疽病的抗性[8];外源NO处理能够提高马铃薯对干腐病的抗病性,并且在壳聚糖诱导马铃薯抗病性中发挥重要的作用[9]; NO处理可以有效抑制接种灰霉病草莓果实病斑的扩展[10]。但在外源NO诱导玉米对瘤黑粉病的抗性机理研究方面未见详细报道。因此,本试验以瘤黑粉病高抗玉米自交系‘齐319和高感玉米自交系‘掖478为试验材料,研究外源NO对玉米抗瘤黑粉病的影响,探讨外源NO诱导玉米抗病性的作用机理,为进一步认识NO对植物抗逆境的调控机理奠定基础。
1材料与方法
1.1 试验材料
以高抗玉米瘤黑粉病自交系‘齐319和高感玉米自交系‘掖478为试验材料,由甘肃农业大学玉米课题组提供。试验材料种植于甘肃农业大学试验基地,2021年4月下旬左右播种,按照随机区组设计,‘齐319和‘掖478各种植5行,行长6 m,行距为0.75 m,每行留苗20株, 田间正常管理。
供试菌株:玉米瘤黑粉菌(Ustilago maydis),菌株编号5.208,购自中国科学院微生物研究所。
1.2 玉米瘤黑粉病病菌培养及人工接种
在培养基上接种菌碟进行测定[11]。经细菌过滤器,分别配浓度为0.02、0.05、0.1和0.5 mmol/L硝普纳(SNP)的马铃薯葡萄糖琼脂培养基(PDA),对照为加入与 SNP 等量的无菌水。在无菌环境下将直径为 5 mm 菌碟接种在培养基上,在人工培养箱中进行培养,24 h和48 h 时采用全自动微生物菌落计数仪进行菌落面积的测算,各处理设3次重复。
挑取玉米瘤黑粉菌两种不同遗传交配型担孢子单菌落于 PDA 培养基中,28 ℃培养5 d;将长出的菌落全部转移到2 mL无菌离心管中,加入适量无菌水充分振荡悬浮菌体;最后在悬浮液中加入甘油,使甘油的终浓度为15%,放入-80 ℃冰箱长期保存。
将保存的菌株转至马铃薯蔗糖液体培养基中,在27 ℃、180 r/min条件下振荡培养3 d,产生大量担孢子可用于接种。用蒸馏水将悬浮液稀释至9×103~10×103个孢子/mL,待玉米长至6叶1心时,采用菌液注射法[12]接种。接种时选择上午或阴天,用注射器从幼苗茎侧方刺入接种,接种量为 2 mL 每株,对照组在相同部位注射等量的蒸馏水,在同一天接种完。配置0.02、0.05、 0.1、0.5 mmol/L SNP溶液,接种处理6 h后将配好的 SNP 溶液用喷壶喷到接种玉米叶片的表面,每株喷施50 mL,对照组喷洒等量无菌水,每个处理设置3个重复,每个重复10株。用塑料袋套住接种瘤黑粉病菌悬浮液的植株和喷洒 SNP 溶液的叶片,以起到保湿和防止其他病菌侵染的作用。SNP 处理7 d后观察玉米发病情况,筛选最佳浓度。
采用筛选出的最佳SNP浓度对玉米叶片进行处理,在处理后 0、5、10、15、20 d共5个时间段进行采样。试验共设置8个处理:‘齐319 SNP-接种、‘齐319 SNP -未接种、‘齐319 CK-接种、‘齐319 CK-未接种;‘掖478 SNP-接种、‘掖478 SNP -未接种、‘掖478 CK-接种、 ‘掖478 CK-未接种,每个处理设 3 次重复。
1.3 生理指标测定
超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、丙二醛(MDA)、游离脯氨酸(Pro)测定采用王三根[13]方法;脂氧合酶(LOX)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、几丁质酶(CHT)、β-1,3-葡聚糖酶测定采用曹建康等[14]方法。
1.4 数据统计
用Shineso Supcre G9 软件测量菌落面积,数据采用 Microsoft Excel 软件进行绘图,用 SPSS 统计软件进行统计分析,数据以“平均数±标准差”表示。
2 结果与分析
2.1 外源NO对玉米瘤黑粉菌菌丝生长的影响
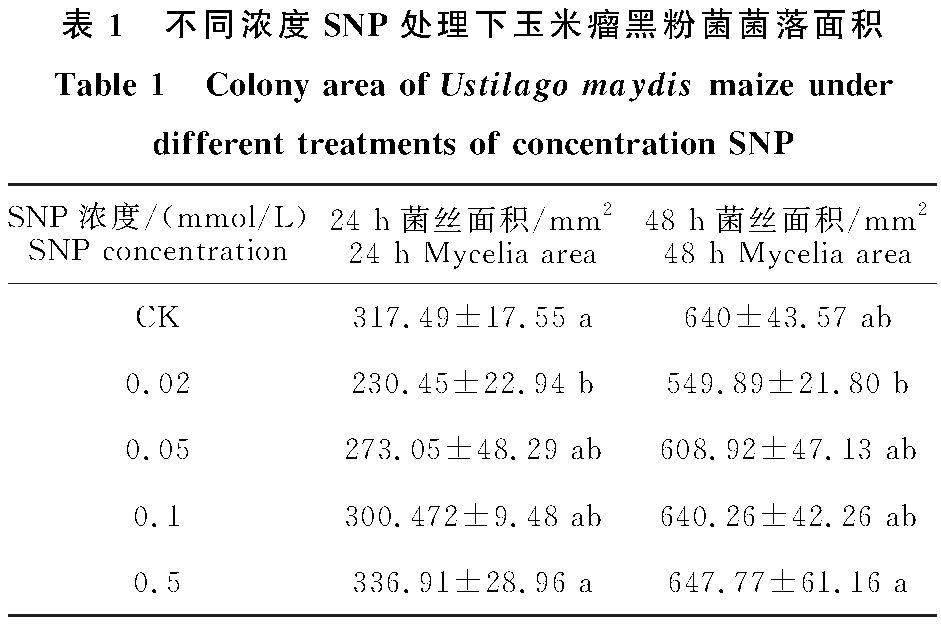
由表1可见,24 h和48 h玉米瘤黑粉菌菌落面积随着SNP浓度的升高呈逐渐增大的趋势。24 h后,在 SNP 浓度为0.02 mmol/L时与对照相比差异显著。当处理浓度为0.02、0.05、0.1 mmol/L时,24 h菌落面积分别比对照降低 27.42%、14%、5.2%,0.5 mmol/L 时菌落面积比对照增加6.12%。当处理浓度为0.02、0.05 mmol/L 时,48 h菌落面积分别比对照降低 14.08%、4.86%,0.1、0.5 mmol/L 时菌落面积比对照增加0.04%、1.21%。以上研究结果表明,当 SNP浓度为0.02 mmol/L 时,对瘤黑粉菌落生长抑制效果较好。
2.2 外源NO对玉米瘤黑粉病发生的影响
不同浓度SNP处理玉米叶片7 d后,玉米发病情况如图1,玉米‘齐319 CK处理和0.1、0.5 mmol/L SNP处理下轻微侵染,叶片有零星变黄;0.5 mmol/L SNP处理下轻度侵染,叶片有少量变黄、起皱扭曲;0.02、0.05 mmol/L SNP处理下没有发病。玉米‘掖478所有处理下均发病,CK处理下玉米茎部严重畸形;0.02 mmol/L SNP处理下玉米叶片轻微起皱扭曲,茎部轻度畸形; 0.05、0.1 mmol/L SNP处理下玉米叶片变黄,起皱扭曲,有少量凸起瘤状物;0.5 mmol/L SNP处理下叶片和茎部严重畸形。
以上结果表明,低浓度 SNP 能提高玉米抗瘤黑粉病的能力,以 0.02 mmol/L SNP 处理效果最佳。
2.3 外源NO对玉米叶片中抗氧化酶类的影响
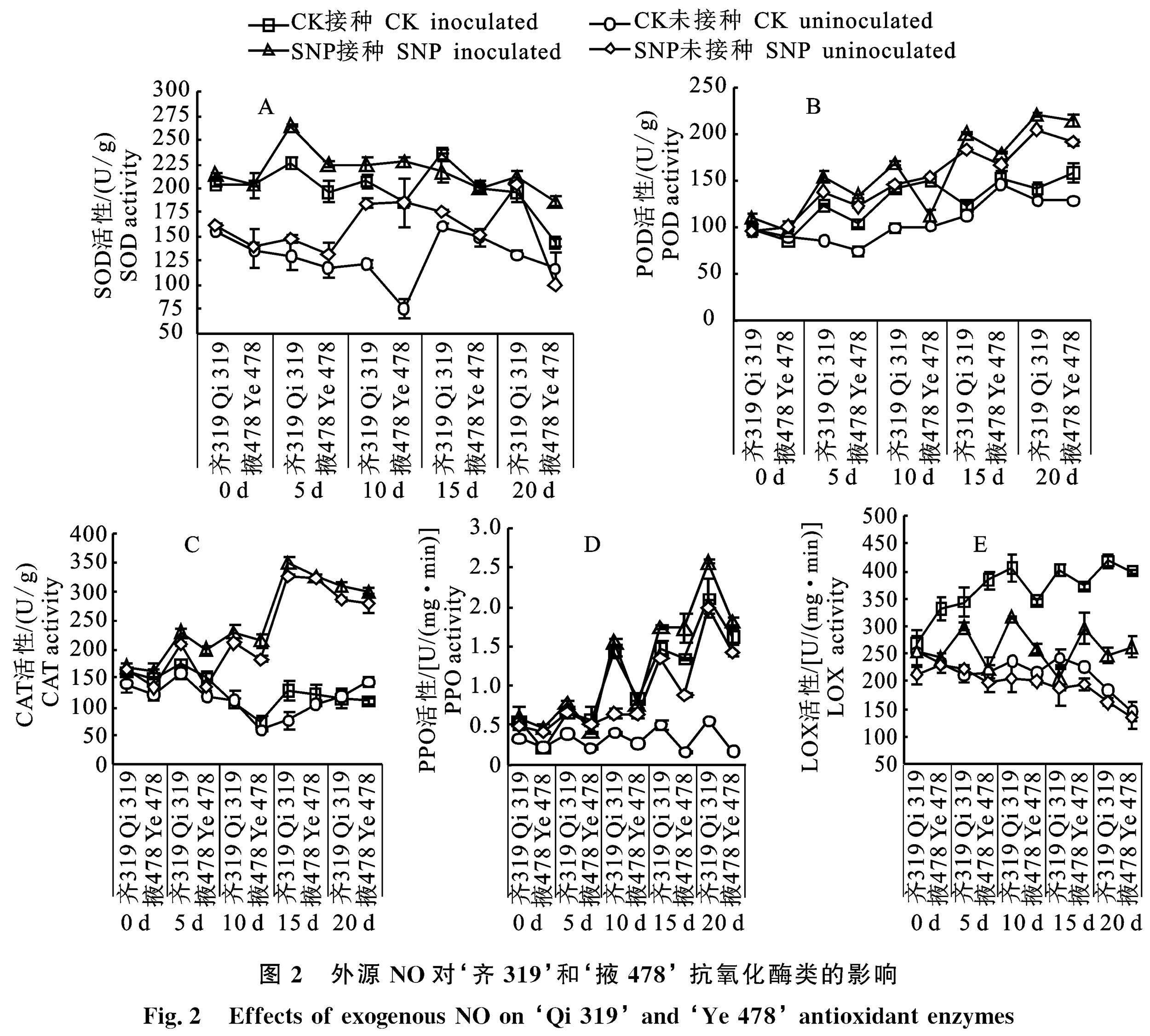
由图2可以看出,各处理组与对照组之间在整个处理期间 SOD、POD、CAT、PPO活性变化显著(P<0.05)。玉米接种瘤黑粉菌后,‘齐319 和‘掖478 CK-接种处理的玉米酶活性均显著高于CK-未接种;SNP-接种处理的玉米酶活性显著高于SNP-未接种(P<0.05);SNP处理组玉米的酶活性整体高于CK处理组。
‘齐319 SNP-接种处理的玉米 SOD 活性高峰出现在5 d,比‘齐319 CK-接种处理高 17.4%;‘掖478 SNP-接种活性高峰出现在10 d,比‘掖478 CK-接种处理高22.9%(图2-A)。POD活性各处理组变化趋势相似,活性高峰出现在 20 d,‘齐319 SNP-接种处理比‘齐319 CK-接种处理高56.8%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理高35.2%(图2-B)。CAT活性的SNP处理组活性高峰出现在15 d, ‘齐319 SNP-接种处理比‘齐319 CK-接种处理高171.4%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理高168%(图2-C)。处理期间各处理的 PPO活性呈上升的趋势,活性高峰出现在20 d,‘齐319 SNP-接种处理玉米的 PPO 活性比‘齐319 CK-接种的玉米 PPO 活性高22.3%,‘掖478 SNP-接種处理玉米的 PPO 活性比‘掖478 CK-接种处理高27.9%(图2-D)。‘齐319的 SOD、POD、CAT、PPO活性整体高于‘掖478,说明‘齐319 的抗逆性强于‘掖478。
由图2-E可以看出,玉米接种瘤黑粉病菌后玉米 LOX 活性显著高于未接种玉米。两个玉米自交系 SNP-接种处理的玉米 LOX 活性显著低于 CK-接种处理,最低出现在20 d,‘齐319 SNP-接种处理比‘齐319 CK-接种处理低 40.7%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理低34%。
上述结果表明,SNP处理能增强玉米叶片中 SOD、POD、CAT、PPO的活性,降低 LOX 酶的活性,从而提高玉米叶片的抗氧化能力,降低细胞膜的损伤程度,其中 POD活性受 SNP 影响 最大。
2.4 外源NO对玉米叶片中脯氨酸和MDA含量的影响
SNP处理对玉米叶片 Pro含量的影响如图 3-A,各处理组 Pro 含量变化显著(P<0.05),活性高峰出现在10 d。10 d时,两个玉米自交系CK-接种处理的玉米Pro含量均显著高于CK-未接种,SNP-未接种处理的玉米Pro含量显著高于CK-未接种,SNP-接种处理的玉米Pro含量高于CK-接种处理,但差异并不显著。
SNP处理对玉米叶片 MDA 含量的影响如图 3-B,各处理组MDA含量变化显著(P< 0.05)。20 d时,CK-接种处理玉米的 MDA 含量显著高于CK-未接种处理;SNP-接种处理玉米的 MDA含量显著低于CK-接种处理,‘齐319 SNP-接种处理比‘齐319 CK-接种处理低 25.4%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理低 52.9%。
上述结果表明,SNP 处理能增加玉米叶片中 Pro 的含量,降低 MDA 的含量,进而降低病害对玉米细胞膜造成的损伤。
2.5 外源NO对玉米叶片中抗病相关酶类的 影响
由图4可以看出,各处理组与对照组之间在整个处理期间 PAL、CHT、β-1,3葡聚糖酶活性变化显著(P<0.05),SNP处理组玉米的酶活性整体高于CK处理组,活性高峰均出现在10 d。由图 4-A可以看出,10 d时,‘齐319 SNP-接种处理PAL酶活性比‘齐319 CK-接种处理高 45.6%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理高23.7%。由图4-B可以看出,10 d时,‘齐319 SNP-接种处理CHT酶活性比‘齐319 CK-接种处理高17.1%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理高32.2%。由图 4-C可以看出,10 d时,‘齐319 SNP-接种处理β-1,3葡聚糖酶活性比‘齐319 CK-接种处理高 22.9%,‘掖478 SNP-接种处理比‘掖478 CK-接种处理高44.1%。玉米接种瘤黑粉病菌后玉米 β-1,3葡聚糖酶活性显著高于未接种玉米。抗性自交系‘齐319 整体酶活性高于感病自交系‘掖478。
上述结果表明,SNP 处理能增强玉米叶片中 PAL、CHT、β-1,3葡聚糖酶的活性,从而增强玉米抵御病害的能力,其中 PAL和 β-1,3葡聚糖酶活性受 SNP 影响较大。
3 讨论与结论
植物细胞膜的通透性会在受到病原物侵染时发生改变,影响植物的光合作用和呼吸作用等,蛋白质含量等也会降低。植物体内大多数酶类都由可溶性蛋白组成。植物会在受到病菌胁迫时通过合成大量的可溶性蛋白来抵御或缓解病原菌所带来的伤害[15]。研究发现,病原物的侵入促进代谢相关酶的活性增强,比如PAL、POD、PPO等[16-17] 。
NO作为信号调节分子和活性氧清除剂在抵抗生物和非生物胁迫方面起着重要的生理作用,硝普纳(SNP)是一种重要的 NO 供体。赵晓丹[18]研究发现低浓度的外源NO可降低拟南芥灰霉病的发病情况,诱导拟南芥对灰霉病的抗性。本试验研究结果表明,用4种不同浓度的 SNP 处理玉米瘤黑粉菌菌丝,0.02 mmol/L浓度的SNP对玉米瘤黑粉菌的菌丝生长抑制明显。用4种不同浓度的SNP处理玉米植株后,0.02 mmol/L浓度的 SNP 处理诱导玉米抗病性效果最佳。
SOD、POD、CAT 是植物细胞中重要的抗氧化保护酶,能清除过量的活性氧,防止植株受到各种胁迫的伤害[19-21]。研究表明,外源 NO 能够提高干旱胁迫下玉米叶片 SOD、POD、CAT等的活性,增强玉米清除ROS的能力,增强玉米抗旱性 [22]。本试验研究结果表明 0.02 mmol/L浓度的 SNP 处理可以增强玉米叶片中SOD、POD、CAT、PPO的活性,增强玉米在瘤黑粉菌胁迫下对过氧化物的清除能力, 降低膜脂过氧化的程度, 减小玉米瘤黑粉病对植株的伤害。
植物受到病菌侵染时细胞发生膜脂过氧化,产生毒性代谢物 MDA,导致膜系统遭到破坏,植物的生长发育受到抑制。前人研究认为植物最初感染病原物时,LOX 活性会升高诱导产生单线态氧(1O2和O-2),同时SOD活性下降,导致O-2发生累积,膜脂过氧化作用加强,膜结构遭到破坏,加速染病组织的死亡[23]。本研究表明,瘤黑粉菌胁迫下玉米叶片中MDA、LOX 活性升高。在瘤黑粉菌胁迫下,用 0.02 mmol/L浓度的SNP处理玉米后,玉米叶片中LOX的活性降低,MDA含量降低,降低病菌对玉米叶片细胞膜的破坏,在一定程度上降低了瘤黑粉菌胁迫对玉米叶片的伤害程度。
脯氨酸在植物对逆境胁迫的反应中扮演着重要的角色,是植物体内的重要渗透调节物质之一。本试验中,用 0.02 mmol/L 浓度的SNP处理玉米后,玉米叶片中Pro含量有一定程度的增加,这和张菊平等[24]的研究结果一致。外源NO诱导玉米植株细胞的渗透调节能力增强,病菌对植物体的伤害降低。
PAL酶系是植物体内普遍存在的防御酶系统,PAL活性可作为植物抗逆境能力的一个生理指标[25]。β-1,3-葡聚糖酶和 CHT 广泛存在于高等植物体内,协同作用更能有效抵御病原菌的侵害,提高植物的抗病性[26]。本研究表明,玉米遭受瘤黑粉菌胁迫后玉米葉片中 PAL、CHT、β-1,3葡聚糖酶活性显著升高,经过外源 NO 处理后,提高了玉米抗瘤黑粉病的能力,玉米叶片中 PAL、CHT、β-1,3-葡聚糖酶活性显著升高。这与黄玉平[10]的研究结果一致。
综上所述,瘤黑粉菌胁迫会明显抑制玉米植株的正常生长和生理反应,外源喷施适宜浓度SNP可提升玉米对瘤黑粉病的防治效果,以浓度0.02 mmol/L处理效果最佳,其机制可能是外源NO处理可诱导玉米叶片的多种抗氧化酶活性、渗透物质含量和抗病相关酶活性升高,MDA和LOX 活性降低,进而导致过氧化物积累和膜脂过氧化程度降低,减小氧化胁迫对玉米植株的伤害,从而提高玉米对瘤黑粉病的抗性。
参考文献 Reference:
[1] 任志强,王晓清,卜华虎,等.玉米抗旱育种研究进展[J]. 山西农业科学,2019,47(7):1291-1294.
REN ZH Q,WANG X Q,BU H H,et al.Research progress in drought resistance breeding of maize[J].Shanxi Agricultural Science,2019,47(7):1291-1294.
[2] 李 斌,杨辉斌,王军锋,等.四氯虫酰胺的合成及其杀虫活性[J].现代农药,2014,13(3): 17-20,40.
LI B,YANG H B,WANG J F,et al.Synthesis and insecticidal activity of Si Lv Chong Xianan[J].Modern Agrochemicals,2014,13(3): 17-20,40.
[3] 边亚辉.玉米瘤黑粉病的危害与防治[J].河北农业,2016(1):39-40.
BIAN Y H.Hazards and control of Ustilago maydis in maize [J].Hebei Agriculture,2016(1):39-40.
[4] 杨青华,郑博元,李蕾蕾,等.外源NO供体对水分亏缺下玉米叶片碳同化关键酶及抗氧化系统的影响[J].作物学报,2018,44(9):1393-1399.
YANG Q H,ZHENG B Y,LI L L,et al.Effects of exogenous nitric oxide donors on carbon assimilation and antioxidant systems in leaves of maize seedlings under PEG-induced water deficit stress[J].Acta Agronomica Sinica,2018,44(9):1393-1399.
[5] 白金恺.杂粮作物病害[M].北京:中国农业出版社,1997: 78-80.
BAI J K.Diseases of Coarse Grain Crops [M].Beijing: China Agricultural Press,1997: 78-80.
[6] 张 霖,赵 翔,王亚静,等.NO与Ca2+对蚕豆保卫细胞气孔运动的互作调控[J].作物学报,2009,35(8):1491-1499.
ZHANG L,ZHAO X,WANG Y J,et al.Crosstalk of NO with Ca2+ in stomatal movement in vicia faba guard cells[J].Acta Agronomica Sinica,2009,35(8):1491-1499.
[7] YAMASAKI H,SHIMOJI H,OHSHIRO Y,et al.Inhibitory effects of nitric oxide on oxidative phosphorylation in plant mitochondria[J].Nitric Oxide,2001,5(3):261-270.
[8] 朱迎迎.外源一氧化氮(NO)誘导火龙果果实对炭疽病的抗性及其对采后品质影响的研究[D].海口:海南大学,2016.
ZHU Y Y.Impact of postharvest anthracnose,enhancement of disease resistance and quality in ripening dragon fruit by exogenous nitric oxide treatment[D].Haikou:Hainan University,2016.
[9] 胡林刚.NO和H2O2对马铃薯干腐病的控制作用及其机理研究[D].兰州:甘肃农业大学,2014.
HU L G .Control of exogenous NO and H2O2 on dry rot of potato tuber and its possible mechanism involved[D].Lanzhou:Gansu Agricultural University,2014.
[10] 黄玉平.外源NO对草莓果实品质影响及诱导抗病性机理研究[D].南京:南京农业大学,2016.
HUANG Y P.The effect of strawberry quality and regulation mechanism of nitric oxide on gery mold disease[D].Nanjing:Nanjing Agricultural University,2016.
[11] 张智慧,聂艳芳,何 磊,等.外源茉莉酸甲酯诱导水稻抗瘟性相关防御酶和内源水杨酸的变化[J].植物病理学报,2010,40(4): 395-403.
ZHANG ZH H,NIE Y F,HE L,et al.Resistance-related defense enzymes and endogenous salicylic acid induced by exo-genous methyl jasmonate in rice against blast disease[J].Acta Phytopathologica Sinica,2010,40(4): 395-403.
[12] 王 威.玉米瘤黑粉病抗性的遗传特点及生化特性研究[D].兰州:甘肃农业大学,2010.
WANG W.Genetic and biochemical characteristic research of corn resistance to common smut[D].Lanzhou: Gansu Agricultural University,2010.
[13] 王三根.植物生理生化[M].北京:中国林业出版社,2013.
WANG S G.Plant Physiology and Biochemistry[M].Beijing:China Forestry Press,2013.
[14] 曹建康,姜微波,赵玉梅.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.
CAO J K,JIANG W B,ZHAO Y M.Experiment Guidance of Postharvest Physiology and Biochemistry of Fruits and Vegetables[M].Beijing:China Light Industry Press,2007.
[15] 沈文飚,徐朗莱,叶茂炳.水杨酸诱导植物抗病性的新进展[J].生物化学与生物物理进 展,1999(3):44-47.
SHEN W B,XU L L,YE M B.Progress in structure-function studies of cellulases [J].Progress in Biochemistry and Biophysics,1999(3):44-47.
[16] 王 曼.两个苹果品种叶片接种褐斑菌后抗病相关酶活性变化研究[D].陕西杨凌:西北农林科技大学,2013.
WANG M.Differentiated expression of pathogenesis-related enzymatic activity in two apple cultivars in response to the pathogen Marssonina coronaria[D].Yangling Shaanxi:Northwest Agriculture and Forestry University,2013.
[17] 黄志磊.基于转录组学的大麦抗叶斑病生理机制研究及抗病基因筛选[D].兰州:甘肃农业大学,2019.
HUANG ZH L.Transcriptomics-based physiological mechanism of barley resistance to Bipolaris sorokiniana and screening of disease[D].Lanzhou:Gansu Agricultural University,2019.
[18] 赵晓丹.外源一氧化氮诱导拟南芥抗灰霉病机制的研究[D].昆明:云南师范大学,2008.
ZHAO X D.The effect of Arabidopsis thaliana regulation mechanism of nitric oxide on gray mold[D].Kunming:Yunnan Normal University,2008.
[19] 胡国霞,马莲菊,陈 强,等.植物抗氧化系统对水分胁迫及复水响应研究进展[J].安徽农业科学,2011,39(3):1278-1280,1282.
HU G X,MA L J,CHEN Q,et al.Research progress on the response of plant antioxidant system to water stress and rewatering[J].Anhui Agricultural Science,2011, 39(3):1278-1280,1282.
[20] 刘晓慧,尚 静,朱宗文,等.高温胁迫对丝瓜幼苗抗氧化酶活性及基因表达的影响[J].分子植物育种,2020, 18(24):7989-7996.
LIU X H,SHANG J,ZHU Z W,et al.Effects of high temperature stress on the activities of antioxidant enzymes and genes expression of Luffa seedling[J].Molecular Plant Breeding,2020,18(24):7989-7996.
[21] 韩 阳,邱漫莉,孟 靖,等.碱胁迫对紫花苜蓿抗氧化酶的影响[J].辽宁大学学报(自然科学版),2020,47(3):193-199,188.
HAN Y,QIU M L,MENG J,et al.Effects of alkali stress on antioxidant enzymes of alfalfa[J].Journal of Liaoning University (Natural Science Edition),2020,47(3):193-199,188.
[22] 李蕾蕾.外源NO对干旱条件下玉米幼苗光合特性及抗氧化酶系统的影响[D].郑州:河南农业大学,2016.
LI L L.Studies on the effect of exogenous nitric oxide on photosynthetic characteristics and antioxidant enzymes activity of maize seedlings under drought stress[D].Zhengzhou:Henan Agricultural University,2016.
[23] 党俊梅,张少英,邵世勤,等.甜菜抗(耐)丛根病生理基础的研究Ⅱ.超氧化物歧化酶(SOD)、酯氧合酶(LOX)、丙二醛(MAD)与甜菜抗(耐)丛根病的关系[J].中国糖料,2000(3):7-12.
DANG J M,ZHANG SH Y,SHAO SH Q,et al.Physiological basis of rhizomania resistance (tolerance) in sugarbeet Ⅱ.The relationship between superoxide dismutase(SOD),lipoxidase(LOX),malondialdehyde(MAD) and the rhizomania resistance(tolerance) in sugarbeet[J].China Sugar,2000(3):7-12.
[24] 张菊平,张会灵,张焕丽.外源NO降低辣椒幼苗盐害的生理效應[J].北方园艺,2020(22):10-15.
ZHANG J P,ZHANG H L,ZHANG H L.Physiological effectof exogenous nitric oxide on pepper seedlings under NaCl stress [J].Northern Horticulture,2020(22):10-15.
[25] 叶文斌,贠汉伯,樊 亮,等.复合涂膜对杨梅贮藏过程中POD、PPO、PAL酶活性的影响[J].包装与食品机械,2012,30(2):10-16.
YE W B,YUN H B,FAN L,et al.Effect of compound coating antistaling agent of polysaccharide treatment in storage on POD,PPO and PAL enzymatic activity of Chinese bayberry[J].Packaging and Food Machinery,2012,30(2):10-16.
[26] 程笑笑.棉花黃萎病菌内源几丁质酶基因 VDECH 功能分析[D].北京:中国农业科学院,2017.
CHENG X X.Functional analysis of endochitinase gene VDECH from Verticillium dahliae[D].Beijing:Chinese Academy of Agricultural Sciences,2017.
Effect and Action Mechanism of Exogenous NO in Enhancing Maize Resistance to Ustilago maydis
Abstract To investigate effect and mechanism of nitric oxide (NO) donor sodium nitroprusside (SNP) on enhancement of maize resistance to Ustilago maydis,we used the highly resistant maize Ustilago maydis inbred line ‘Qi 319 and the highly susceptible maize inbred line ‘Ye 478 as the experimental materials.We conducted an experiment to investigate the effect of various SNP concentrations (0.02,0.05,0.1 and 0.5 mmol/L) on growth of Ustilago maydis hypha and the physiological parameters of maize leaves at various growth phases (0,5,10,15,20 d).The results demonstrated that SNP significantly inhibited mycelium at concentrations of 0.02 and 0.05 mmol/L,inducing a certain level of resistance in maize plants.Exogenous application of 0.02 mmol/L SNP enhanced the antioxidant activities of the enzymes superoxide dismutase (SOD),peroxidase (POD),catalase (CAT),polyphenol oxidase (PPO),phenylalanine ammonia-lyase (PAL),chitinase (CHT),and β-1,3-Glucanase as well as the level of free proline (pro) in maize leaves.Concurrently,it reduced the malondialdehyde (MDA) content and lipoxygenase (LOX) activity.In conclusion,exogenous NO can partially alleviate the damage caused by Ustilago maydis in maize plants and enhance their resistance to this pathogen.This enhancement is likely achieved by increasing the activity of various antioxidant enzymes,the accumulation of osmotic substances,and the activity of disease-resistance-related enzymes in maize.
Key words Maize;Exogenous NO;Blades;Common smut;Antioxidant enzyme
