宁夏地区不同品种番茄主要病毒病的分子鉴定及抗性评价
2024-04-27郜雅欣高艳明李建设王涵
郜雅欣 高艳明 李建设 王涵


摘 要 为明确宁夏地区番茄上的病毒种类并分析复合侵染状况以及评价不同品种番茄的抗病性,于宁夏贺兰园艺产业园采集139份番茄疑似病毒样品(共22个品种),利用主要的8种番茄病毒特异性引物对病样进行RT-PCR分子检测与鉴定。结果显示:在疑似病样中,病毒检出率为98.56%,其中,ToMMV首次在银川市检出,检出率显著高于其他病毒,达92.05%,为当地优势毒源;其次为TSWV和STV检出率分别为 76.04%和73.35%;TYLCV、ToCV、ToMV、CMV和TMV检出率较低。通过对番茄病毒的复合侵染现象分析发现,复合侵染的样本占阳性样本数的94.89%,其中3种病毒的复合侵染率占复合侵染总比的53.08%,且3种和4种复合侵染类型繁多。此外,对22个品种感病情况分析,‘冠蔬106感染的病毒种类最多,为6种,而‘黑小哥未检测出以上8种番茄病毒。进而对番茄病毒病抗性品种进行初步评估,‘黑小哥‘千禧‘香妃9号‘152‘冠疏103‘193和‘赛硒柿2号这7个品种为抗病毒品种。综上,面对外来病毒的侵入,复合侵染的暴发,应当引起高度重视和警惕。
关键词 番茄病毒病;南方番茄病毒;番茄斑萎病毒;番茄斑驳花叶病毒;复合侵染
番茄(Lycopersicon esctdentum)因其具有丰富的营养价值、独特的风味、广泛的用途等诸多优点,被称为神奇的菜中之果,深受人们喜爱,此外,番茄亦是中国广泛种植的设施蔬菜种类之一[1]。而处于中国西北的宁夏地区,位于黄河中上游,地势自西南向东北呈阶梯下降,坡降相宜,引水方便,便于灌溉。区内昼夜温差较大,日照时间长,具有得天独厚的资源优势,适宜设施蔬菜的发展。如今,该地区设施番茄的栽培面积占设施农业总面积的15.9%,已经成为国内设施番茄的重要生产基地[2]。然而,随着番茄需求量的提升,番茄种植面积也随之扩大,番茄病毒病对番茄种植的影响也日益突出,已成为宁夏番茄第一大病害,致使番茄产业深受其害。
番茄病毒病,又称蔬菜上的癌症,目前,国内外共发现136种病毒侵染番茄,有34种番茄病毒病在中国已被报道,其中,大部分为RNA病毒,如番茄褪绿病毒(Tomato chlorosis virus,ToCV)、番茄斑驳花叶病毒(Tomato mottle mosaic virus,ToMMV)、南方番茄病毒 (Southern tomato virus, STV)、番茄斑萎病毒(Tomato spotted wilt virus,TSWV)、黄瓜花叶病毒 (Cucumber mosaic virus,CMV)、番茄烟草花叶病毒 (Tobacco mosaic virus,TMV)及番茄花叶病毒(Tomato mosaic virus,ToMV)等[3]。2011年,在宁夏首次发现DNA毒病中的番茄黄化曲叶病毒(Tomato yellow leaf curl virus,TYLCV),随后该病毒向全区蔓延[2]。继2014年,番茄斑萎病毒(TSWV)在石嘴山地区报道[4]。被病毒感染后的番茄,其田间症状与番茄缺素症相似,并且番茄感染不同病毒所表现的症状也相近,又因病毒复合侵染的现象在田间出现频繁,因此肉眼检视不能作为病毒病诊断的可靠方法。为此,基因分子生物学因其具有快捷、灵敏准确及可重复的优点近些年来被广泛应用到植物病毒的鉴定与诊断。
本试验通过采集宁夏银川地区种植的适宜鲜食不同品种中的疑似番茄病毒病样本,运用分子生物学鉴定方法,以明确宁夏地区番茄病毒病的病毒种类和番茄被侵染的状况;为宁夏设施栽培番茄病害的诊断、抗性品种的筛选及综合防控提供科学依据。
1 材料与方法
1.1 试验材料
试验选用樱桃番茄,品种为‘191‘193‘152‘白妃‘千禧‘黑小哥‘香妃9号‘黄妃,共8个;口感型大番茄,品种为‘1号‘赛硒柿2号‘冠蔬103‘冠蔬106‘原味1号‘甜脆脆‘京番308‘普罗旺斯‘味多美‘亚蔬12号‘中番9号‘168‘塞纳‘869,共14个。于2022年1月2日播种育苗,2月10日定植于宁夏贺兰园艺产业园11号日光温室。每个品种定植48株,株行距45.0 cm×60.0 cm,定植前用利尔康(泡腾消毒片Ⅱ型:三氯异氰尿酸)对基质及设施进行消毒,定植后按常规方法施肥和管理,大番茄采用单杆整枝方式,樱桃番茄采用三杆整枝方式。6月10日(盛果期)进行田间调查,在番茄的整个生育期共采集22个番茄品种的139份疑似被侵染的发病植株叶片,拍照后分别包于锡纸中,做好标记,置于液氮桶,带回实验室,次日进行病毒病鉴定,试验剩余样品存入-80 ℃冰箱保存,备用。在样品采集期间不喷施任何化学药剂,温室内的番茄植株均为自然发病。
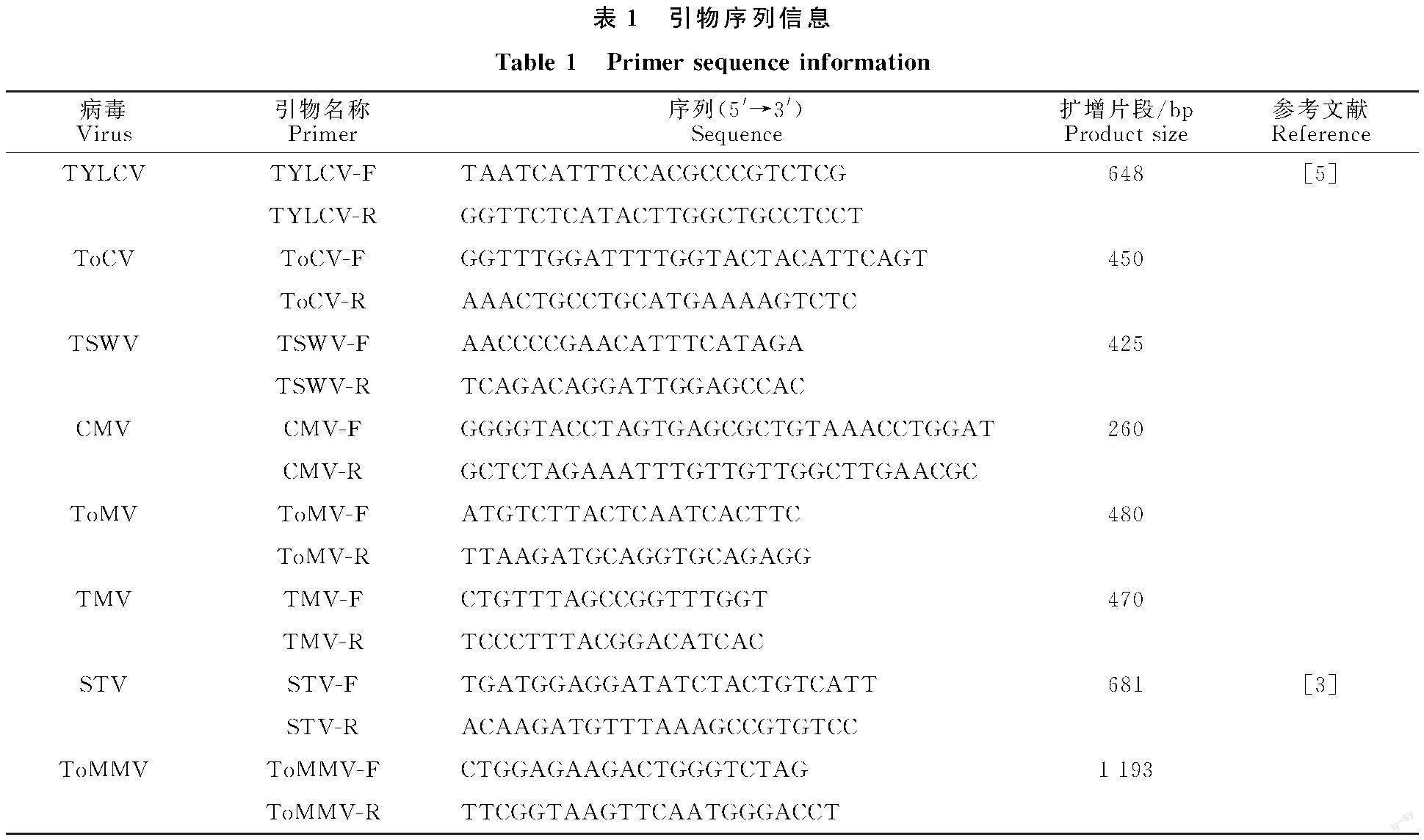
1.2 供试引物信息
供试引物详见表1。
1.3 番茄病样总DNA/RNA提取
番茄叶片总的DNA提取:将0.5 g左右冻结保存的发病番茄叶片迅速转移至消毒且预冷的研体中,充分研磨至粉末状,装入经液氮预冷的1.5 mL离心管中,采用Tiangen DNA提取试剂盒,用于DNA的提取及后续试验。
番茄总RNA的提取以及cDNA的合成:将0.5 g左右冻结保存的发病番茄叶片迅速转移至消毒且预冷的研体中,充分研磨至粉末状,装入经液氮预冷的1.5 mL离心管中,采用RNAprep Pure多糖多酚植物總RNA 提取试剂盒进行样品总RNA的提取,随后利用Vazyme生物公司的Hiscript Ⅲ 1st Strand cDNA Synthesis Kit (+gDNA wiper)试剂盒进行反转录。取2 μL的RNA作为模板并加入6 μL RNase Free ddH2O到8 μL,将温度调升至65 ℃加热5 min,随后迅速置于冰上骤冷且静置2 min,使RNA模板变性;基因组DNA去除:加入2 μL 5×gDNA wiper Mix到上一步的混合液中,并用移液枪吹打使之混匀,将温度调至42 ℃加热2 min;最后于 10 μL的混合液中加入2 μL Hiscript Ⅲ Enzyme Mix,2 μL 10×RT Mix,1 μL Radom hexamers和5 μL RNase Free ddH2O于 25 ℃加热5 min,37 ℃加热45 min,85 ℃加热5 s,进行第一链 cDNA的合成。
1.4 番茄病样PCR和RT-PCR检测
常规PCR检测:将提取到的总DNA作为模板与TYLCV特异性引物(表1)进行检测。反应体系(20 μL):TYLCV-F/TYLCV-R引物各0.5 μL,2×Taq Master Mix(Dye Plus)10 μL,模板 2 μL,用ddH2O补足到20 μL。反应程序:94 ℃预变性4 min;随后94 ℃变性30 s,53 ℃退火 30 s,72 ℃延伸45 s,循环数为34;最后于72 ℃延伸10 min,-20 ℃冰箱保存。
RT-PCR检测:将模板分别与常见的番茄病毒病特异性引物(表1)进行检测。PCR反应体系(20 μL):模板cDNA 2 μL、上游引物与下游引物各0.5 μL、2×Taq Master Mix(Dye Plus)10 μL、加入ddH2O并补足到20 μL。反应程序同上。
在扩增结束后,取4 μL PCR/RT-PCR产物于1.0%的琼脂糖凝胶上在118 V的电压下进行电泳检测,36 min左右后在全自动凝胶成像系统记录结果。
1.5 番茄抗病性鉴定
病情分级参照许向阳等[6]的抗性分级方法并稍作调整(表2)。根据番茄群体病情分级标准可分为:免疫I(病情指数为0,植株不带毒)、高抗HR(0<病情指数≤ 2)、抗病R(2<病情指数< 15)、耐病MS(15<病情指数< 30)、感病S(病情指数> 30),病情指数计算参照以下公式:
病情指数=Σ(各级病株数×相对级数值)/(调查总株数×最高严重度代表值)×100
病株率=病株数/调查总株×100%
2 结果与分析
2.1 田间症状调查
田间调查发现,2022年银川地区番茄病毒病发生较为严重,棚室内番茄病毒病主要有6种症状,表现为:(1)叶片缩小、部分变黄, 叶片边缘褪绿变紫,节间缩短,植株矮化严重,不可正常开花结果(图1-A);(2)叶片缩小、褪绿、轻微上卷、出现褐色且不规则形病斑,此症状由下而上逐渐明显(图1-B);(3)叶片上卷严重、黄化明显、叶缘焦枯,节间缩短,长势弱,果实小并存在花脸现象(图1-C);(4)叶脉浓绿、脉间褪绿黄化,叶片边缘焦枯,叶肉增厚, 变脆易碎,植株长势强(图1-D);(5)叶片由叶缘向内侧逐渐褪绿,边缘干枯,叶脉明显,心叶皱缩突起(图1-E);(6)叶片变小增厚,轻者边缘褪绿,重者边缘褪绿且发红(图1-F),在以上6种症状的样品中均能检测到STV。
2.2 番茄病株样品的RT-PCR检测分析
将在产业园采集的139份疑似番茄病毒样本进行总RNA/DNA提取,进而利用特异性引物ToMMV、ToMV、STV、TYLCV、TSWV、TMV、CMV和ToCV对其进行PCR/RT-PCR检测,结果显示在疑似番茄病毒样品中特异性引物ToMV-F/ToMV-R、STV-F/STV-R、TYLCV-F/TYLCV-R、TSWV-F/TSWV-R、TMV-F/TMV-R、ToMMV-F/ToMMV-R、CMV-F/CMV-R和ToCV-F/ToCV-R、分別可扩增出大小480、681、648、425、470、1193、260、450 bp左右的相应条带,且条带清晰,无其他非特异性条带产生,而阴性对照未出现扩增现象,表明在所检测样品种中可检出以上8种病毒。其中,137份病样均检出病毒,有2份样品未检测到,病毒检出率高达98.56%。通过田间调查不同品种番茄感病症状,选取生产上主栽品种‘普罗旺斯的病叶再次进行总RNA/DNA提取,用以上8种病毒种类的特异性引物进行PCR/RT-PCR检测,扩增出681、480、1 193、425和450 bp左右大小的特异性条带(图2),且无杂带出现,说明番茄品种‘普罗旺斯同时被STV、ToMV、ToMMV、TSWV和ToCV侵染。
2.3 侵染不同品种番茄的主要病毒种类及检测结果
表3表明,口感型番茄‘冠蔬106所携带病毒种类最多,检出6种病毒,仅有STV和TMV未检出;其次是樱桃番茄‘191与口感番茄‘原味1号‘普罗旺斯和‘中番9号,检出病毒种类个数皆为5个;樱桃番茄‘千禧与口感番茄‘冠蔬103以及硬果番茄‘168‘塞纳和‘869携带4种病毒,不同番茄品种间病毒种类各不尽相同;樱桃番茄‘193‘白妃和‘香妃9号及口感番茄‘赛硒柿2号 ‘甜脆脆 ‘京番308和‘亚蔬12号以上7个品种均检测出STV、TSWV及ToMMV3种病毒,而口感番茄‘1号除TSWV及ToMMV外,还检测到ToCV; 樱桃番茄‘152‘黄妃及口感番茄‘味多美所检出病毒种类较少,为2种;在‘黑小哥品种的2个疑似病样中,未检测出番茄病毒。
由图3可见,检出率最高的为ToMMV,高达 92.05%,和其他的病毒种类相比有显著差异 (P<0.05),是危害银川地区的主要病毒;其次为TSWV和STV,检出率分别为 76.04%、 73.35%;ToCV、ToMV、TYLCV、CMV和TMV检出率略低,各种类间无差异显著性,分别为 19.48%、16.22%、6.82%、1.52%、1.52%。
2.4 不同品种番茄病毒的复合侵染分析
在137份阳性样品中(表4),发现单一病毒病侵染样品量为7份,复合样本为130份,复合侵染的样品占阳性样本的94.89%,其中由3种病毒复合侵染的样本数量最多,检出率为复合侵染总比的53.08%,主要类型为STV+TSWV+ToMMV、TSWV+ToMMV+ToCV、ToMV+STV+ToMMV、ToMMV+CMV+ToCV、ToMV+TSWV+ToMMV、TSWV+ToMMV+CMV、STV+TYLCV+ToMMV和STV+ToMMV+ToCV,且STV+TSWV+ToMMV为复合侵染优势种;被STV+ToMMV、STV+TSWV和TSWV+ToMMV2种病毒侵染样本占比为23.08%;而由4种病毒复合侵染的比率略低,为17.69%,其病毒复合侵染类型却多达9种,分别为ToMV+TYLCV+TSWV+ToMMV、STV+TSWV+ToMMV+ToCV、ToMV+STV+TSWV+ToMMV、ToMV+TSWV+ToMMV+ToCV、TYLCV+TSWV+ToMMV+ToCV、ToMV+STV+ToMMV+ToCV、STV+TSWV+TMV+ToMMV、STV+TYLCV+TSWV+ToMMV和TSWV+ToMMV+CMV+ToCV;在复合侵染样本中,最多检测出5种病毒复合侵染,类型复杂,为ToMV+STV+TSWV+ToMMV+ToCV。
2.5 不同品种番茄病毒抗性分析
不同番茄品种对病毒病的抗性表现皆不相同。经抗病性调查后,结果表明:番茄‘黑小哥疑似病样中没有发生病毒病,发病率为0.00%,初步定为番茄病毒病免疫品种。其余供试番茄品种均发现不同程度的病毒侵染。发病品种之间发病率存在较大差异,硬果番茄‘塞纳发病率最高,高达27.08%;樱桃番茄‘152发病率最低,为 2.78%。樱桃番茄中‘千禧‘191‘香妃9号和‘152及口感番茄‘冠疏103的病情指数分别为1.39、1.62、1.85、1.85和1.62,为高抗品种;抗性等级为抗病的樱桃番茄有‘193‘白妃‘黄妃,口感番茄有‘原味1号‘甜脆脆‘京番308‘味多美‘亚蔬12号‘中番9号‘赛硒柿2号,硬果番茄有‘168,其中‘168的病情指数最高,高达14.35。而口感番茄‘1号‘冠蔬106‘普罗旺斯和硬果番茄‘塞纳与‘869均处于耐病水平,病情指数分别为16.20、15.05 、15.05、19.68、16.20。在以上品种中,免疫品种占参试总品种的 4.55%,高抗品种占参试总品种的22.73%,而大多数为抗性品种,占总品种数的45.45%。因此,初步认为品种‘黑小哥‘191‘152‘千禧‘香妃9号和‘冠蔬103可以作为宁夏地区春茬设施栽培番茄抗病毒病备选品种(表5)。
3 讨论和结论
现如今,番茄种植业已成为宁夏地区蔬菜种植的主导产业之一,随着其不断的发展,病毒病危害的问题也越发突出,导致番茄品质与产量严重下降,制约着当地番茄产业的发展。前人对宁夏地区病毒病种类有所鉴定与分析,但缺少不同病毒对番茄侵染的主次关系相关报道,因此,对该地区番茄病毒病的发展现状进行系统研究刻不 容缓。
本研究从银川市贺兰园艺产业园11号日光温室采集139份疑似病毒感染番茄叶片,利用分子生物学手段,对其样品进行PCR/RT-PCR病毒分子检测,分析结果显示,侵染番茄的病毒种类伴有以上8种,且98.56%的样品都被病毒所感染。在本试验中,ToMMV为银川地区优势种,检出率高达90.53%,且在当地首次发现,本研究为宁夏自治区番茄上发现ToMMV的首次报道。由于该病毒是近年来植物上新发现的一种病毒,并且,已对多个地区包括番茄在内的多种植物侵染。从2014年中国首次报道该病毒以来,截至到2022年,已有7个省份发现ToMMV[7-9],其中,海南省[10]和辽宁省[11]受到该病毒侵染并引发番茄产量难以提升的困扰。番茄斑驳花叶病毒,属于烟草花叶病毒属,其传播方式主要为汁液摩擦,目前,研究报道指出此病毒亦可寄主在部分作物的种子上[12],因而ToMMV的寄主種类和范围可能较为广泛。并且有相关报道提到,ToMMV在对不同品种番茄之间的抗、耐病性进行评价时比ToMV更容易侵染一些品种,并且表现的症状也更为严重[13],因此,番茄斑驳花叶病毒在银川市大爆发。此外,采样时期温度高,降雨少,棚内粉虱、蓟马大量聚集,TSWV可通过昆虫传播[14],而据最新研究表明STV除了可以种传以外,还可利用花粉快速传播,其传播效率与番茄的品种呈相关关系[15],以上因素与二者普遍发生息息相关,进而使TSWV和STV也成为该地区番茄上不容忽视的主要病毒。
番茄病毒病在各地报道的优势种类有所不同,在不同的品种上亦是如此,其种类繁多,侵染类型较为复杂,复合侵染也层出不穷,且当不同病毒发生复合侵染时,作物往往会表现出协生作用[16]。本研究通过样品鉴定与数据分析发现,银川地区番茄病毒病复合侵染类型共有21个,其中半数以上样本是由3种或4种病毒共同侵染,部分样本甚至出现5种病毒复合侵染的现象,为银川地区番茄病毒病的防控和治理增加难度。而出现番茄病毒病复合侵染严重的现象可能归因于病毒的传播方式和田间管理及外来病毒入侵等,如CMV、ToMV、ToCV和TYLCV可通过两种传播方式进行传播,一种是机械传播,另外则是通过昆虫媒介进行传播扩散[17-18],其中,部分介体传播时可以携带多种病毒,对番茄植株刺吸后,将携带病毒一并传染至植物体内,导致发生多种病毒复合侵染现象。而STV与其他番茄病毒复合侵染的现象较为普遍,据国外检测的报道,STV分别与TMV和TYLCV 复合侵染[19-20]。在国内,复合侵染的现象更为明显,STV与TYLCV、CMV、ToCV于山东寿光在同一样本上被检测到[21];新疆部分番茄样品中发现STV和ToMV共存[22];而北京出现了STV与TYLCV、ToCV复合侵染的现象[23]。除了上述情况之外,在分析结果中发现,超过半数的复合侵染都出现了ToMMV,由此可见,该病毒的入侵使银川市病毒病复合侵染的类型更加多样化。
由于当前尚无明确统一的番茄病毒病抗性评价标准,因此,本试验以烟粉虱、蚜虫、蓟马等昆虫在常规管理条件下传播番茄病毒的方式,将病情指数、病毒PCR检测、病毒检出量及植株长势等综合指标相结合,对不同品种番茄进行抗病性鉴定,与Rubio等[24]的评估方法具有一定的相似性,相较使用单一指标评估更加全面和客观。鉴定结果发现,在本研究所有参试品种中,樱桃番茄‘黑小哥对番茄病毒病免疫,未检测出以上8种番茄病毒病,且在田间表现出长势强,产量高,口感好等诸多优点。其次为樱桃番茄‘千禧‘191‘香妃9号和‘152及口感番茄‘冠疏103,为高抗等级的番茄品种,病毒病侵染率较其他品种偏低,在田间表现良好,而对番茄病毒病表现出抗病的樱桃番茄‘193与口感番茄‘赛硒柿2号病情指数分别为5.56和6.02,二者的发病率与高抗番茄‘香妃9号相同,皆为8.33%,且在田间植株总体表现出健康状态。此外,媒介昆虫是虫媒植物病毒传播扩散的重要“桥梁”[25],基于宁夏地区5-9月气温高,降雨少,是烟粉虱、蚜虫、蓟马等昆虫生存的有利条件,为了避免因昆虫传毒而致番茄病毒病大爆发现象的出现,暂不采用携带5种病毒的樱桃番茄‘191。
综合考虑,初步判定‘黑小哥‘千禧‘香妃9号‘152‘冠疏103‘193和‘赛硒柿2号这7个品种为抗病毒品种,后期可进行品种与多种病毒靶标对峙抗性,进一步验证抗病毒品种,为宁夏番茄病毒病的综合防控及番茄的产业发展提供理论依据和技术指导。
参考文献 Reference:
[1] 刘 卫,姚永康,刘士辉.番茄黄化曲叶病毒及其抗性基因研究进展[J].上海农业科技,2015(4):15-16,23.
LIU W,YAO Y K,LIU SH H.Progress in the study of tomato yellowing varroa virus and its resistance genes[J].Shanghai Agricultural Science And Technology,2015(4):15-16,23.
[2] 沙 龍,高艳明,李建设.宁夏番茄黄化曲叶病毒病分子鉴定及防控措施[J].北方园艺,2013(12):119-121.
SHA L,GAO Y M,LI J SH.Molecular identification of yellowing varroa virus disease of tomato in Ningxia and preventive and control measures[J].Northern Horticulture,2013(12):119-121.
[3] 刘 勇,李 凡,李月月,等.侵染我国主要蔬菜作物的病毒种类、分布与发生趋势[J].中国农业科学,2019,52(2):239-261.
LIU Y,LI F,LI Y Y,et al.Species,distribution and occurrence trends of viruses infesting major vegetable crops in China[J].Scientia Agricultural Sinica,2019,52(2):239-261.
[4] 曹金强,谢学文,柴阿丽,等.李宝聚博士诊病手记(九十三)番茄斑萎病毒病在宁夏的发现与防治[J].中国蔬菜,2016(4):87-89.
CAO J Q,XIE X W,CHAI A L,et al.Dr.Li Baojus notes on disease diagnosis (93) detection and control of Tomato spotted wilt virus disease in Ningxia[J].China vegetables,2016(4):87-89.
[5] 陈利达,石延霞,谢学文,等.我国不同地区番茄主要病毒病种类的分子检测与分析[J].华北农学报,2020,35(1):185-193.
CHEN L D,SHI Y X,XIE X W,et al.Molecular detection and analysis of the main virus disease species of tomato in different regions of China[J].Acta Agriculturae Boreali-Sinice,2020,35(1):185-193.
[6] 许向阳,李景富,孙清芳.番茄TMV、叶霉病、枯萎病苗期多抗性鉴定方法研究[J].北方园艺,2002(3):38-40.
XU X Y,LI J F,SUN Q F.Identification method of multiple resistance to TMV,leaf mold and blight of tomato at seedling stage[J]. Northern Horticulture,2002(3):38-40.
[7] LI Y Y,WANG Y,HU J J,et al.The complete genome sequence,occurrence and host range of Tomato mottle mosaic virus Chinese isolate [J].Virology Journal,2017,14(1):15.
[8] LIY Y,WANG CH L,XIANG D.First report of Tomato mottle mosaic virus infection of pepper in China [J].Plant Disease,2014,98(10):1447.
[9] CHEN H Y,LUO D Q,CAO X R.First report of Tomato mottle mosaic virus in tomato crops in China [J].Plant disease,2018,102(10):2051.
[10] ZHAN B H,CAO N,WANG K N,et al.Detection and characterization of an isolate of tomato mottle mosaic virus infecting tomato in China [J].Journal of Integrative Agriculture,2017,17(5):1207-1212.
[11] 涂丽琴,吴淑华,高丹娜,等.辽宁省番茄上番茄斑驳花叶病毒的分子鉴定[J].江苏农业学报,2020,36(5):1126-1132.
TU L Q,WU SH H,GAO D N,et al.Molecular identification of tomato mottle mosaic virus on tomatoes in Liaoning Province[J].Jiangsu Journal of Agriculture Sciences,2020,36(5):1126-1132.
[12] LOVELOCK D A,KINOTI W M,BOTTCHER C, et al.Tomato mottle mosaic virus intercepted by Australian biosecurity in Capsicum annuum seed [J].Australasian Plant Disease Notes:Journal of the Australasian Plant Pathology Society,2020,15(4):8.
[13] NAGAI A,DUARTE M L L,CHAVES L R A,et al.Tomato mottle mosaic virus in Brazil and its relationship with Tm-22 gene [J].European Journal of Plant Pathology,2019,155:353-359
[14] 李云洲,默 寧,闫见敏,等.番茄斑萎病毒病研究进展[J].园艺学报,2018,45(9):1750-1760.
LI Y ZH,MO N,YAN J M,et al.Progress in research on tomato spotted wilt virus disease[J].Acta Horticulturae Science,2018,45(9):1750-1760.
[15] 杨海燕,崔百明,张 强,等.新疆番茄病毒病检测及南方番茄病毒全基因组序列测定与传播特性分析[J].植物保护学报,2017,44(2):253-259.
YANG H Y,CUI B M,ZHANG Q,et al.Detection of tomato virus disease in Xinjiang and determination of whole genome sequence and transmission characteristics of southern tomato virus[J].Acta Phytophylacica Sinica,2017,44(2):253-259.
[16] JERZY S.Facilitative and antagonistic interactions between plant viruses in mixed infections [J].Molecular Plant Pathology,2012,13(2):204-216.
[17] MOODLEY V,GUBBA A,MAFONGOVA P L.Occurrence of Tomato chlorosis virus (ToCV) on Datura stramonium near tomato crops (Solanum lycopersicum) in South Africa [J].Plant Disease,2016,100(7):213.
[18] ZHAO W W,WAN Y R,XIE W,et al.Effect of spinosad resistance on transmission of tomato spotted wilt virus by the western flower thrips (Thysanoptera:Thripidae) [J].Journal of Economic Entomology,2016,109(1):62.
[19] CANDRESSE T,MARAIS A,FAURE C.First report of southern tomato virus on tomatoes in southwest france [J].Plant Disease,2013,97:1124.
[20] VERBEEK M,DULLEMANS A M,ESPINO A,et al.First report of southern tomato virus in tomato in the canary islands,Spain [J]. Journal of Plant Pathology,2015,97(2):329.
[21] CHELLAPPAN P,ZHENG Y,LI R G, et al.Complete genome sequence of southern tomato virus identified in China using next-generation sequencing [J].Genome Announcements,2015,3(5):e01226-15.
[22] [ZK(#]张 强,崔百明,郑银英,等.新疆加工番茄上南方番茄病毒外壳蛋白基因的克隆与原核表达[J].西北农林科技大学学报(自然科学版),2015,43(4):118-122.
ZHANG Q,CUI B M,ZHENG Y Y,et al.Cloning and prokaryotic expression of the southern tomato virus capsid protein gene on processed tomatoes in Xinjiang[J].Journal of Northwest A&F University(Natural Science Edition),2015,43(4):118-122.
[23] 董云浩,雷喜紅,李云龙,等.警惕种子传带的南方番茄病毒Southern tomato virus对我国番茄产业的危害[J]. 植物保护,2019,45(3):254-256.
DONG Y H,LEI X H,LI Y L,et al.Warning about the risk of seed-borne Southern tomato virus to the tomato industry in China[J].Plant Protection,2019,45(3):254-256.
[24] RUBIO L,HERRERO J R,SARRIO J,et al.A new approach to evaluate relative resistance and tolerance of Tomato cultivars to begomoviruses causing the tomato yellow leaf curl disease in Spain [J]. Plant Pathology,2003,52:763-769.
[25] 丁天波,周 雪,杨 楠,等.ToCV单独侵染和TYLCV&ToCV复合侵染番茄植株上烟粉虱寄主适应性及寄主植物营养成分含量和防御反应变化[J].昆虫学报,2021,64(3):384-391.
DING T B,ZHOU X,YANG N,et al.Host adaptation and changes in nutrient content and defence responses of host plants to the sooty fly on tomato plants infested with ToCV alone and TYLCV & ToCV in combination[J].Acta Entomologica Sinica,2021,64(3):384-391.
Molecular Identification and Resistance Evaluation of Major Tomato Virus Diseases in Different Varieties in Ningxia Region
Abstract
To identify virus speciesin tomatoes in Ningxia, analyze the status of compound infestation and evaluate the disease resistance of different varieties of tomatoes,139 suspected virus samples (associated with 22 varieties) of tomatoes were collected at Helan Horticultural Industrial Park in Ningxia.The disease samples were detected and identified using RT-PCR with eight major tomato virus-specific primers. The results showed that among the suspected cases, the virus detection rate was 98.56%.Tomato mottle mosaic virus (ToMMV) was detected for the first time in Yinchuan, with a significantly higher detection rate of 92.05% compared to other viruses, which was the dominant local virus source. The detection rates of Tomato spotted wilt virus (TSWV) and Southern tomato virus (STV) were 76.04% and 73.35%,respectively. Conversely, the detection rates for Tomato chlorosis virus (ToCV), Tomato mosaic virus (ToMV), Tomato yellow leaf curl virus (TYLCV), Cucumber mosaic virus (CMV), and Tobacco mosaic virus (TMV) were relatively low. With the analysis of co-infection phenomenon of tomato virus, it was found that the co-infection samples accounted for 94.89% of the positive samples.Among these,the con-infection rates of three viruses accounted for 53.08% of the total co-infection rate, and there were many co-infection types involving three or four virus species. In addition, according to the analysis of the infection situation of the 22 tomato varieties, ‘Guanshu 106 was the most infected variety with six kinds of virus, while the eight viruses was not detected in ‘Heixiaoge .A preliminary assessment was conducted on the resistance of tomato varieties to viral diseases, the varieties ‘Heixiaoge ‘Qianxi ‘Xiangfei No. 9 ‘152‘Guanshu 103‘193 and ‘Saixishi No. 2 were identified as virus-resistant varieties. In summary, when confronted with invasive foreign viruses and the occurrence of co-infections in tomato virus disease,it is crucial to pay close attention and exercise vigilance.
Key words Tomato virus disease; Southern tomato virus (STV); Tomato spotted wilt virus (TSWV); Tomato mottle mosaic virus (ToMMV); Co-infection
