血清ITIH4和MCL-1水平与急性缺血性脑卒中患者病情程度及预后的关系
2024-04-25席俊男冯松松薛惠元腾东陈丽薇
席俊男,冯松松,薛惠元,腾东,陈丽薇
脑卒中是导致中老年人死亡和残疾的主要原因之一[1]。急性缺血性脑卒中(acute ischemic stroke, AIS)约占脑卒中的70%,具有起病急、发展迅速及预后差等特点[2]。间α胰蛋白酶抑制因子重链4(inter alpha trypsin inhibitor heavy chain 4,ITIH4)主要由肝脏合成并分泌,在血液中被血浆激肽释放酶切割活化,参与炎性反应、免疫及肿瘤等疾病过程[3-4]。近年来发现,ITIH4在心脑血管疾病中发挥抗炎效应,与动脉粥样硬化程度呈负相关,是评估主要不良心血管事件的血清标志物[5]。髓样细胞白血病因子-1(myeloid cell leukemia sequence 1,MCL-1)属于B细胞淋巴瘤蛋白2家族成员,参与维持线粒体外膜的完整性,发挥抗凋亡的生物学效应[6]。研究发现,脑组织缺血再灌注损伤过程中MCL-1表达下调,导致神经细胞凋亡增加,是潜在的缺血性脑卒中的生物标志物[7]。目前AIS患者血清ITIH4、MCL-1表达水平及临床意义尚不清楚。本研究通过检测AIS患者血清ITIH4、MCL-1的表达水平,探讨两者与AIS病情程度及预后的关系,报道如下。
1 资料与方法
1.1 临床资料 纳入2019年7月—2022年7月河南科技大学附属黄河医院神经内科诊治AIS患者128例(AIS组),男74例,女54例;年龄37~81(63.02±6.53)岁;体质量指数18.47~26.70(23.37±2.19)kg/m2;病程2~72(21.47±6.89)h;均无明显诱因;AIS家族史4例;有吸烟史45例;基础病:高血压54例,糖尿病36例。另选取同期医院体检的健康者70例为健康对照组,男40例,女30例;年龄40~78(62.73±5.86)岁;体质量指数18.26~26.57(23.20±2.11)kg/m2;AIS家族史1例;有吸烟史26例;基础病:高血压30例,糖尿病15例。2组受试者性别、年龄、体质量指数、AIS家族史、吸烟史、高血压史、糖尿病史比较,差异无统计学意义(P均>0.05),具有可比性。本研究经医院伦理委员会审核批准(2019-S058),受试者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①所有病例均符合《中国急性缺血性脑卒中诊治指南(2018)》制定的AIS诊断标准[8];②头颅MR检查显示与临床症状相符合的责任病灶;③首次发病或复发但既往未遗留明显后遗症;④发病72 h内入院;⑤年龄>18岁。(2)排除标准:①短暂脑缺血发作、颅内占位、脑出血及脑外伤患者;②合并急慢性肾功能不全,或严重的心肺、肝脏疾病;③合并自身免疫性疾病或恶性肿瘤;④合并血液性疾病;⑤合并神经退行性疾病、颅内感染性疾病、肠道炎性反应;⑥发病前任何原因所致生活不能自理。
1.3 观测指标与方法
1.3.1 血清ITIH4、MCL-1检测:患者入院后次日清晨、健康对照组体检时留取肘静脉血5 ml,4℃冰箱静置2 h,离心留取上层血清。采用多功能酶标仪(美国PerkinElmer有限公司,型号EnVisionXcite)以酶联免疫吸附法测定血清ITIH4(试剂盒购自上海臻科生物科技公司,货号ZK-3744)、MCL-1(试剂盒购自上海信裕生物科技公司,货号XY-MCL1-Hu)。按照试剂盒说明书完成检测。
1.3.2 梗死部位及面积测定:患者入院72 h内采用美国 GE 公司 HDXT1.5T磁共振仪测量颅脑梗死部位(皮质、皮质下、脑干/小脑),计算梗死面积。
1.3.3 病情程度评估:参考美国国立卫生研究院卒中量表(National Institute of Health stroke scale,NIHSS)[9]对AIS患者入院24 h病情程度评估,包含意识水平检查、双眼凝视及视野情况、面部瘫痪程度、上下肢运动检查、共济失调检查、有无感觉障碍、语言表达情况、构音是否正常、有无忽视症状共计 13 个部分,范围0~42分,分数越高神经功能受损越严重,并分为轻度亚组(NIHSS<6分,n=42),中度亚组(6分≤NIHSS<14分,n=52),重度亚组(NIHSS≥14分,n=34)[10]。
1.3.4 预后评估:出院后90 d对所有AIS患者进行门诊和电话随访,根据随访情况进行改良Rankins评分(modified Rankins score, mRS)[11],包括是否存在神经功能缺损症状、能否完成日常职责和活动、是否可独立自理,评分0~5分,评分越高预后越差,并分为预后不良亚组(评分>2分,30例)和预后良好亚组(评分≤2分,98例)。采用简易智能状态量表(mini-mental state examination,MMSE)和蒙特利尔认知评估量表(Montreal cognitive assessment, MoCA)评估AIS患者认知功能,评分范围均为0~30分,分值越低,患者认知功能越差。

2 结 果
2.1 2组血清ITIH4、MCL-1水平比较 AIS组患者血清ITIH4、MCL-1水平分别为(24.17±4.58)μg/L和(7.03±1.34)μg/L,低于健康对照组的(63.29±8.17)μg/L和(22.53±3.64)μg/L,差异均有统计学意义(t=43.211、43.191,P均<0.001)。
2.2 不同病情程度AIS患者血清ITIH4、MCL-1水平比较 血清ITIH4、MCL-1水平比较,轻度亚组>中度亚组>重度亚组患者,差异均有统计学意义(P<0.05),见表1。

表1 不同病情程度AIS患者血清ITIH4、MCL-1水平比较
2.3 不同预后AIS患者病理特征比较 预后不良亚组梗死面积、入院24 h NIHSS评分高于预后良好亚组,血清ITIH4、MCL-1水平及出院3个月MMSE评分、MoCA评分低于预后良好亚组,差异具有统计学意义(P均<0.01),见表2。

表2 不同预后AIS患者病理特征比较
2.4 血清ITIH4、MCL-1与病情程度及预后的相关性 AIS患者血清ITIH4、MCL-1与梗死面积、入院24 h NIHSS评分呈负相关,与出院3个月的MMSE评分、MoCA评分呈正相关(P均<0.01),见表3。
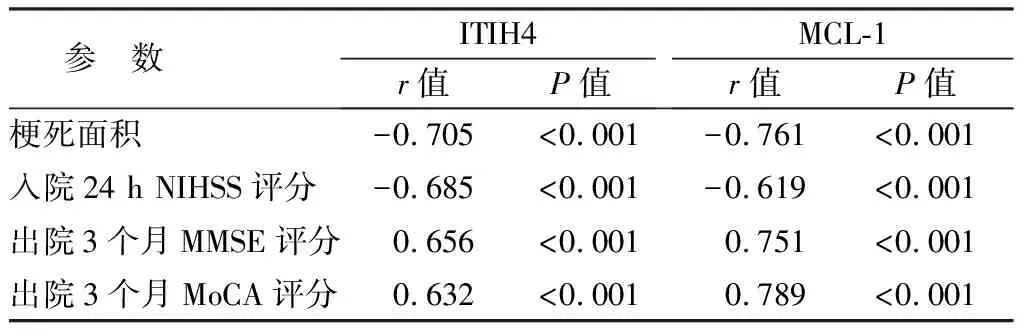
表3 AIS患者血清ITIH4、MCL-1与病情程度的相关性
2.5 影响AIS患者预后的多因素Logistic回归分析 以AIS患者预后为因变量(预后不良=1,预后良好=0),以上述结果中P<0.05项目为自变量,进行多因素Logistic回归分析,结果显示,出院3个月MMSE评分高、出院3个月MoCA评分高是影响AIS患者预后不良的独立保护因素,血清ITIH4低、MCL-1低、梗死面积大、入院24 h NIHSS评分高是危险因素(P均<0.01),见表4。

表4 影响AIS患者预后的多因素Logistic回归分析
2.6 血清ITIH4、MCL-1预测AIS预后的价值 绘制血清ITIH4、MCL-1预测AIS预后价值的预测效能ROC曲线,并计算曲线下面积(AUC),结果显示:血清ITIH4、MCL-1及两项联合预测AIS预后不良的AUC分别为0.811、0.835、0.923,两项联合预测AIS预后不良的AUC大于单一指标,差异有统计学意义(Z=4.258、4.119,P均<0.001),见表5,图1。
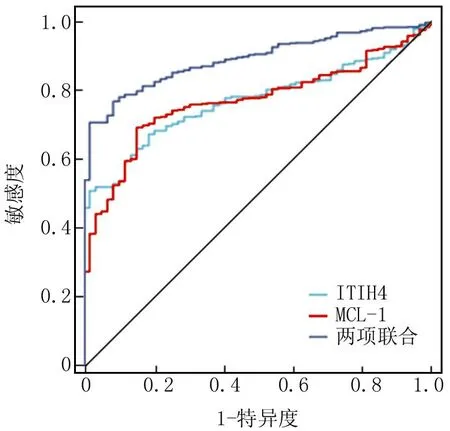
图1 血清ITIH4、MCL-1预测AIS预后不良的ROC曲线分析

表5 血清ITIH4、MCL-1预测AIS预后不良的价值
3 讨 论
脑卒中是危害我国居民健康的重大公共卫生问题,中国脑卒中病死率为149.49/10万,占居民总死亡率的22.3%[12]。AIS是脑卒中最常见的类型,病理表现为脑血栓形成或脑血管闭塞后局部缺血缺氧,引起脑细胞能量代谢障碍、钙超载及氧化应激等的发生,导致脑细胞的死亡,是中老年人致死致残的主要原因之一。深入研究AIS疾病机制,寻找能有效评估AIS预后的血清标志物,对于AIS的早诊断、早治疗具有较大临床意义。
ITIH4属于丝氨酸蛋白酶抑制剂家族成员,其作为肝源性血清糖蛋白,参与透明质酸代谢、细胞外基质代谢的调节过程,与恶性肿瘤、炎性反应及心血管疾病关系密切[13]。近年来发现,血清ITIH4能够改善脑组织AIS急性期炎性反应,与AIS患者神经功能康复有关,是潜在的反映AIS患者预后的血清生物标志物[14]。本研究中,AIS患者血清ITIH4水平降低,并与患者病情程度有关,提示ITIH4的降低参与促进AIS疾病过程,与既往血清利用蛋白质谱的研究结果一致[15]。分析其原因,ITIH4作为一种抗炎因子,在心脑血管疾病中发挥保护作用。研究表明,ITIH4作为一种糖蛋白和蛋白酶抑制剂,通过抑制基质金属蛋白酶和促炎细胞因子介导的纤维化稳定细胞外基质,能够抑制动脉粥样硬化的发生,改善冠状动脉血管狭窄程度,降低冠心病患者主要不良心血管事件的发生风险[5,16]。AIS患者血清ITIH4降低增加肿瘤坏死因子α、白介素6等促炎细胞因子的分泌,加重AIS患者病变组织炎性反应程度,导致AIS患者病情加重。本研究中,AIS患者血清ITIH4与MMSE评分、MoCA评分呈正相关,提示ITIH4的降低加重AIS患者认知功能障碍。分析其原因,ITIH4的降低促进AIS后神经元死亡,加重AIS患者认知功能障碍。有学者证实,ITIH4能够抑制白介素6、白介素8及白介素17A等促炎细胞因子的产生,抑制AIS中过量补体活化,并与细胞外组蛋白形成ITIH4组蛋白复合物,阻断胶质细胞中补体激活受体C5aR1,减轻对海马神经元的细胞毒性,而小鼠大脑中动脉阻塞后6 h给予静脉注射ITIH4,能显著改善AIS模型小鼠神经功能损伤的严重程度和认知功能[17]。本研究中,血清ITIH4低是影响AIS患者预后不良的独立危险因素,提示检测血清ITIH4水平有助于评估AIS患者预后。笔者分析,ITIH4能够抑制中性粒细胞活化,维持中性粒细胞形态,抑制活性氧释放及中性粒细胞与血脑屏障中血管内皮细胞的黏附,发挥保护缺血脑组织的效应[17]。而AIS发生时,ITIH4的降低会导致大量促炎细胞因子的产生以及过量的补体激活,引起外周炎性细胞,如中性粒细胞、单核巨噬细胞等募集到脑组织损伤部位,加重缺血脑组织炎性反应,特别是缺血半影区的炎性反应,加重神经元损伤程度,导致AIS患者不良预后[18]。
MCL-1编码基因定位于人类染色体1q21, 其作为Bcl-2家族成员,能够下调促凋亡蛋白BH-3域蛋白,具有重要的抗凋亡生物学效应,与肿瘤、DNA损伤修复及缺血再灌注损伤等病理生理学过程关系密切。本研究中,AIS患者血清MCL-1水平降低与患者病情程度有关,提示MCL-1的降低参与促进AIS疾病进展。AIS中MCL-1的表达受miR-106b-5p的表达调控。有学者通过双荧光素酶实验证实MCL-1是miR-106b-5p的直接下游靶基因,在大脑中动脉闭塞的缺血性脑卒中大鼠模型中,脑组织中miR-106b-5p表达显著升高,miR-106b-5p降低MCL-1和B细胞淋巴瘤-2的表达,抑制超氧化物歧化酶的活性,促进神经元的氧化应激损伤及细胞凋亡,加重神经功能缺损的程度[19]。本研究中,AIS患者血清MCL-1与MMSE评分、MoCA评分呈正相关,提示MCL-1的降低加重AIS患者认知功能障碍。分析其原因,海马区在学习、认知和记忆存贮中均发挥重要的功能,MCL-1能够通过减轻AIS中海马区神经元损伤,发挥神经保护效应[20-21]。研究表明,缺血性脑卒中动物模型中,缺血脑组织及血清中MCL-1的表达显著降低,海马CA1锥体神经元的存活率显著降低,大鼠出现明显的焦虑样行为和认知障碍,应用葛根素或磷脂酰肌醇3激酶抑制剂LY294002治疗后,磷脂酰肌醇3激酶/Akt1/糖原合成酶激酶-3β信号通路激活,MCL-1表达上调,减轻海马神经元缺血再灌注损伤及认知功能障碍[22]。本研究中,血清MCL-1低是影响AIS患者预后不良的独立危险因素,提示检测血清MCL-1水平有助于评估AIS患者预后。分析其原因,MCL-1的表达降低能够抑制Wnt/β-连环蛋白途径,增加基质金属蛋白酶9的产生,促进SH-SY5Y神经元的凋亡和炎性反应,促进脑组织水肿及神经功能缺损的程度[23]。本研究中,血清ITIH4、MCL-1联合预测AIS预后不良的诊断效能较高,表明血清ITIH4、MCL-1联合能够有效评估AIS患者的预后,临床医生可参考血清ITIH4、MCL-1水平,对AIS患者出院后3个月神经功能缺损情况进行预测,对于预后不良的高危患者,临床上给予积极有效的干预治疗及随访,尽可能改善患者的预后,降低致残和致死率。
综上所述,AIS患者血清ITIH4、MCL-1水平降低,且AIS病情越重,血清ITIH4、MCL-1水平降低更为明显。血清ITIH4、MCL-1水平是影响AIS患者预后的独立因素,ITIH4、MCL-1联合对AIS患者的预后具有较高的预测价值,可能为AIS的分层管理和预测预后提供参考。本研究也存在一定的局限,其一是患者入院时的 NIHSS 评分以及随访过程中对患者的mRS评分可能存在一定的评分误差。其二是入组病例数偏少且仅为单中心研究,存在一定的纳入偏倚。后续的研究中将通过增加样本量、开展多中心研究来纠正纳入偏倚,以进一步研究AIS患者血清ITIH4、MCL-1的临床意义。
利益冲突:所有作者均声明无利益冲突
作者贡献声明
席俊男:设计研究方案,实施研究过程,论文撰写;冯松松:提出研究思路,分析试验数据,论文审核;薛惠元:资料搜集整理;腾东:进行统计学分析;陈丽薇:课题设计,论文修改
