基于营养风险评估的个体化饮食管理对乙型肝炎肝硬化失代偿期营养状况及生活质量的影响
2024-04-25刘新
刘 新
(天津市第二人民医院肝病二科,天津 300192)
肝脏具有极其复杂的功能,为蛋白质、脂肪以及糖代谢的主要器官。乙型肝炎(乙肝)肝硬化属于一个病理概念,指在病理组织学上可见肝纤维组织增生,继而分割包绕肝小叶形成假小叶的病理状态[1-2]。乙肝肝硬化起病隐匿,早期可无明显症状,直至发展为失代偿期后,才会出现腹水、低蛋白血症、感染以及上消化道出血等一系列症状[3]。目前临床暂未找到抑制肝硬化代偿期发展为失代偿期的有效方法,以致该病预后普遍较差,更甚者还会发展为原发性肝癌[4-5]。据报道,肝硬化一旦发展为失代偿期,其肝脏功能会随之发生异常,其相关联的代谢途径也会发生障碍,导致患者普遍存在不同程度的代谢性营养不良,从而引起低蛋白血症,造成腹水,增加疾病死亡率[6-7]。因此,改善乙肝肝硬化失代偿期患者的营养状况,增加蛋白浓度是治疗该病的关键[8]。本研究基于营养风险评估,对患者实施个体化饮食管理,以期改善患者的营养状况,提高其生活质量,改善预后。
1 资料与方法
1.1一般资料:选取天津市第二人民医院2022年1月~2022年12月收治的100例乙肝肝硬化失代偿期患者,按照随机数字表法分为试验组和对照组,每组各50例。试验组男26例,女24例,年龄35~55岁,平均(45.26±3.42)岁;病程10~17个月,平均(13.37±1.31)个月;对照组男27例,女23例,年龄36~55岁,平均(45.38±3.22)岁;病程11~18个月,平均(13.59±1.42)个月。两组患者的年龄以及病程比较,差异无统计学意义(P>0.05),具有可比性。此次研究经过本院医学伦理委员会同意。纳入标准:①经过基础体格、肝功能、免疫学以及彩超检查确诊为乙肝肝硬化;②处于失代偿期;③年龄<55周岁;④言语交流无障碍;⑤患者知情同意。排除标准:①合并肿瘤;②处于哺乳期或妊娠期女性;③合并肝性脑病或肝功能衰竭;④合并糖尿病。
1.2方法:两组患者均给予统一的保肝、降酶以及退黄等常规治疗,若有合并腹水的患者,则对其给予利尿剂等常规药物治疗。对照组:给予常规饮食治疗管理。常规饮食治疗的基本原则:①适宜的能量摄入:能量供给量按35~40 kCal/(kg·d)或1.3倍的静息能量消耗(REE)测量值供给。肥胖者可在保证足够的蛋白质摄入量>1.5 g/(kg·d)的情况下,全日减少能量500~800 kCal,以实现体重减轻5%~10%且不损害机体蛋白质储备。能量供给以碳水化合物为主,每日提供易消化、产气少的粮食为主,可经常轮换选择米饭、粥、花卷、面条、馒头、馄饨等主食。②适量的蛋白质摄入:蛋白质可按1.2~1.5 g/(kg·d)供给,其中优质蛋白占1/2~2/3,鼓励多选用鱼类、瘦肉类、大豆类与奶类,必要时可适量选用蛋白粉。当患者肝功能严重减退时,应限制蛋白质的摄入,且摄入蛋白质以植物性蛋白为好。③适量的脂肪摄入:脂肪的选择以不饱和脂肪酸为主,少用或限用饱和脂肪酸。④及时补充矿物质:尤其注意钾、锌、钙、镁和铁等矿物质的补充。⑤全面补充维生素:多进食含维生素丰富的食物,选用容易消化吸收的蔬菜和水果如西红柿、嫩叶菜、黄瓜、胡萝卜、苹果、香蕉等。肝硬化合并贫血时,适当补充维生素B12和叶酸;有凝血障碍者,可多选用含维生素K丰富的食物。⑥酌情限制食盐和液体的摄入量:患者以低盐饮食为宜,每日食盐约1.5~2 g,水<1 000 ml;如有低钠血症,水<500 ml。试验组:在对照组的基础上,实施基于营养风险评估的个体化饮食管理。实施方案为:①首先建立工作小组:组建包括护士长、责任护士、责任医师以及营养师在内的工作小组,对工作组成员进行营养干预的相关培训,培训内容包括肝硬化失代偿期患者的常规饮食要求、营养风险筛查2002(NRS 2002)使用方法以及营养治疗策略,同时借助维普、知网等数据库下载相关文献,以循证医学为依据,制定每位患者的个体化饮食治疗方案。②患者入院24 h内,责任护士使用中华医学会肠外肠内营养学分会推荐的NRS 2002对患者实施营养风险筛查,其内容包括初步筛查和最终筛查两个部分。NRS 2002初步筛查表包括四个项目:①是否BMI<18.5 kg/m2;②患者在过去3个月是否有体重下降;③患者在过去1 w内是否有摄食减少;④患者是否有严重疾病。最终筛查包括三部分内容:①年龄评分:18~69岁为0分,≥70岁为1分;②疾病严重程度评分:0~3分;③营养状况受损程度评分:0~3分。最终筛查结果判定:NRS 2002总评分≥3分代表存在营养风险;1~2分代表可能存在风险;0分代表无风险;④营养师每日根据患者的营养状况和肝功能情况制定3~4套个性化饮食食谱以供患者选择。餐次安排为5餐/d,其中早中晚三餐为主食,午餐和晚餐中间、晚餐后2 h加餐。⑤责任护士需记录患者每日进食情况,并于每日下午17∶00前进行总结,将总结报告发送给营养师,并请营养师评价患者的食物摄入是否科学合理,确保患者每日摄入足够的能量和营养素。⑥工作小组每周开展一次营养评价,及时调整患者的个性化饮食治疗方案。
1.3观察指标:①营养状况:干预前后空腹采血2~3 ml,经3 000 r/min、半径3 cm离心处理后,分离血清、血浆,取血清,采用酶联免疫吸附试验(ELISA)测定:前白蛋白(PA)、白蛋白(ALB)以及转铁蛋白(TRF)。②肝功能指标:干预前后空腹采血2~3 ml,经3 000 r/min、半径3 cm离心处理后,分离血清、血浆,取血清,采用全自动分析仪测定:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、总胆红素(TBIL)。③门静脉压力:干预前后使用彩色多普勒超声检测:门静脉主干内径、血流量以及血流速。④生活质量:应用SF-36量表[9]为调查工具,调查患者心理领域、生活领域、社会关系领域、独立性领域4个维度。每个维度均为100分,分数越高表示生活质量越好。
1.4统计学分析:使用SPSS25.0软件进行χ2检验及t检验。
2 结果
2.1两组营养状况比较:干预前,两组患者的PA、ALB以及TRF差异无统计学意义(P>0.05)。干预后试验组患者的PA、ALB以及TRF均明显高于对照组,差异有统计学意义(P<0.05)。见表1。
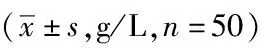
表1 两组营养状况比较
2.2两组肝功能指标比较:干预前,两组患者的AST、ALT以及TBIL差异无统计学意义(P>0.05)。干预后,试验组AST、ALT以及TBIL均低于对照组,差异有统计学意义(P<0.05)。见表2。
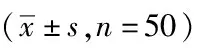
表2 两组肝功能指标比较
2.3两组门静脉压力比较:干预前,两组患者的主干内径、血流量以及血流速差异无统计学意义(P>0.05)。干预后,试验组的主干内径与血流量低于对照组,且血流速高于对照组,差异有统计学意义(P<0.05)。见表3。
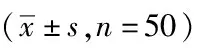
表3 两组门静脉压力比较
2.4两组生活质量比较:干预前,两组患者的心理领域、生活领域、社会关系领域、独立性领域差异无统计学意义(P>0.05)。干预后,试验组的心理领域、生活领域、社会关系领域、独立性领域评分均明显高于对照组,差异有统计学意义(P<0.05)。见表4。
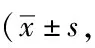
表4 两组生活质量比较分,n=50)
3 讨论
乙肝肝硬化失代偿期的患者均会伴随不同程度的肝功能损害,引起消化道功能下降、蛋白质摄入量不足,甚至出现低蛋白血症,严重影响患者康复。对于失代偿期患者来说,人体机能普遍较弱,难以正常进食,导致蛋白质-能量营养不良[10-11]。由于营养不良早期难以诊断,因此选择合理的工具评估营养风险,制定科学有效的饮食管理方案至关重要[12]。
本研究选取PA、ALB、TRF、AST、ALT以及TBIL指标对患者进行评估,可反映患者干预前后营养状况及肝功能的变化。本次研究由专业人员组建小组并参考国内外权威文献,对每位患者以NRS 2002量表为基础进行了详细的营养风险评估,同时根据患者每日所需摄入的能量与蛋白质制定个性化食谱,确保蛋白质和能量能够足量摄入,使患者体内由足够的能量供应来减轻体内蛋白的消耗程度,以此满足患者机体营养需求、减轻肝脏负担,使机体抵抗力提高,促进腹水的消退或降低腹水发生风险,促进肝功能尽早恢复[13]。
乙肝肝硬化失代偿期患者的蛋白质摄入不足,会引起体内蛋白水平降低,从而进一步影响血浆胶体渗透压,增加了门静脉高压的发生率,而门静脉压力若超过正常范围,则易导致食管胃底静脉破裂出血、肝肾综合征、脾大等一系列并发症,严重影响肝硬化预后[14-15]。本研究应用基于营养风险评估的个体化饮食管理,以患者摄入总热量为基础,跟随临床指标进行增减食物,补充患者所需能量和营养素,促进肝细胞的修复和再生,促进蛋白质合成,并为每位患者制定3~4套食谱,便于患者根据自己偏好选择,提高患者的饮食倾向,增加食欲,抑制机体糖代谢紊乱,有利于肝脏储备营养,降低门静脉高压发生率。本研究结果说明科学的饮食管理不仅可以改善患者病情,使其身心状态明显改善,积极面对生活及与他人交往,进而提高其生活质量,预后良好。
综上,基于营养风险评估的个体化饮食管理对乙肝肝硬化失代偿期患者具有显著的临床效果,具有推广应用价值,可作为首选的饮食管理模式,但本研究也因患者地域存在局限性、样本量少等因素,结论可能存在地区差异性,需要进一步完善不足之处,以便患者获得更好的体验效果。
