施氮对紫花苜蓿干旱复水后生长恢复能力的影响
2024-04-24臧军蕊张钰婷张英豪刘洋铭邓文慧刘世鹏孙娈姿
臧军蕊,张钰婷,张英豪,刘洋铭,邓文慧,刘世鹏,孙娈姿
(1.西北农林科技大学草业与草原学院, 陕西 杨凌 712100;2.延安大学生命科学学院, 陕西 延安 716000)
气候变化正在改变全球的降水格局,干旱发生的频率不断增加,干旱已成为限制植物生长的主要胁迫之一[1]。植物对干旱的适应表现在两个方面,一是抗旱性,即干旱下保持正常生理功能和生长水平的能力;二是恢复能力,即复水后恢复到正常生长水平的能力[2]。紫花苜蓿(Medicago sativa)因营养价值好、产量高等优点,被誉为“牧草之王”。然而,紫花苜蓿耗水量大,栽培过程中常受到干旱胁迫[3],降水和灌溉使“干旱-复水”成为紫花苜蓿生长过程中经常面对的环境变化。因此,干旱的适应性是决定紫花苜蓿高产和稳产的关键。
干旱抑制植物对水分和养分的吸收,从而影响植物的生长。然而,植物在复水后却表现出不同的恢复能力。研究表明,同未受干旱的植物相比,经历干旱复水的植物,其抗逆性和水分利用效率会有所提高[4-5],生长速度加快,发生“补偿性生长”。也有研究表明,由于干旱时造成的损伤,植物复水后则无法恢复至正常水平。植物复水后的恢复能力与一系列因素有关,如干旱程度和持续时间等[6]。施氮是生产实践中常见的栽培措施。增施氮肥不但能有效提高作物产量[7-8],也可以增强作物的抗旱性[9]。干旱胁迫下,合理增施氮肥能够促进根系的生长,提高对各层土壤水分的吸收利用[10-11]。但是,不同施氮水平对紫花苜蓿复水后生长恢复能力的作用尚未阐明。
碳代谢是决定植物复水后生长恢复能力的重要因素。Guo 等[12]研究表明,干旱下,为了获取更多的土壤水分和养分,植物会促进根系的生长并增加根中糖类的积累;复水后,由于“干旱记忆”,植物依旧将光合产物和营养优先向根部分配,提高了根冠比(root shoot ratio,R/S)以及根中糖类和养分的储备,从而加快了植物的生长速度,发生“补偿性生长”。蔗糖作为光合产物运输的主要形态,叶片中蔗糖的合成和根中蔗糖的分解决定着干物质以及糖类的分配[12]。叶片中,蔗糖可由己糖通过蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)生成,或由果糖和葡萄糖通过蔗糖合成酶(sucrose synthetase,SS)转化生成。蔗糖运输到根系后,可在酸性转化酶(acid invertase,AI)的作用下水解,被植物所利用[13-14]。
基于此,本试验在不同氮水平上通过添加聚乙二醇-6000 (PEG)模拟干旱-复水,测定紫花苜蓿R/S、地上和地下部可溶性糖和淀粉含量,以及参与蔗糖代谢主要酶的活性,研究施氮对紫花苜蓿复水后糖代谢的影响,揭示施氮对紫花苜蓿复水后生长恢复能力的作用机理,为干旱背景下紫花苜蓿栽培管理措施的优化提供理论依据。
1 材料与方法
1.1 植物培养与试验设计
供试材料为紫花苜蓿‘WL168HQ’ (北京正道)。挑选籽粒饱满且大小均一的种子,在75%乙醇浸种消毒8 min 后,用蒸馏水冲洗4~5 次,置于铺有两层灭菌滤纸的培养皿中。待紫花苜蓿长出真叶后,采用水培法培养。每个水培盒(长12 cm,宽8 cm,高11 cm)中培养6 株植物。植物于培养箱中控制条件下培养,温度(昼/夜)为25 ℃/20 ℃,光周期(昼/夜)为16 h/8 h,光照强度为20 000 lx,相对湿度为35%~40%。
研究设置两个水分处理(未受干旱、干旱)、两个氮素水平(低氮:3 mmol·L-1;高氮:7 mmol·L-1)以及3 个复水时间(干旱结束时、复水初期和复水后期)处理。植物长出3~4 片真叶时置于不同氮素水平下进行培养。待植物长至10 cm 高时进行水分处理。研究通过培养液中加入10% PEG (渗透压-0.14 MPa)模拟为期7 d 的干旱,然后替换为不含PEG 的营养液,模拟复水。在替换营养液时,为防止根上PEG 的残留,用不含PEG 的营养液冲洗根系数次。在干旱结束时(0 d)、复水初期(复水7 d)以及复水后期(复水24 d)进行采样。干旱下,植物的叶片会有所损伤,而不同氮水平下植物的抗旱性不同,叶片的损伤程度也有所不同。为了减少光合能力损伤对复水后生长恢复的影响,在复水7 d 的采样后,对余下的紫花苜蓿刈割至3 cm。采样后,3 株样品置于烘箱内烘干,用于干重以及糖分等指标的测定;另外3 株采样后立即放入液氮中,随后保存于-80℃,用于酶活性的测定。
1.2 测定指标与方法
采用常规烘干法,将样品于105 ℃杀青30 min,于65 ℃烘干至恒重,用万分之一天平测定其地上和地下部干重,计算总生物量和根冠比。叶片含水量 = (鲜重 - 干重)/鲜重 × 100%。使用蒽酮比色法[15]测定可溶性糖和淀粉。植物经H2SO4-H2O2消煮后,利用流动分析仪测定植物地上部分总氮。SS、SPS 和AI 活性采用索莱宝试剂盒进行检测。
1.3 数据处理
利用SPSS 25.0 统计分析数据,采用三因素方差分析(three-way ANOVAs)检验施氮水平、干旱处理和复水时间对植物生物量、相对含水量、含氮量、含糖量以及酶活性的作用及交互作用。使用Duncan法对不同复水时间数据进行多重比较分析(P< 0.05),试验数据均用平均值 ± 标准误表示。采用Origin 2021 制图。
2 结果与分析
2.1 生物量
干旱、氮素水平和复水时间显著影响植物的总干重,并存在交互作用(表1)。干旱胁迫下,低氮处理的地上与地下部的生长均有所抑制;高氮处理的总生物量没有明显变化,而地下部生物量有所提高。复水7 d 时,低氮处理的地上和地下部生物量分别低于对照组37.0%和31.0%。尽管高氮处理的地上部生物量也显著低于其对照组(P< 0.05),但地下部生物量与对照组没有显著差异。复水24 d 时,低氮处理的生长仍未恢复,但是高氮处理已恢复至正常生长水平,总生物量高于对照组11.1%,其中,地下生物量高出对照组39.0% (图1)。
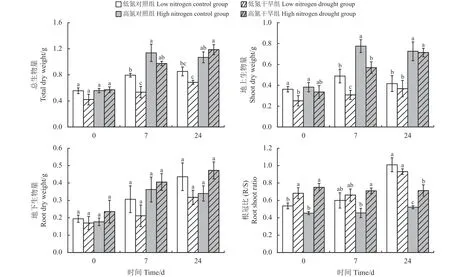
图1 不同氮处理下紫花苜蓿在干旱-复水中的生物量和根冠比Figure 1 Variation of dry weight and root shoot ratio in alfalfa with different nitrogen treatments under drought and subsequent rewatering
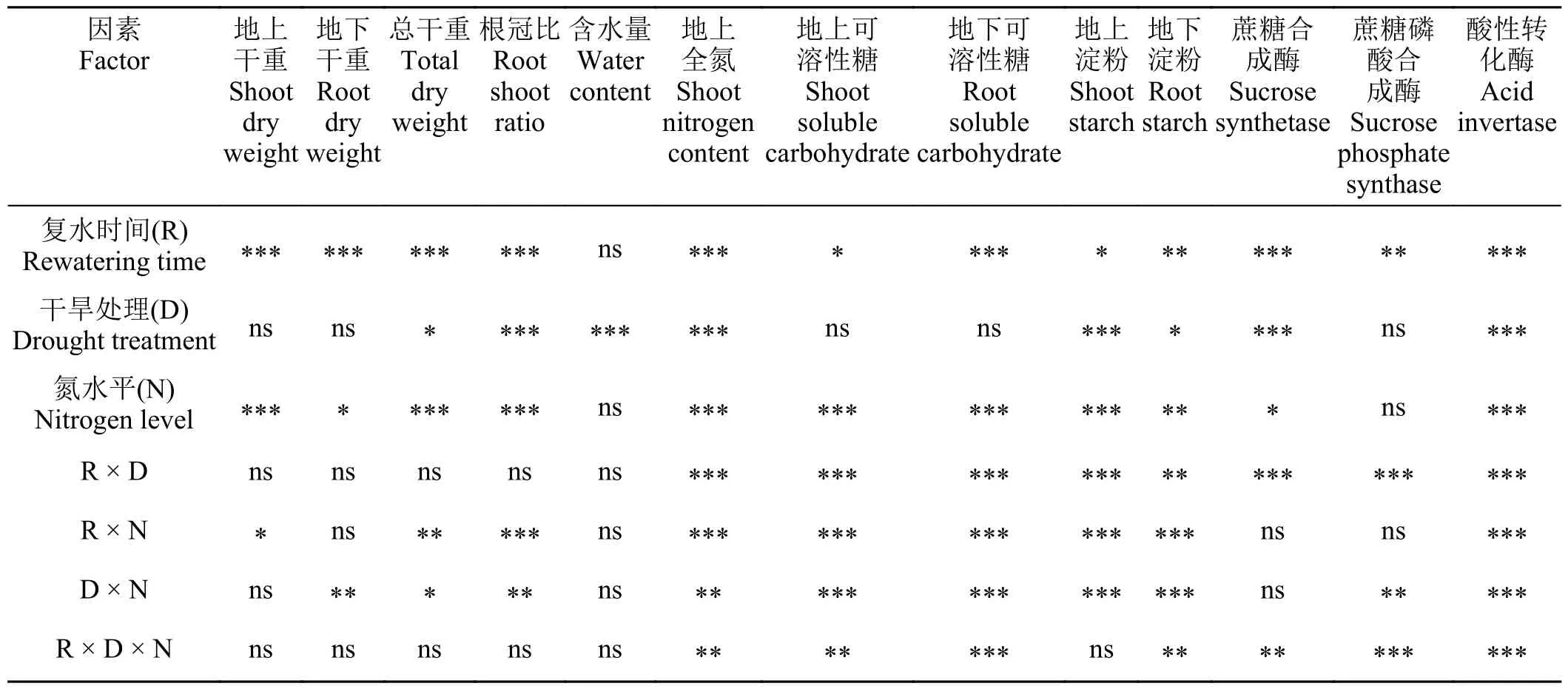
表1 干旱处理、复水时间和氮素水平对紫花苜蓿各指标影响的方差分析Table 1 Three-way ANOVA analysis of the parameters between water treatment, rewatering time, and N levels
干旱胁迫显著改变了植物的R/S,但对不同氮水平下植物的作用有所不同(表1)。干旱下,低氮和高氮处理的R/S 较其对照均显著提高(P< 0.05),其中低氮处理的R/S 提高了27.2%,高氮处理的R/S 提高了65.7%。复水7 d 时,低氮和高氮处理的R/S 依旧高于对照组。但在复水24 d 时,低氮处理的R/S 低于其对照组7.8%,高氮处理的R/S 依旧显著高于其对照组(P< 0.05) (图1)。
2.2 叶片含水量和地上部氮含量
干旱结束时,低氮处理的叶片含水量与对照组无显著差异(P> 0.05),而高氮处理的含水量显著低于对照组(P< 0.05)。复水后7 d 以及24 d,两个氮水平下植物的含水量与对照组均无显著差异(图2)。
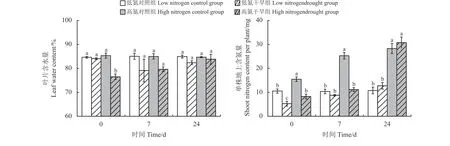
图2 不同氮处理下紫花苜蓿在干旱-复水中的叶片含水量和地上氮含量Figure 2 Variation of leaf water content and shoot nitrogen content in alfalfa with different nitrogen treatments under drought and subsequent rewatering
干旱显著影响植物的地上含氮量,并与复水时间以及氮素水平存在显著的交互作用(表1)。干旱下,低氮和高氮处理的地上含氮量均较其对照显著降低(P< 0.05)。复水7 d 时,低氮处理的地上含氮量与其对照组无显著差异,而高氮处理显著低于其对照组(P< 0.05)。复水24 d 时,两个氮素水平下植物的地上含氮量均有所提高,分别提高18.3%和8.6% (P> 0.05) (图2)。
2.3 可溶性糖和淀粉含量
干旱与氮素水平对植物地上和地下的可溶性糖含量具有显著的交互作用(表1)。从干旱结束到复水24 d,低氮处理的地上可溶性糖含量均高于其对照组,而高氮处理的地上可溶性糖含量从未显著高于其对照组(图3)。地下部可溶性糖含量则有着相反的变化趋势,低氮处理的地下可溶性糖含量从未显著高于其对照组,而高氮处理的地下可溶性糖含量在干旱结束以及复水24 d 时显著高于其对照组(P< 0.05)。
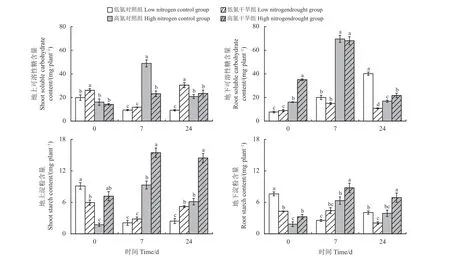
图3 不同氮处理下紫花苜蓿在干旱-复水中的可溶性糖和淀粉含量Figure 3 Variation of soluble carbohydrate and starch content of shoot and root in alfalfa with different nitrogen treatments under drought and subsequent rewatering
干旱和氮素水平显著影响紫花苜蓿的淀粉含量,并存在交互作用(表1)。在干旱-复水过程中,除干旱时期,低氮和高氮处理的地上淀粉含量一直高于其对照组(图3)。与地上部变化趋势不同,低氮处理的地下淀粉含量从未显著升高,而高氮处理的地下淀粉含量始终显著高于其对照组(P< 0.05)。
2.4 蔗糖代谢相关酶活性
干旱、复水时间以及氮素处理均对叶片SS 活性有显著影响(表1)。干旱对两个氮素水平下的SS活性均无显著影响(图4)。复水7 d,两个氮素水平下植物的SS 酶活性均显著高于其对照组。复水24 d时,低氮处理的SS 活性与其对照组无显著差异,而高氮处理的SS 活性依旧显著高于其对照组(P<0.05)。
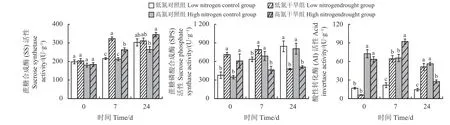
图4 不同氮处理下紫花苜蓿在干旱-复水中的叶片蔗糖合成酶,磷酸蔗糖合成酶和根部酸性转化酶活性Figure 4 Variation of activity of leaf sucrose synthetase, sucrose phosphate synthase,and root acid invertase in alfalfa with different nitrogen treatments under drought and subsequent rewatering
植物的SPS 活性受到干旱、氮素水平以及复水时间及其交互作用的影响(表1)。干旱下,两个氮素水平植物的SPS 活性均显著升高(图4)。复水7 d,低氮处理的SPS 活性依旧高于其对照组,但高氮处理的SPS 活性则显著低于其对照组(P< 0.05)。复水24 d,两个氮素水平植物的SPS 酶活性均显著低于其对照组(P< 0.05)。
干旱、氮素水平、复水时间对植物AI 活性均有显著影响,并存在交互作用(表1)。干旱对两个氮素下植物的AI 活性均无显著影响(图4)。复水7 d 时,两个氮素水平下植物的AI 活性均显著上升(P< 0.05)。复水24 d 时,低氮处理依旧保持着较高的AI 酶活性,而高氮处理的AI 活性显著下降(P<0.05)。
3 讨论
3.1 施氮对紫花苜蓿复水后生长恢复能力的影响
干旱使植物气孔关闭,因此两个氮水平下植物的生长均受到抑制。复水7 d 时,由于叶片光化学和叶肉导度在干旱时受到了损伤[16],两个氮水平下紫花苜蓿的生长依旧均低于正常水平(图1)。复水24 d 时,低氮水平下紫花苜蓿的干重仍然低于其对照组,而高氮水平下紫花苜蓿的干重则超过其对照组,说明施氮有利于植物复水后的生长恢复。植物复水后的生长恢复情况与两方面有关,一是植物的抗旱性,与低氮处理相比,高氮处理具有更强的抗旱性,在干旱中受到的影响较小,因而更易从干旱中恢复;二是植物复水后的生理功能,复水后,高氮处理植物的分蘖再生能力显著增大[17-18],水分利用效率提高[8],内源保护酶活性增强[19],因而生长速度加快[20],使植物快速恢复至正常生长水平。
3.2 施氮对紫花苜蓿干旱复水后根冠比、非结构性碳水化合物、含氮量的影响
R/S 决定着植物对水分的吸收能力。干旱下,与低氮处理相比,高氮处理的植物更为明显地提高了R/S,这与Wang 等[21]研究结果一致。源汇关系假说认为,植物器官通过相互竞争获得光合产物。与低氮处理相比,干旱下高氮处理的植物叶片受到的损伤较小,可将更多比例的碳用于根系的生长。由于“干旱记忆”,复水后高氮处理的根冠比的升高程度依旧大于低氮处理。
复水后7 以及24 d,低氮处理主要提高了地上部的淀粉和可溶性糖含量,而高氮处理主要提高了地下部的淀粉和可溶性糖含量。植物在干旱时也有相似的变化,说明复水后糖类的分配规律也是“干旱记忆”导致的。干旱下,高氮处理趋于将非结构性碳水化合物储存于根系中[22],而低氮处理主要将糖用于维持叶片的光合功能。
复水后,低氮处理的地下生物量降低,而高氮处理下增加,表明高氮处理提高了氮素吸收能力。然而,与低氮处理一样,高氮处理并未显著提高其地上部的氮素含量,说明高氮处理可能将氮素主要储存在地下根系中。这种现象可能也与干旱时的响应有关。低氮处理植物的抗旱能力较低,干旱时可能将更多的氮素用来提高叶片的光合吸收,而高氮处理则可将更多的氮储存于根系中。由于本研究并未测定植物地下部的含氮量,施氮对植物复水后氮分配的作用机理需要进一步验证。
3.3 施氮对紫花苜蓿复水后酶活性的影响
干旱时,两个氮水平下植物的SS 活性没有显著变化。复水7、24 d,两个氮水平下的SS 活性均高于对照组,说明干旱时与复水后参与蔗糖代谢的主要酶是有所不同,而SS 酶是植物复水后参与蔗糖合成的主要酶。但是,复水7 d 时,与低氮处理相比,高氮处理的SS 活性升高程度较小。这可能是因为蔗糖的合成与分解是由一系列酶共同决定的,不同处理下植物碳分配的差异不是由单一酶所决定[23-24]。复水24 d 时,低氮处理的SS 活性与其对照组无显著差异,而高氮处理的SS 活性依旧高于其对照组,说明SS 是高氮处理复水后蔗糖合成的主要酶。
干旱条件下,两个氮水平下植物叶片的SPS 活性均显著升高,说明干旱下SPS 是参与蔗糖合成的主要酶。Xu 等[5]的研究也表明,干旱显著升高了水稻(Oryza sativa)叶片SPS 活性。但是复水7 d,低氮处理的SPS 活性显著高于其对照组。复水24 d,两个氮水平下植物的SPS 活性均显著低于其对照组,说明SPS 不是决定植物复水后光合产物分配的主要酶,这与Guo 等[12]的研究一致。
干旱下,两个氮水平下植物根系的AI 活性均有所下降,复水后根系AI 活性则显著提高,说明AI酶是复水后调节蔗糖分解的关键酶。但是,由于酶的活性也会随着时间而发生变化[25]。在复水过程中,高氮处理AI 活性的增高程度始终低于低氮处理,说明施氮并未通过提高AI 活性而促使根系生长及其碳水化合物的积累。
4 结论
施氮有利于紫花苜蓿复水后根部干物质、淀粉、可溶性糖以及氮素的积累,从而增强紫花苜蓿复水后的生长恢复能力。在AI、SPS 和SS 酶中,施氮主要通过提高SS 酶活性,促进复水后紫花苜蓿碳水化合物在根系中的积累。
