骨炎消方通过PI3K/Akt/mTOR信号通路对骨关节炎细胞自噬的影响*
2024-04-24高小凤王宝娟才贺郑曙光
高小凤,王宝娟,才贺,郑曙光
(1.贵州中医药大学 基础医学院,贵州 贵阳 550025;2.贵州中医药大学第一附属医院骨伤科,贵州 贵阳 550002)
骨关节炎(Osteoarthritis, OA)是年龄、肥胖、炎症、创伤、遗传等多种原因导致的关节变性疾病[1],其主要表现包括骨关节软骨破坏、软骨下骨硬化或囊性变、关节边缘骨质增生、滑膜病变、关节囊挛缩、韧带松弛或挛缩及肌肉萎软乏力[2]。OA发病以中老年为主,女性多于男性,且伤残发生率较高。目前治疗药物以非甾体抗炎药居多[3],病程后期治疗主要采用外科手术,如关节置换等[4]。软骨细胞是软骨中唯一的驻留细胞,可以维持软骨的周转平衡,OA发生时软骨细胞大量损失[5]。近几年来,关于雷帕霉素靶基因表达途径(PI3K/Akt/mTOR)与OA之间的关系已成为一个热门课题。PI3K/Akt/mTOR信号通路由酶联受体介导,能被生长因子、细胞因子、细胞外基质等多种因子活化[6-7]。目前OA的发病机制尚未完全清楚,因此,探讨其与PI3K/Akt/mTOR的信号转导途径的关系及延缓其发生、发展具有十分重要的意义。骨炎消方是苗族的传统方剂,其在黔南和黔东南一带OA的治疗当中发挥重要作用,其疗效可靠,作用全面,无明显不良影响[8]。本研究以骨炎消方为主要治疗手段,通过实验观察其对PI3K/Akt/mTOR信号通路的影响,探讨骨炎消方对OA的预防及治疗作用。
1 材料与方法
1.1 实验细胞
兔软骨细胞(CP-Rb038)购自武汉普诺赛生命科技有限公司。
1.2 药物及制备
骨炎消方由12味药物组成,其中大血藤、黑骨藤、狗脊、鸡血藤、杜仲、淫羊藿、伸筋草、透骨香、骨碎补均采购自贵阳同仁堂药房(生产批号:210501),蜘蛛香、飞龙掌血、小血藤均购自万东桥下药材市场,经贵州中医药大学药学院王波讲师鉴定均为正品。上述12味药物各取10 g,常规水煎制,用旋转蒸发仪对水煎液减压浓缩,再用冷冻干燥机冻干,最后获得10 g棕褐色冻干粉,采用无菌PBS完全溶解骨炎消冻干粉,用100 μm筛网过滤杂质,最后使用0.22 μm滤网过滤除菌,药物浓度为100 mg/mL,置入-80 ℃冰箱冷冻保存备用。
1.3 实验仪器与试剂
旋转蒸发仪(上海科兴仪器有限公司),冷冻干燥机(上海舜制仪器制造有限公司),酶标仪(上海赛默飞世尔科技公司),PCR仪(北京东胜创新生物科技有限公司),化学发光成像系统(上海赛默飞世尔科技公司),倒置显微镜(上海徕卡显微系统有限公司),离心机、超净台、细胞培养箱(上海赛默飞世尔科技公司),胎牛血清(南京维森特生物技术有限公司),DMEM培养基(上海赛默飞世尔科技公司),胰酶(南京维森特生物技术有限公司),青霉素-链霉素双抗、D-氨基酸葡萄糖(北京索莱宝科技有限公司),脂多糖(Lipopolysaccharide, LPS)(北京索莱宝科技有限公司),CCK-8试剂盒(美国MedChemexpress生物科技公司),自噬蛋白5(autophagy protein 5, ATG5)和自噬蛋白12(autophagy protein 12, ATG12)酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)试剂盒(上海源桔生物科技有限公司)。
1.4 实验方法
1.4.1 软骨细胞炎症模型构建 选取第3代对数生长期的软骨细胞,待其细胞融合度达80%时加入LPS 10.0 μg/mL,处理24 h。用无菌刮刀收集细胞悬液,离心后用PBS清洗2次,再次离心10 min,加入0.3 mL生理盐水进行匀浆,冰浴条件下超声破碎,用NO试剂盒测定制备好的匀浆液,确定软骨细胞模型是否复制成功。
1.4.2 CCK-8法检测细胞增殖率 3代软骨细胞接种于含完全培养基的96孔板中,细胞密度为5×105个/mL,每孔100 μL,待细胞贴壁后,吸弃培养液,PBS清洗2遍,更换含有LPS(10.0 μg/mL)的DMEM培养基将骨炎消药物分别稀释至所需浓度(1.0 ng/mL、0.1 μg/mL、1.0 μg/mL、10.0 μg/mL、100.0 μg/mL、1.0 mg/mL和10.0 mg/mL),细胞培养箱中孵育24 h后,每孔加入100 μL CCK-8试剂,37 ℃避光孵育4 h,用酶标仪测定各孔溶液在波长450 nm处的光密度(optical density, OD)值,根据OD值计算细胞加药后的增殖率,进而选取合适浓度的骨炎消进行后续实验。
1.4.3 ELISA检测细胞上清液中自噬因子水平 将软骨细胞随机接种于6孔板中,用配置好的完全培养基进行稀释,最终将细胞密度调整为1×105个/mL,每孔加入2 mL培养液,待细胞融合至80%后,分6组进行培养:空白组(兔软骨细胞+完全培养基),模型组(兔软骨细胞+含10 μg/mL LPS培养基),阳性组(兔软骨细胞+ LPS+含150 μmol/L的D-氨基葡萄糖培养基),其余3组分别加入含骨炎消1.0、10.0和100.0 μg/mL的培养基处理1 h,为避免细胞过多死亡造成实验误差,再加入10.0 μg/mL的LPS处理24 h。细胞培养24 h后,收集细胞上清液,按照ELISA试剂盒说明书步骤进行后续操作。
1.4.4 实时荧光定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR)检测细胞PI3K、Akt、mTOR基因相对表达量 用TRIzol法提取RNA,用微量分光光度计测定OD260、OD280及OD260/OD280值,计算RNA的纯度和浓度,总RNA浓度(μg/μL)=OD260×40×10-3。将RNA逆转录成cDNA,以cDNA为模板进行qRT-PCR检测。qRT-PCR反应条件:95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火延伸60 s,95℃再升温15 s;共40个循环。采用2-ΔΔCt法计算各目的基因相对表达量。引物序列见表1。
1.4.5 Western blotting检测PI3K、Akt、mTOR、Beclin-1蛋白相对表达量 用RIPA裂解液提取细胞蛋白,BCA法测定各蛋白的浓度,添加蛋白上样缓冲液后加热变性。SDS-PAGE电泳,根据蛋白大小调整转膜时间,5%的脱脂奶粉室温条件下封闭2 h。一抗孵育4 ℃过夜(GAPDH、PI3K、Akt、mTOR、Beclin-1均为1∶1 000)。二抗常温孵育2 h(1∶10 000),ECL发光液显影,用Image J软件处理分析。
1.5 统计学方法
数据分析采用SPSS 26.0和Graphpad Prism 9.0统计软件。计量资料以均数±标准差(±s)表示,多组比较用方差分析,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 软骨细胞炎症模型的构建
正常软骨细胞呈椭圆形或短梭形,胞质丰富,胞核清晰,单层生长的细胞均匀地贴在细胞瓶壁。用LPS诱导一段时间后的软骨细胞形状不规则且细长,有伪足样触手伸出,相较于正常软骨细胞,LPS诱导后的软骨细胞有部分漂浮且贴壁细胞的数量减少,分布疏散。空白组NO含量为(37.35±2.47)μmol/L,模型组NO含量为(146.00±2.17)μmol/L,两组比较,经t检验,差异有统计学意义(t=65.609,P=0.000)。见图1。

图1 软骨细胞形态 (倒置显微镜×100)
2.2 不同浓度骨炎消对软骨细胞存活率的影响
CCK-8法检测结果显示,各组软骨细胞存活率比较,经方差分析,差异有统计学意义(F=168.930,P=0.000)。骨炎消1.0 ng/mL组和骨炎消10.0 mg/mL组的细胞存活率与模型组比较,差异均无统计学意义(P>0.05);剩余骨炎消不同浓度组的细胞存活率与模型组比较,差异均有统计学意义(P<0.05),其中骨炎消1.0 μg/mL组、骨炎消10.0 μg/mL组、骨炎消100.0 μg/mL组细胞增殖率升高最为明显,因此选取这3组作为后续实验当中的骨炎消高、中、低剂量组。见表2。
表2 不同浓度骨炎消对软骨细胞存活率的影响 (±s)
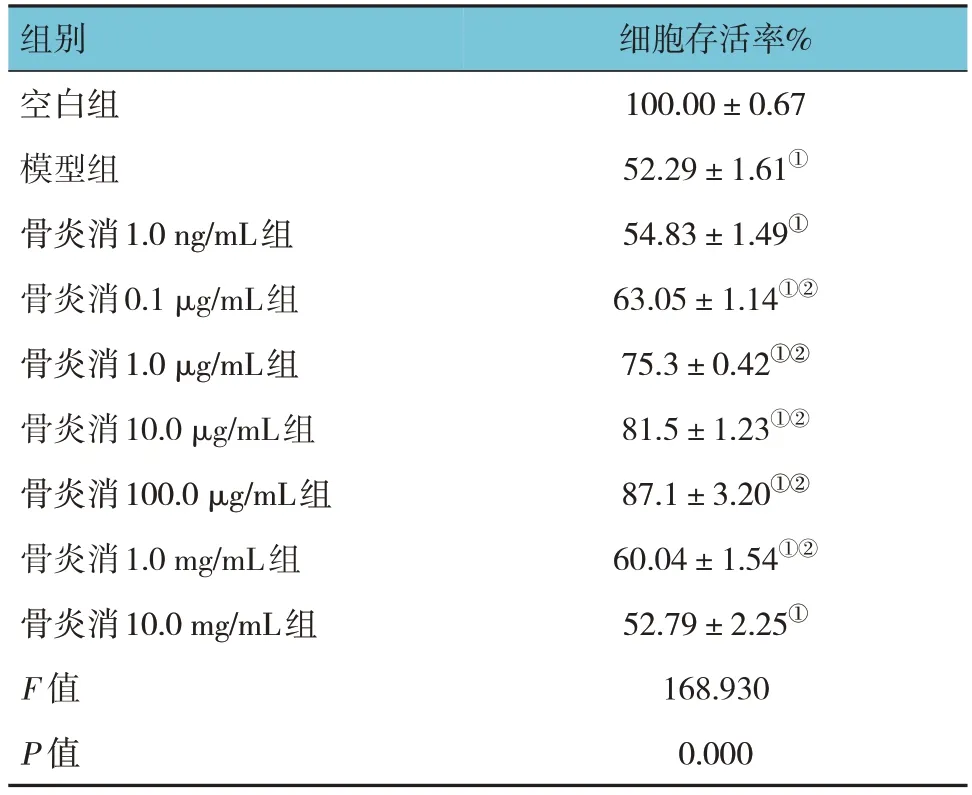
表2 不同浓度骨炎消对软骨细胞存活率的影响 (±s)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
组别空白组模型组骨炎消1.0 ng/mL组骨炎消0.1 μg/mL组骨炎消1.0 μg/mL组骨炎消10.0 μg/mL组骨炎消100.0 μg/mL组骨炎消1.0 mg/mL组骨炎消10.0 mg/mL组F 值P 值细胞存活率%100.00±0.67 52.29±1.61①54.83±1.49①63.05±1.14①②75.3±0.42①②81.5±1.23①②87.1±3.20①②60.04±1.54①②52.79±2.25①168.930 0.000
2.3 各组细胞上清液中自噬因子水平
各组细胞上清液中自噬因子ATG5和ATG12水平比较,经方差分析,差异均有统计学意义(P<0.05)。与空白组比较,模型组、阳性组及骨炎消高、中、低组的ATG5和ATG12水平均降低(P<0.05);与模型组比较,阳性组和骨炎消高、中、低组的ATG5和ATG12水平均升高(P<0.05),但模型组的ATG12水平与骨炎消低剂量组比较,差异无统计学意义(P>0.05)。见表3。
表3 各组细胞中自噬因子水平比较 (ng/mL,±s)
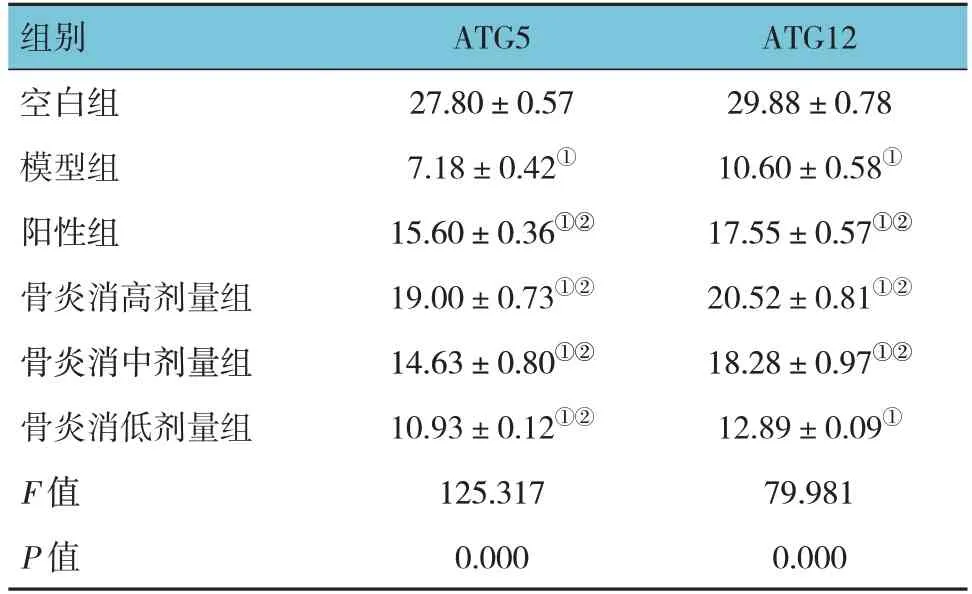
表3 各组细胞中自噬因子水平比较 (ng/mL,±s)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
组别空白组模型组阳性组骨炎消高剂量组骨炎消中剂量组骨炎消低剂量组F 值P 值ATG12 29.88±0.78 10.60±0.58①17.55±0.57①②20.52±0.81①②18.28±0.97①②12.89±0.09①79.981 0.000 ATG5 27.80±0.57 7.18±0.42①15.60±0.36①②19.00±0.73①②14.63±0.80①②10.93±0.12①②125.317 0.000
2.4 骨炎消对软骨细胞中PI3K、Akt、mTOR基因相对表达量的比较
6组软骨细胞中PI3K、Akt、mTOR基因相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与空白组相比,模型组PI3K、AKT、mTOR相对表达量均升高(P<0.05);与模型组相比,骨炎消高、中、低组PI3K、Akt、mTOR相对表达量均降低(P<0.05),且骨炎消各剂量组中的基因相对表达量随浓度降低而上升。见表4。
表4 各组PI3K、Akt、mTOR mRNA相对表达量比较(±s)

表4 各组PI3K、Akt、mTOR mRNA相对表达量比较(±s)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
组别空白组模型组阳性组骨炎消高剂量组骨炎消中剂量组骨炎消低剂量组F 值P 值mTOR mRNA 1.01±0.08 3.72±0.08①2.17±0.04②1.58±0.03②1.77±0.06②1.91±0.03②8.411 0.001 PI3K mRNA 1.00±0.04 2.44±0.05①1.71±0.08①1.31±0.05②1.51±0.09②1.57±0.06②9.224 0.001 Akt mRNA 1.00±0.03 2.03±0.09①1.53±0.09①1.24±0.07②1.44±0.07②1.48±0.06②8.911 0.001
2.5 骨炎消对软骨细胞中PI3K、Akt、mTOR、Beclin-1蛋白相对表达量比较
各组软骨细胞中PI3K、Akt、mTOR、Beclin-1蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05)。与空白组比较,模型组PI3K、Akt、mTOR蛋白相对表达量均升高(P<0.05);与模型组比较,阳性组和骨炎消高、中剂量组的PI3K、Akt、mTOR蛋白相对表达量均降低(P<0.05),而骨炎消低剂量组的PI3K、Akt、mTOR蛋白相对表达量与模型组比较,差异均无统计学意义(P>0.05)。与空白组比较,模型组Beclin-1的蛋白相对表达量降低(P<0.05),与模型组比较,阳性组和骨炎消高、中、低组Beclin-1蛋白相对表达量升高(P<0.05)。见图2和表5。

图2 各组细胞蛋白条带图
表5 各组软骨组织PI3K、Akt、mTOR、Beclin-1蛋白相对表达量比较 (±s)
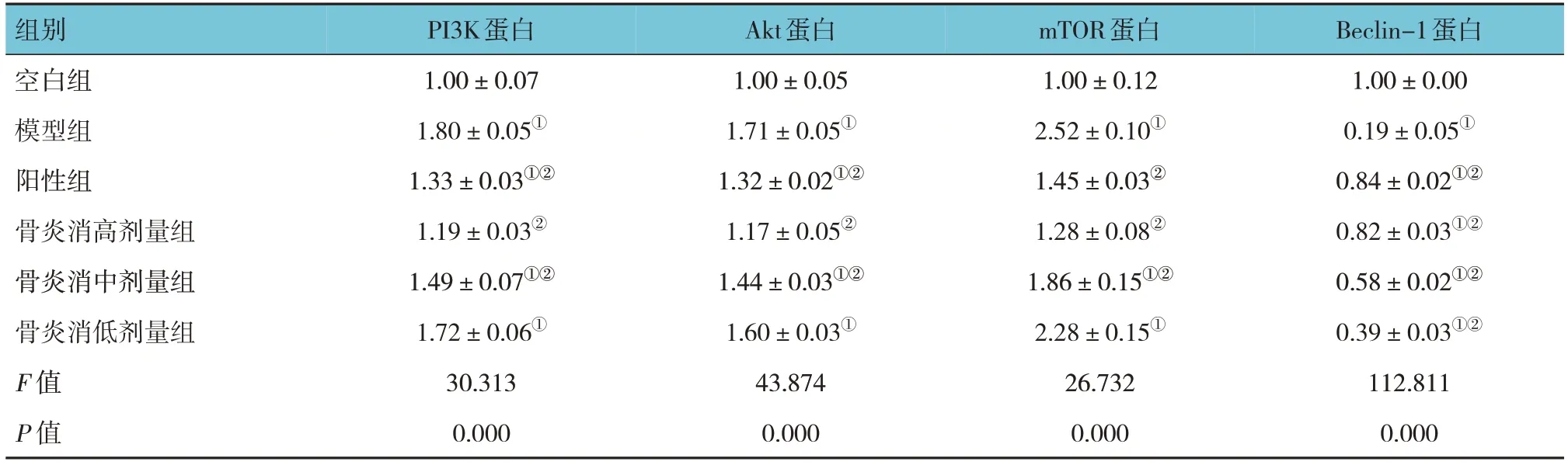
表5 各组软骨组织PI3K、Akt、mTOR、Beclin-1蛋白相对表达量比较 (±s)
注:①与空白组比较,P<0.05;②与模型组比较,P<0.05。
组别空白组模型组阳性组骨炎消高剂量组骨炎消中剂量组骨炎消低剂量组F 值P 值Beclin-1蛋白1.00±0.00 0.19±0.05①0.84±0.02①②0.82±0.03①②0.58±0.02①②0.39±0.03①②112.811 0.000 PI3K蛋白1.00±0.07 1.80±0.05①1.33±0.03①②1.19±0.03②1.49±0.07①②1.72±0.06①30.313 0.000 Akt蛋白1.00±0.05 1.71±0.05①1.32±0.02①②1.17±0.05②1.44±0.03①②1.60±0.03①43.874 0.000 mTOR蛋白1.00±0.12 2.52±0.10①1.45±0.03②1.28±0.08②1.86±0.15①②2.28±0.15①26.732 0.000
3 讨论
骨关节炎是一种慢性退行性疾病,常见于中老年人群,其与年龄、肥胖、遗传等因素密切相关,且其自身的修复能力有限[9]。《2015年中国骨关节炎防治认知白皮书》指出,全世界有3.6亿骨关节炎患者,我国约1.2亿人正在经受着骨关节炎的折磨,>60岁的老年人中有一半以上患有此病,其发病率远超心脑血管疾病,致残率高,严重影响患者的生活自理能力和劳动能力[10]。针对OA的治疗,大部分患者采用口服钙类和氨基酸葡萄糖类产品,而骨关节炎的核心病理过程是关节软骨的破坏,所以仅通过补钙是不能达到治疗目的的,而氨基酸葡萄糖类产品具有软骨保护和结构改善性作用,故广泛用于OA的预防与治疗[9,11]。本实验采用D-氨基酸葡萄糖作为阳性药物对照组,药物浓度的设定是课题组前期依据DODGE博士[12]的实验研究引用而来。
骨炎消方原是黔南、黔东南等地苗族人民用于治疗OA的经典验方,上述12味药物合用,具有通气活血、疏经活络、祛风除湿,表出毒邪之功。在苗医理论中,将骨关节炎称为“冷骨风”,有“壅塞为病,通达为康”“身不通则痛”的说法。治疗原则是依据“热病冷治,冷病热治;弱漏用补,邪重用攻”[13],这与中医学的治疗原则的理论是相通的。苗医依其治疗原则创造了“熏蒸法”“弩针药法”“纸火疗法”等外治法来治疗此类疾病[14-15]。前期研究发现,骨炎消有改善小鼠耳发热、红肿等炎性症状,提示骨炎消具有消炎镇痛、改善关节功能的作用[16];同时发现,苗族熏蒸疗法对于骨关节炎的治疗效果较为突出。王兴桂等[17]采用骨炎消熏蒸疗法对家兔早期OA进行局部干预,结果发现骨炎消主要是通过上调Bcl-2表达和下调Bax表达从而保护软骨细胞免受凋亡。前期研究证实骨炎消方对OA的病理状态有明显的改善作用,并且发现骨炎消方在调控凋亡方面也对软骨细胞具有保护作用,在此基础上,本文将进一步探究骨炎消方通过PI3K/Akt/mTOR信号通路影响细胞自噬用于治疗OA的作用机制。
PI3K/Akt/mTOR通路作为细胞内重要的信号转导通路之一,具有影响细胞的生长、存活、增殖、凋亡、自噬、血管生成及蛋白合成等作用,并在此过程中发挥着重要的生物学调控功能[18]。PI3K/Akt/mTOR信号通路典型的活化途径是由受体酪氨酸激酶或G蛋白结合受体启动的,活化的PI3K将磷脂酰肌醇-4,5-二磷酸转化为磷脂酰肌醇-3,4,5-三磷酸,并进一步激活下游底物如Akt[19]。活化后的Akt激活各种下游底物,如mTOR等。而mTOR作为自噬相关的调节因子,与自噬的启动呈负相关[20],因此,通过干预该信号通路可以影响细胞自噬。
自噬(Ⅱ型程序性细胞死亡)是一种特殊的生命现象,在一定的环境下,细胞内的溶酶体可以分解损伤的细胞器和大分子,从而达到生物合成或产生能量的目的,具有保护组织细胞、提供能量的作用[21]。自噬还是一种复杂的代谢途径,受多种信号通路影响,有研究证实,mTOR是自噬最为核心的调节因子[22]。卓清缘等[23]应用桦木酸调控人结肠癌细胞SW620发现,细胞自噬蛋白LC3-Ⅱ、Beclin-1表达明显升高,验证其作用机制可能与抑制PI3K/Akt/mTOR信号通路有关。另有实验证明,采用PI3K/Akt/mTOR信号通路蛋白抑制剂诱导大鼠软骨细胞,细胞自噬率增加,Atg5和Atg7的基因表达及LC3、Beclin1和p62的蛋白表达显著上调,提示抑制PI3K/Akt/mTOR信号通路可促进关节软骨细胞的自噬,减轻骨性关节炎大鼠的炎症反应[24]。由此可见,当上游的PI3K/Akt被抑制后,下游的mTOR同样也会被抑制,这时的自噬表达会上升。
ATG5、ATG12与Beclin1是重要的自噬因子。王秀阁等[25]应用解毒通络保肾方作为治疗药物,作用于SD大鼠及体外实验高糖诱导的大鼠肾小球系膜细胞(HBZY-1),结果显示解毒通络保肾方干预后,肾组织中Beclin-1、ATG5蛋白表达上升,与模型组相比,解毒通络保肾方抑制高糖诱导的HBZY-1细胞增殖,细胞中ATG5蛋白表达上升。而本研究结果也证明,当PI3K相对表达量升高,下游的Akt、mTOR相对表达量也随之升高,骨炎消治疗后PI3K、Akt、mTOR相对表达量均随着浓度升高而降低。与模型组比较,骨炎消各剂量组的ATG5、ATG12表达量增加,且骨炎消高、中剂量组的Beclin-1蛋白条带灰度显影与模型组相比均有不同程度加深。
综上所述,骨炎消方有防治OA的作用,其作用机制可能为抑制PI3K/Akt/mTOR信号通路,引起自噬相关因子在一定程度上调,促进细胞增殖分化。本研究初步探讨PI3K/Akt/mTOR信号轴在骨炎消治疗OA中的作用,为OA的治疗提供新的思路和靶点,但仅限于细胞实验,后续仍需进一步采用动物实验来验证此结论。
