红花-牛膝治疗口腔黏膜下纤维化作用机制的网络药理学分析
2024-04-23唐智群鲍喆煊聂敏
唐智群,鲍喆煊,聂敏
(1.广州医科大学附属口腔医院口腔黏膜病科,广东省口腔组织修复与重建工程技术研究中心,广州市口腔再生医学基础与应用研究重点实验室,广东 广州510182;2.广州医科大学附属口腔医院牙周病科,广东省口腔组织修复与重建工程技术研究中心,广州市口腔再生医学基础与应用研究重点实验室,广东 广州510182)
口腔黏膜下纤维化(OSF)又称口腔黏膜下纤维性变,是一种常见的慢性进行性口腔黏膜疾病,临床上常表现为进食刺激性食物疼痛、进行性张口受限、吞咽困难[1],典型的病理变化为黏膜固有层及黏膜下层胶原纤维堆积、变性,因其具有癌变倾向,在1987年被世界卫生组织列为癌前状态[2]。OSF病因复杂,发病机制尚不明确,目前认为,咀嚼槟榔是OSF的高危因素。在我国湖南、海南、台湾等有咀嚼槟榔习惯的地区,OSF的发病率可达0.9%~17.6%[3-4],癌变率可达1.2%~4.32%[3,5]。随着槟榔产业的扩大及咀嚼槟榔习惯的流行,OSF及癌变的患者数量在逐年增加且有全国蔓延的趋势,已逐渐成为严重危害公共健康的社会问题。目前OSF的治疗主要使用糖皮质激素类药物,但是长期使用此类药物会出现全身不良反应。中医学历史悠久,且中医药具有患者依从性好、副作用少、作用靶点多的特点,近年来各种具有活血化瘀功效的中药已逐渐被应用于OSF的临床治疗中[6]。
红花-牛膝有活血散瘀、通经止痛的功效,药理研究发现两者具有调节免疫系统、抗炎、抗氧化、扩张血管改善微循环障碍等作用。含有红花-牛膝的活血化瘀方剂已被广泛应用于OSF的临床治疗中,但由于其成分靶点众多,很难确定其具体机制,因此对红花-牛膝的潜在作用机制进行研究,有助于更好地处理红花-牛膝临床常用剂量、配伍及量效之间的关系。本文采用网络药理学的方法对红花-牛膝的有效成分及红花-牛膝与OSF的靶点进行预测与分析,以期为临床上应用红花-牛膝治疗OSF提供理论基础。
1 资料与方法
1.1 收集红花-牛膝活性成分及其靶点以类药性(DL)>0.18、口服生物利用度(OB>30%)为筛选条件[7],在TCMSP平台(https://tcmspw.com/tcmsp.php)检索“红花”“牛膝”的活性成分。通过数据库SwissTargetPrediction (http://www.swisstargetprediction.ch)[8]获得这些活性成分的潜在作用靶点。合并相关数据库去重后,得到红花-牛膝的活性成分的相关靶基因。
1.2 收集OSF疾病相关靶点以“oral submucous fibrosis”为检索词在GeneCards数据库(https://www.genecards.org)和DisGeNET数据库(https://www.disgenet.org)[9]中得到OSF的靶点并去重。
1.3 绘制“活性成分-靶点”网络取红花-牛膝活性成分的靶点和OSF靶点的交集,利用Cytoscape 3.9.1绘制“活性成分-靶点”网络图,主要活性成分通过度值(degree)筛选[9]。
1.4 蛋白质相互作用(PPI)网络的构建红花-牛膝的活性成分和OSF的交集靶点在STRING平台(https://string-db.org)绘制PPI网络构建图,核心蛋白通过度值进行筛选。
1.5 分子对接将“1.3”项下得到的度值排名前5的活性成分与“1.4”项下得到的PPI网络中度值前6的核心蛋白进行分子对接分析。活性分子的结构从PubChem(https://pubchem.ncbi.nlm.nih.gov)获取[10],而核心蛋白的结构从Protein Data Bank(PDB)数据库中获取,利用AutoDock Vina进行分子对接分析。结合能<-5.0 kcal·mol-1表示结合力良好[11]。对接结果应用PyMOL绘制结合模式图进行展示。
1.6 GO和KEGG富集分析在DAVID数据库(https://david.ncifcrf.gov)[12]中对交集靶点进行GO和KEGG通路富集分析[9],用R语言绘图。在Cytoscape中进行“药物-活性成分-关键靶点-疾病-信号通路”图的绘制[9]。
2 结果
2.1 红花-牛膝靶点收集到红花的活性成分16个、牛膝的活性成分15个,其中有6个为共有活性成分(见表1)。25个活性成分共2 745个相关基因,去重后最终共收集到靶点基因631个。

表1 红花-牛膝主要活性成分信息
2.2 OSF靶点整合GeneCards数据库得到669个OSF靶点基因,DisGeNET数据库106个,去重后为703个OSF靶点基因。疾病与活性成分交集靶点为77个。
2.3 “中药活性成分-靶点”网络对“2.2”项下得到的77个靶点进行“活性成分-靶点”网络图的绘制(见图1)。其中度值前15的活性成分见表2。其中木犀草素(luteolin)、γ-谷甾醇(poriferast-5-en-3beta-ol)、黄芩苷(baicalin)、黄连素(berberine)、黄连碱(coptisine)等活性成分度值较大。
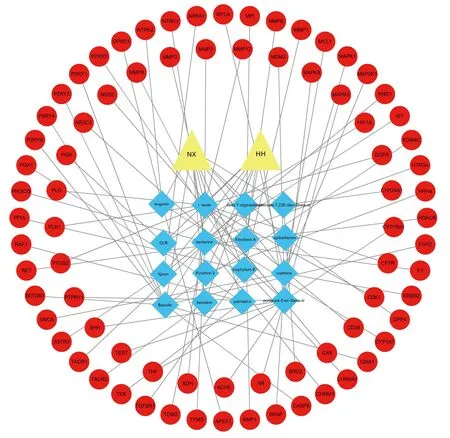
▲牛膝为NX、红花为HH;■为靶点基因;○内为活性成分

表2 “活性成分-靶点”中度值前 15 的活性成分
2.4 PPI 网络分析将“2.2”项下得到的77个交集靶点绘制PPI网络图(见图2),得到77个节点,446条边,平均度值11.6,其中为肿瘤坏死因子(TNF)、表皮生长因子受体(EGFR)、基质金属蛋白酶9(MMP9)、丝裂原活化蛋白激酶3(MAPK3)、酪氨酸激酶受体2(ERBB2)、低氧诱导因子1α(HIF-1α)度值较大(见表3),说明与其他蛋白互作力强。
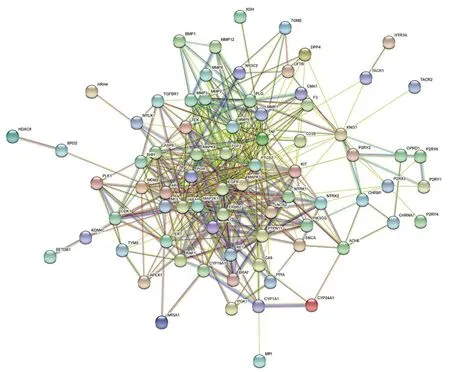
图2 药物与疾病蛋白-蛋白互作图
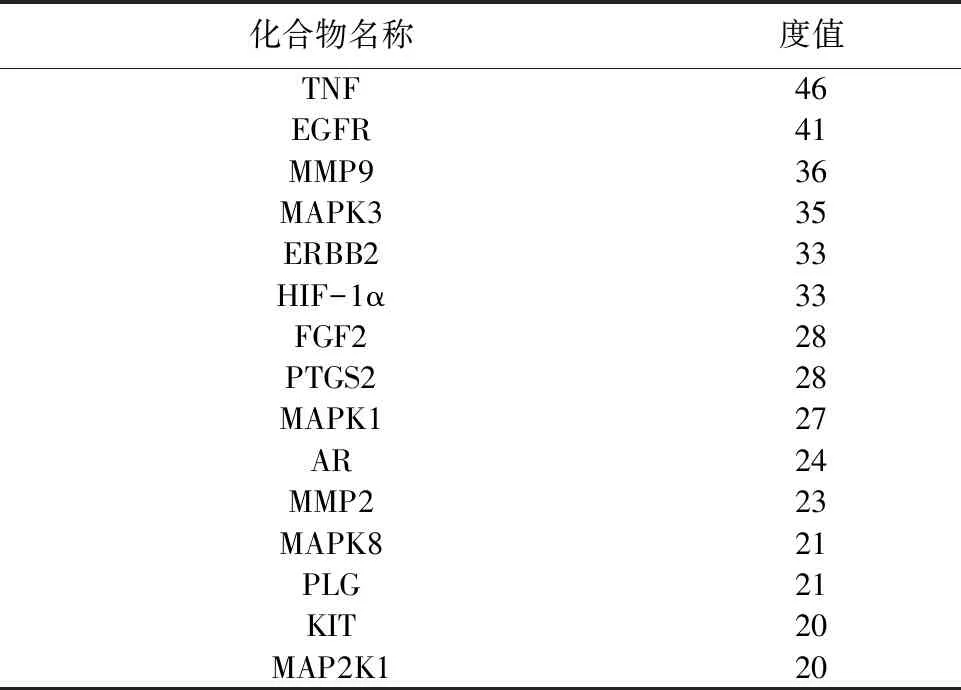
表3 度值前 15 的蛋白
2.5 分子对接分析将“2.3”项下度值最高的5个活性成分与“2.4”项下得到的度值最高的6个核心蛋白进行分子对接,结合能均≤-5 kcal·mol-1(见表4)。输出三维分子对接图(见图3)。

图3 成分-靶点对接相互作用模式图

表4 主要活性分子与核心蛋白分子对接结合能(kcal·mol-1)
2.6 GO和KEGG富集分析77个靶基因进行GO富集分析后得到299个生物过程(BP)条目,包括negative regulation of apoptotic process、positive regulation of gene expression、protein phosphorylation、positive regulation of MAPK cascade、response to hypoxia、extracellular matrix disassembly等过程;49条细胞成分(CC)条目,包括plasma membrane、integral component of plasma membrane、extracellular space、mitochondrion等成分;66条分子功能(MF)条目,包括ATP binding、identical protein binding、zinc ion binding、protein kinase activity和enzyme binding等功能。对排名前10的3种聚类分析条目进行绘图(见图4)。
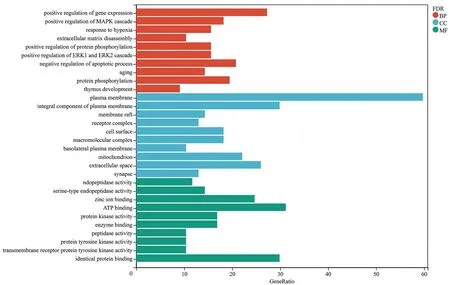
图4 交集靶点GO富集分析
使用DAVID对77个交集靶点进行KEGG富集分析,得到117条相关通路(见图5)。以P<0.05筛选出110条信号通路,排除与OSF无明显相关性的通路后,P值最小的前11条通路主要为:癌症信号通路(pathways in cancer、proteoglycans in cancer、central carbon metabolism in cancer)、钙离子信号通路(calcium)、松弛素信号通路(relaxin)、炎症信号通路(IL-17、C-type lectin receptor、MAPK)、缺氧诱导因子1信号通路(HIF-1)、细胞凋亡信号通路(PI3K-Akt、FoxO)等(见表5)。
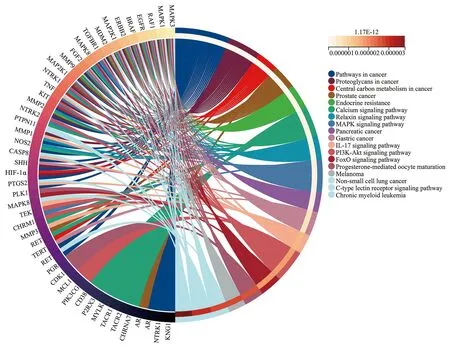
图5 交集靶点KEGG富集分析
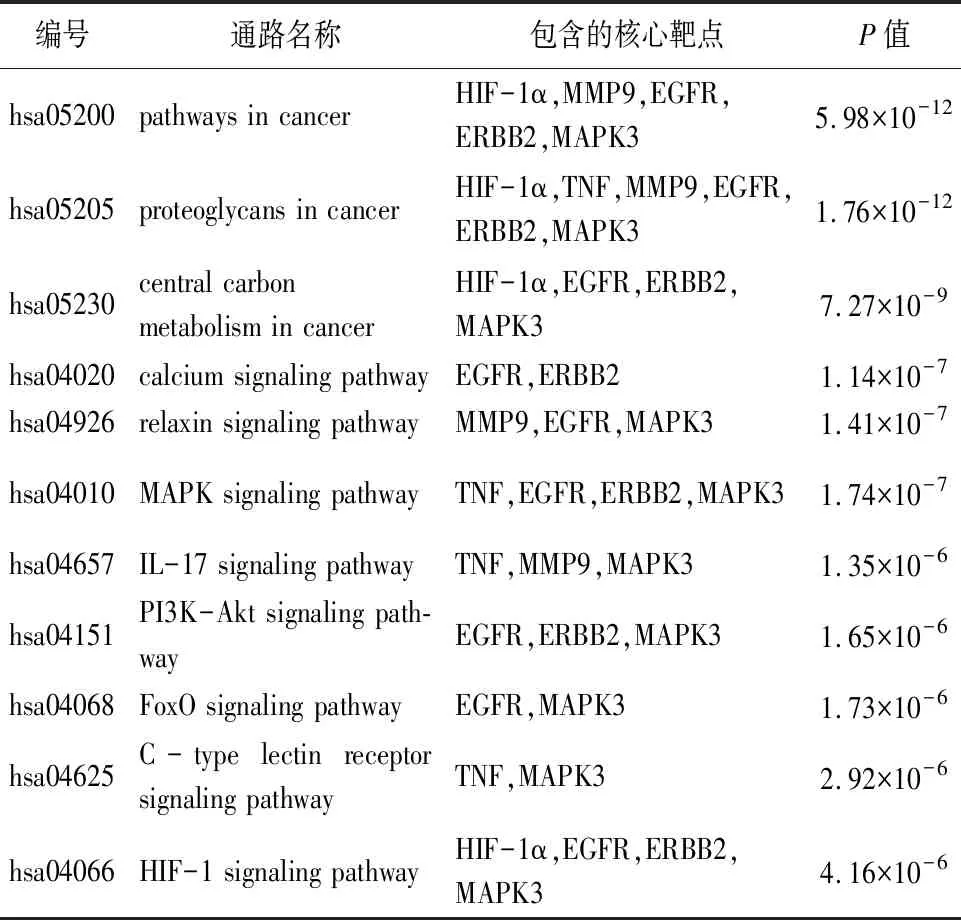
表5 关键信号通路与核心靶点
3 讨论
中医学认为口腔黏膜局部的毒邪郁积、气机不畅、血运受阻、气血失和导致了OSF的发生,治疗以理气活血、化瘀软坚为主要原则,使用具有活血化瘀作用的中药可通过促进病变部位血管生成及增加血液流量来治疗OSF[13]。红花具有活血散瘀、通经止痛的功效[14],牛膝具有逐瘀通经、补肝肾、强筋骨、利尿通淋、引血下行的功效[15],两者是各类活血方剂中的重要组成部分,活血化瘀解毒汤、自拟解纤饮就包含了红花,而清代王清任的血府逐瘀汤里更是包含了红花、牛膝等多种活血化瘀的中药[13,16]。
本研究中,我们发现红花-牛膝与 OSF 交集靶基因77个,红花-牛膝共有16种有效成分协同作用于OSF的疾病靶点,主要为木犀草素、黄芩苷、黄连素和黄连碱,有效成分作用于OSF的核心靶点为TNF、EGFR、MMP9、MAPK3、ERBB2、HIF-1α,且主要活性成分与核心蛋白具有良好的结合能力。现代药理学认为木犀草素、黄芩苷均属于黄酮类化合物,而黄连素、黄连碱都属于异喹啉类生物碱,四者都具有调节酶活性、抗血小板聚集、参与细胞凋亡和干细胞信号转导等药理活性,能发挥抗炎、抗氧化、抗肿瘤、改善微循环等多种作用[17-19]。这些结果说明红花-牛膝可能通过其抗炎、抗氧化、抗肿瘤以及改善微循环障碍等作用来治疗OSF。
进一步通过GO和KEGG富集分析,红花-牛膝治疗 OSF以细胞凋亡负调控、缺氧反应及MAPK级联反应正调控生物过程为主,主要通过癌症、钙离子、炎症及细胞凋亡相关信号通路起作用。其中与癌症和炎症相关的信号通路条数最多,富集的核心蛋白基因最多,提示在红花-牛膝的抗炎和抗肿瘤作用在治疗OSF中具有重要意义。
C-type lectin receptor信号通路、IL-17信号通路以及MAPK信号通路中的JNK 和 p38-MAPK路径是3条经典的炎症信号通路,在多种炎症反应及自身免疫性疾病的病理过程中都起着关键作用,且三者存在着相互调控的关系。C-type lectin receptor的活化可促进IL-17的表达[20],而IL-17家族可通过其相应受体发出信号,激活下游的 MAPK信号通路,诱导抗菌肽、细胞因子和趋化因子的表达,激活体内的炎症级联反应[21]。OSF的病理过程与炎症反应密切相关,研究认为槟榔碱等刺激因素可通过引发口腔组织表达TNF-α等促炎因子,抑制MMP的表达并促进金属蛋白酶组织抑制剂(TIMP)的表达,打破细胞外基质蛋白生成与降解的平衡,进而导致胶原纤维异常沉积[22]。此外,细胞炎症反应还可刺激细胞持续表达转化生长因子β(TGF-β)和β成纤维细胞生长因子(β-FGF),促进成纤维细胞向肌成纤维细胞转化,导致胶原纤维的生成增加[2]。Kundu等[23]学者对OSF患者的口腔黏膜软组织进行了测序分析,他们发现与健康对照组相比,OSF患者中MAPK和IL-17 信号通路都出现异常活化。而木犀草素、黄芩苷、黄连素和黄连碱均具有显著的抗炎作用。木犀草素可以通过抑制人视网膜色素上皮细胞中的NF-κB和MAPK信号通路,降低IL-1β、IL-6、TNF-α、可溶性细胞间黏附分子-1和单核细胞趋化蛋白-1等炎症介质的表达[24];还能通过降低人乳腺上皮细胞中的IL-1β、IL-6、TNF-α、MMP-2和MMP-9的表达,上调TIMP-1和TIMP-2的水平来抵抗金黄色葡萄球菌引发的炎症反应[25]。黄芩苷能通过抑制JAK2-STAT3信号通路,调节Th17/Treg细胞的平衡,降低TNF-α、IL-6、IL-17和IL-1β的表达,减轻关节腔中的炎症反应[26]。黄连素能通过显抑制大鼠体内JNK1的磷酸化,降低 TNF-α和IL-6的表达[27],还能通过降低TNF-α、TGF-β1的表达和增加MMP-2的水平来促进胶原蛋白的降解,从而减轻肝脏的纤维化[28]。黄连碱也能通过抑制MAPK信号通路降低动脉粥样硬化小鼠血清中IL-6、 IL-1β、 TNF-α水平,并下调血管内皮细胞中血管细胞黏附分子-1、IL-6和 IL-1β的表达[29]。结合本研究结果,我们推测红花-牛膝可能通过调控C-type lectin receptor、IL-17以及MAPK信号通路发挥着OSF治疗过程中的抗炎作用。
Pathways in cancer、proteoglycans in cancer和central carbon metabolism in cancer是3条调控肿瘤微环境的信号通路,参与了肿瘤的生长和迁移。OSF是一种具有癌变倾向的疾病,槟榔碱等刺激因素诱导的持续性炎症、胶原沉积、生长因子和细胞因子分泌可能导致OSF向恶性肿瘤转化。已有研究显示在晚期OSF和口腔鳞状细胞癌中存在着共同的生物标记物,如TGF-β1、 HIF-1α、MMP、TIMP和血清免疫球蛋白G等[30-32]。木犀草素可以通过调控AKT/mTOR 信号通路下调MMP9的表达,从而抑制乳腺癌细胞增殖和转移[33]。黄芩苷能通过抑制HIF-1α和芳香烃受体的表达减弱TGF-β1诱发的人肺动脉平滑肌细胞的异常增殖[34]。黄连素能通过下调EGFR 和 ERBB2的表达抑制卵巢癌细胞的迁移和侵袭[35]。而黄连碱能通过调节JNK信号通路介导人类肝癌细胞的凋亡[36]。木犀草素、黄芩苷、黄连素和黄连碱的抗肿瘤作用可能在红花-牛膝治疗OSF的过程中具有重要作用。
综上所述,红花-牛膝可能以木犀草素、黄芩苷、黄连素和黄连碱等主要活性成分,通过C-type lectin receptor、IL-17、MAPK和癌症相关等信号通路作用于TNF、EGFR、MMP9、MAPK3、ERBB2、HIF-1α等靶点来治疗OSF。本研究应用网络药理学研究方法分析了红花-牛膝治疗OSF的潜在作用机制,为进一步探究红花-牛膝治疗OSF提供理论线索与依据。但本研究尚未对预测的关键靶点以及通路进行验证,未来将通过体内、外实验进一步验证分析,以期能够促进药物的研发以及改良。
