华蟾素通过抑制谷胱甘肽合成酶表达诱导肝癌细胞发生铁死亡的作用机制研究
2024-04-23兀琦杨静依陈启梅王安美孙艺轩张加余杨爱琳
兀琦,杨静依,陈启梅,王安美,孙艺轩,张加余,杨爱琳
(滨州医学院药学院,山东 烟台 264003)
癌症是导致人类死亡的主要原因之一,据2020年GLOBOCAN项目研究表明肝癌的死亡率位居世界第三,占癌症总死亡率的8.3%[1]。肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌最常见的一种类型。早期发现可通过手术切除、射频消融术、肝移植等方法治疗,然而大多数肝癌患者确诊时已为中晚期[2]。截至目前,化疗依旧是晚期肝癌治疗的主要方法,但在临床治疗中,化疗往往会引起一系列不良反应,例如肝功能异常、高血压、腹泻等。因此迫切需要开发新的有效、低毒性抗肝癌药物。
中医药有着悠久的历史,近年来在抗肿瘤领域引起广泛关注。中医药能够增强化疗疗效,提高生存期。华蟾素是从蟾蜍科动物中华大蟾蜍或黑眶蟾蜍(BufoBufogargarizansCantor)蟾蜍干皮中提取所得,其主要活性成分为蟾蜍二烯内酯、生物碱和肽类[3]。华蟾素胶囊、华蟾素注射液等广泛应用于临床肝癌的治疗[4-5]。临床研究表明,华蟾素联合化疗药物能够显著提高晚期癌症患者药物疗效和生活质量[6]。另外,有研究表明华蟾素能够通过抑制细胞增殖、诱导细胞凋亡、抑制上皮间充质转化和抑制肿瘤血管生成等多方面机制发挥抗肿瘤功效[7]。
铁死亡是由于失去对膜脂质过氧化的控制而导致的细胞死亡的形式,其发生过程中伴随铁依赖性脂质累积、谷胱甘肽过氧化物酶4(GPX4)功能异常、活性氧(ROS)升高和还原型谷胱甘肽(GSH)含量下降[8-9]。GSH是人体内重要的抗氧化剂,能够清除活性氧。此外,有研究表明GSH合成障碍导致脂质活性氧累积,导致铁死亡发生[10]。GSS催化λ-谷氨酰半胱氨酸与甘氨酸反应生成还原性GSH,不受GSH反馈抑制的调节[11]。另有资料显示,在肝癌细胞中,核糖核苷酸还原酶M2肽(RRM2)依赖于GSS刺激GSH合成,从而抑制铁死亡[12],且有研究表明通过药物诱导铁死亡为目前肿瘤治疗的新策略及研究热点[13]。关于华蟾素能否诱导肝癌细胞发生铁死亡及作用机制目前鲜有报道,本研究从铁死亡角度探讨华蟾素抑制肝癌细胞生长的机制。
1 材料与方法
1.1 试验药物华蟾素胶囊(批号:OD04)来自于陕西东泰制药有限公司。
1.2 细胞系人肝癌HepG2细胞(American Type Culture Collection)。
1.3 试剂DMEM基础培养基、胎牛血清(FBS)、青霉素-链霉素混合液和0.25%的胰蛋白酶(美国康宁公司);CCK-8细胞活性检测试剂、还原型谷胱甘肽(批号:BN27005,北京百瑞极生物科技有限公司);铁螯合剂(DFO,批号:D9533,Sigma公司);MDA检测试剂盒、GSH和氧化型谷胱甘肽(GSSG)检测试剂盒、ROS检测试剂盒(上海碧云天生物技术有限公司);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);GSS(批号:sc-166882)和β-actin(批号:sc-47778)(美国Santa Cruz公司);HRP标记的羊抗鼠二抗(美国Cell Signaling Technology公司)。
1.4 仪器SpectraMAX M2型多功能酶标仪(美国Molecular Devices公司);LightCycler 96型实时荧光定量PCR(德国罗氏公司);DYY-6D电泳仪电源(北京六一生物科技有限公司);C600多功能荧光化学发光成像仪(Azure Biosystems公司);TUS-200P震荡型恒温金属浴(上海恒科有限公司)。
1.5 方法
1.5.1 细胞培养与细胞活性检测将细胞培养在含89% DMEM基础培养基、10% FBS和1%的青霉素-链霉素的完全培养基中,放入含5% CO2的37 ℃恒温培养箱中进行培养。通过细胞活性检测实验研究华蟾素对人肝癌HepG2细胞增殖的影响。首先,将HepG2细胞(3.5 × 103个/孔)铺于96孔板中,24 h后,吸出上清,将细胞与华蟾素药液0、2、4、6、8 μg·mL-1单独或者分别与DFO 50 μmol·L-1、GSH 5 mmol·L-1联合处理48 h。之后,吸出上清,每孔加入100 μL 10% CCK-8工作液,将培养板放入培养箱敷育1 h后用酶标仪在450 nm波长下进行检测。
1.5.2 细胞MDA含量检测将肝癌细胞铺于6孔板中,待细胞密度达到90%时进行药物干预,设置华蟾素浓度为0、8 μg·mL-1,培养24 h。细胞样品处理方法:用胰蛋白酶消化后,加入1 mL DMEM完全培养液吹打收集细胞,1 000×g 离心5 min。移除上清,将细胞用1 mL PBS清洗,再次离心5 min,移除上清,加入70 μL PBS。细胞样品采用反复冻融的方法进行裂解细胞,将其放入-80 ℃冷冻,10 min后取出冷冻的细胞放置于37 ℃金属浴融化5 min。反复冻融4次后,收集上清。之后根据MDA检测试剂盒说明书对细胞样品进行检测。MDA含量通过样品的蛋白浓度归一化,蛋白浓度由BCA蛋白测定试剂盒测定。
1.5.3 细胞内GSH含量检测将肝癌细胞铺于6孔板中,待细胞密度达到90%时进行药物干预,设置华蟾素浓度为0、8 μg·mL-1,培养24 h。之后根据试剂盒说明书对细胞样品进行处理检测。GSH含量通过细胞数量进行归一化。
1.5.4 细胞内ROS水平测定将肝癌细胞铺于6孔板中,待细胞密度达到90%时进行药物干预,设置华蟾素浓度为0、8 μg·mL-1,培养24 h。之后收集细胞,悬浮于稀释好的DCFH-DA(1∶1 000)中。放置于37 ℃培养箱中避光敷育20 min,并每间隔5 min颠倒混匀一下,使探针与细胞充分接触。敷育结束后,用无血清DMEM基础培养基洗涤细胞3次,以充分去除未进入细胞内的探针。最后将细胞悬浮于200 μL PBS中,在30 min内进行流式细胞仪上机检测。采用FlowJo软件分析荧光强度。
1.5.5 实时荧光定量PCR (QRT-PCR)将肝癌细胞铺于6 cm皿中,待密度达到85%时进行药物干预,设置华蟾素药物浓度为0、8 μg·mL-1,培养24 h。使用E.Z.N.A.©Total RNA Kit I (OMEGA) 根据试剂盒说明书进行总RNA抽提。使用NanoDrop 2000分光光度计测定RNA浓度。使用Takara PrimeScript RT Reagent Kit进行cDNA逆转录。以下引物用于QRT-PCR:
Human actin(Forward):5′-GGGACCTGACTGACTACCTC-3′
Human actin (Reverse):5′-TCATACTCCTGCTTGCTGAT-3′
Human GSS (Forward):5′-GTACTCACTGGATGTGGGTGAAGA-3′
Human GSS (Reverse):5′-CGGCTCGATCTTGTCCATCAG-3′
1.5.6 Western blotting肝癌细胞用不同浓度的华蟾素药液(0、2、4、8 μg·mL-1)处理24 h。细胞用预冷的PBS洗涤两次,加入细胞裂解液,充分裂解后收集细胞裂解物。在SDS-PAGE凝胶上分离细胞裂解物,之后转移到PVDF膜上。膜在4 ℃下用含5%脱脂牛奶的TBST缓冲液封闭过夜。第2天,将膜与特异性一抗(1∶1 000)在4 ℃下孵育过夜,将膜用TBST缓冲液洗涤40 min,然后与HRP偶联的二抗(1∶2 000)在4 ℃下孵育过夜。最后,用TBST缓冲液洗涤40 min后,使用ECL超敏发光液检进行蛋白检测,并通过凝胶图像系统(Azure Biosystems C600,美国)显示条带。
1.5.7 siRNA转染将肝癌细胞铺于6孔板中,待细胞密度达到50%进行转染。将Lipofectamine 2000 5 μL与opti-MEM培养液250 μL混合在一起,用枪轻轻吹匀。将siRNA 10 μL加到opti-MEM培养液250 μL中,与加有Lipofectamine 2000的opti-MEM培养液混合在一起,室温静置20 min。之后将6孔板中的培养基弃掉,加入opti-MEM培养液1 500 μL,将含有Lipofectamine 2000的siRNA溶液500 μL,补齐至每孔2 mL体系,放入细胞培养箱中6 h后将上清替换为DMEM完全培养基。siRNA序列如下:
siNC(negative control,NC):5′-UUCUCCGA-ACGUGUCACGUTT-3′;
siGSS:5′-AGGAAATTGCTGTGGTTTA-3′。
1.6 统计学方法所有数据统计及分析作图采用GraphPad Prism 8。数据比较采用t检验。P<0.05表明组间差异具有统计学意义。
2 结果
2.1 华蟾素诱导肝癌细胞发生铁死亡前期通过研究发现华蟾素能够明显抑制肝癌细胞的生长[3]。为了研究华蟾素抑制肝癌细胞生长的形式,采用细胞铁螯合剂DFO干预不同浓度华蟾素处理的细胞。结果显示,DFO能够部分逆转华蟾素对人肝癌HepG2细胞的增殖抑制能力,HepG2细胞用不同浓度华蟾素药液(0、2、4、6、8 μg·mL-1)或与DFO(50 μmol·L-1)联合处理48 h,采用CCK-8检测细胞活力,结果见图1。由此可见,华蟾素能够通过诱导人肝癌HepG2细胞发生铁死亡的形式抑制增殖。
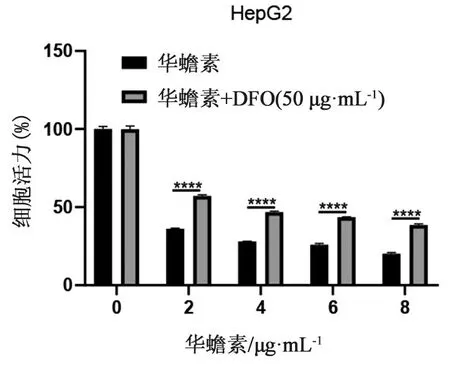
图1 华蟾素对肝癌细胞铁死亡的影响
2.2 华蟾素能够增强肝癌细胞ROS和脂质过氧化水平铁死亡的直接表现是诱导细胞内ROS累积和脂质过氧化诱导的细胞损伤[14]。因此,首先通过流式细胞术检测人肝癌HepG2细胞经过华蟾素处理后的ROS水平。用浓度为0、8 μg·mL-1的华蟾素药液处理HepG2细胞48 h后,用DCFH-DA染色并通过流式细胞仪分析结果显示,HepG2细胞经华蟾素处理后荧光强度增强,说明华蟾素能够诱导HepG2细胞产生ROS(见图2A)。为了进一步研究华蟾素是否通过铁死亡介导的脂质过氧化诱导细胞发生损伤,通过检测细胞内MDA水平发现,用华蟾素药液(0、8 μg·mL-1)处理HepG2细胞24 h,检测MDA水平与对照组相比,HepG2细胞内MDA水平显著升高(见图2B),暗示细胞脂质过氧化程度和细胞损伤的加重。
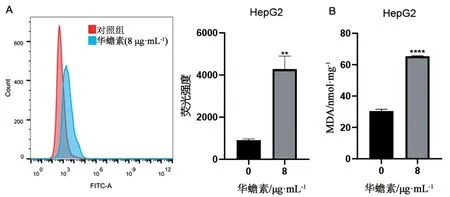
图2 华蟾素对肝癌细胞活性氧(ROS)和丙二醛(MDA)的影响
2.3 华蟾素通过降低肝癌细胞GSH水平抑制细胞增殖前期文献报道,GSH能够避免细胞发生氧化性损伤,更重要的是铁死亡途中伴随着GSH的损失,除了MDA检测,铁死亡的脂质过氧化的指标还有GSH合成的变化[10,15]。细胞中存在多个对抗铁死亡的防御途径,其中最主要的一个是由GPX4所介导的,通过GSH特异性催化过氧化脂质来抑制铁死亡的发生[16]。用华蟾素药液(0、8 μg·mL-1)处理HepG2细胞24 h,检测GSH水平,相比空白对照组,华蟾素干预组GSH水平显著降低(见图3A)。为了进一步探究华蟾素是否通过下调GSH水平抑制肿瘤细胞生长, HepG2细胞用不同浓度华蟾素药液(0、2、4、6、8 μg·mL-1)或与GSH(5 mmol·L-1)联合处理48 h,采用CCK-8检测细胞活力。结果显示,GSH能够部分逆转华蟾素对肝癌细胞的增殖抑制作用(见图3B)。综上,华蟾素可能通过降低肝癌细胞内的GSH水平诱导铁死亡从而表现出抑制肝癌生长的作用。
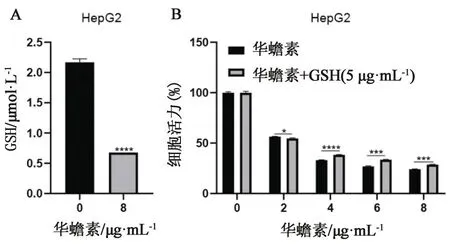
图3 华蟾素对肝癌细胞谷胱甘肽(GSH)含量的影响
2.4 华蟾素能够抑制肝癌细胞GSS水平GSS能够催化λ-谷氨酰半胱氨酸与甘氨酸反应形成GSH[11]。我们首先检测华蟾素对人肝癌HepG2细胞中的GSS水平的影响。用华蟾素药液(0、8 μg·mL-1)处理HepG2细胞24 h,采用QRT-PCR检测GSS的mRNA水平。如图4A所示,与对照组相比,华蟾素干预后肝癌细胞GSS的mRNA水平降低,表明华蟾素干预导致GSS的转录抑制。此外, HepG2细胞采用0、2、4、8 μg·mL-1的华蟾素药液处理24 h,通过Western blotting检测GSS蛋白水平。华蟾素给药干预后肝癌细胞中GSS蛋白表达减弱(见图4B)。

图4 华蟾素对肝癌细胞中谷胱甘肽合成酶(GSS)水平的影响
2.5 抑制肝癌细胞GSS水平能够降低GSH产生接下来,我们研究在肝癌细胞中GSS是否影响GSH产生。用靶向GSS(siGSS)或阴性对照(siNC)的siRNA转染肝癌HepG2细胞。通过Western blotting检测敲低GSS后HepG2细胞GSS蛋白水平的变化。如图5A所示,敲低GSS能够显著抑制HepG2细胞GSS的蛋白表达。同时我们对HepG2细胞敲低GSS后其GSH含量进行检测,结果表明敲低GSS组与siNC组相比,细胞内GSH含量降低(见图5B)。以上结果表明华蟾素可能通过抑制肝癌细胞GSS水平进而抑制GSH的产生。
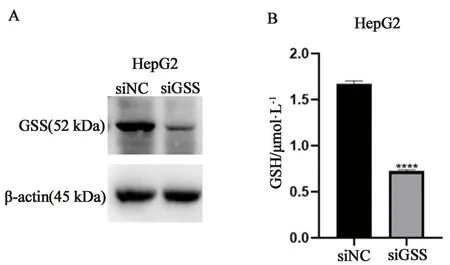
图5 敲低GSS对肝癌细胞GSH含量的影响
2.6 华蟾素诱导肝癌细胞铁死亡部分通过干预GSS实现我们进一步研究华蟾素是否部分通过抑制GSS诱导肝癌细胞铁死亡,HepG2细胞(转染siNC或siGSS)用不同浓度华蟾素药液(0、0.5、1、2 μg·mL-1)或与DFO(50 μmol·L-1)联合处理48 h,采用CCK-8检测细胞活力。如图6A所示,敲低GSS会削弱DFO对华蟾素增殖抑制的逆转作用。HepG2细胞(转染siNC或siGSS)用不同浓度华蟾素药液(0、0.5、1、2 μg·mL-1)处理48 h,采用CCK-8检测细胞活力。如图6B所示,敲低GSS在一定程度上能够抑制肝癌细胞的生长,并能够增强华蟾素对肿瘤细胞的增殖抑制作用。上述结果表明华蟾素诱导肝癌细胞铁死亡可能通过干预GSS水平来实现。
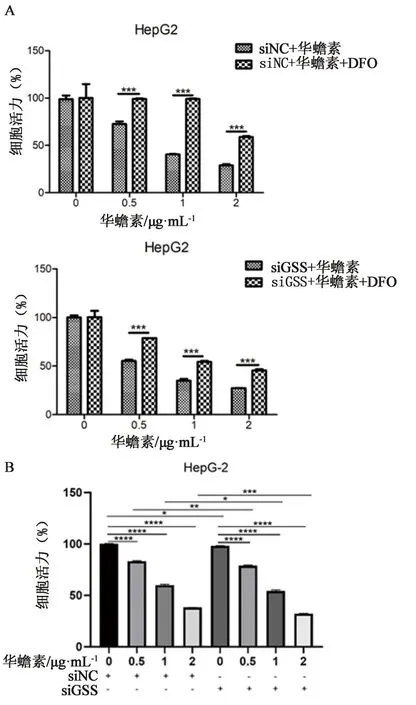
图6 华蟾素部分通过抑制GSS诱导肝癌细胞铁死亡
3 讨论
目前,大多数肝癌患者确诊时已为晚期,只有15%患者能够手术治疗。索拉非尼是FDA批准唯一用于肝癌晚期治疗的药物[17],然而其具有较强的毒副作用,因此迫切需要开发新的抗肝癌药物。在临床中,中药应用于癌症治疗历史悠久[18]。华蟾素作为中成药已广泛应用于临床治疗肝癌、胃癌和胰腺癌等[19-20]。
铁死亡是一种独特的细胞死亡方式。研究表明通过药物诱导铁死亡能够抑制肿瘤发生发展[21],其发生的主要机制为多不饱和脂肪酸途径诱导脂质过氧化导致ROS累积最终造成细胞损伤[22]。MDA是脂质过氧化的副产物[23],是铁死亡的标志物。通过研究发现铁螯合剂DFO能够部分逆转华蟾素对肝癌细胞的增殖抑制作用,我们又进一步检测了铁死亡标志物ROS与MDA,结果显示华蟾素能够诱导肝癌细胞内ROS和MDA的累积,可见华蟾素能够诱导肝癌细胞发生铁死亡。GSH缺失可诱导肿瘤细胞铁死亡[24]。研究表明抑制GSH能够增加脂质ROS含量,增强HCC对铁死亡的敏感性,GSH合成的变化能够反映铁死亡的脂质过氧化程度[25]。细胞中存在多个对抗铁死亡的防御途径,其中最主要的一个是由GPX4所介导的,通过GSH特异性催化过氧化脂质来抑制铁死亡的发生[9]。此外,研究证实Erastin能够通过直接降低GSH水平,诱导缺乏GPX4的敏感细胞发生铁死亡[26]。因此,抑制GSH合成是诱导铁死亡的主要方法。我们检测华蟾素干预后肝癌细胞内GSH含量,结果发现华蟾素干预后GSH水平降低,且GSH能够减弱华蟾素对肝癌细胞的增殖抑制作用。因此,华蟾素可能通过抑制GSH诱导人肝癌HepG2细胞发生铁死亡进而表现出抑制肝癌细胞生长的作用。GSS是GSH生物合成的关键酶,研究表明GSS在肿瘤组织中呈现升高趋势[13]。此外,有研究证实抑制GSS能够降低肝癌细胞活性,且GSH能够减弱由GSS抑制所诱导的细胞增殖抑制作用[27]。通过研究发现华蟾素能够抑制GSS水平,且敲低GSS能够抑制GSH水平。进一步研究结果显示敲低GSS能够削弱DFO对华蟾素增殖抑制的逆转作用,且敲低GSS能够在一定程度上抑制肝癌细胞生长,并增强华蟾素对肿瘤细胞的增殖抑制作用。综上,我们认为华蟾素诱导人肝癌细胞铁死亡可能是通过干预GSS来实现的。本研究有助于阐明华蟾素复杂的抗肝癌作用,为华蟾素应用于肝癌临床治疗提供新的理论支持。
