基于Keap1/Nrf2/HO-1信号通路研究当归醇提物对多囊卵巢综合征大鼠的保护作用
2024-04-23莫思懿曹后康张可锋钟明利韦日明
莫思懿,曹后康,张可锋,晋 玲,钟明利,韦日明,高 雅
(1. 桂林医学院高发病防治药理学重点实验室,广西 桂林 541199;2. 甘肃中医药大学药学院,甘肃 兰州 730000)
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是一种以雄激素水平升高、排卵功能障碍和形态异常为特征的疾病[1]。在全球范围内,PCOS的发病率在2%至26%之间[2],而在我国育龄期妇女患病率为5.6%[3]。患有PCOS的女性,除了生殖系统问题外,往往还会伴随其他代谢方面的异常,例如糖耐量下降、二型糖尿病风险增加、血脂水平异常、高血压风险升高等,这些因素长期累积可能会增加代谢综合征和心血管疾病的风险。西医主要以对症治疗为主,且需要进行长期的健康管理。大多数西药都含有单一的活性成分,能进行靶向性治疗,但是PCOS的发病机制相对复杂,西药治疗PCOS具有很多局限性[4]。中医药在治疗上具有多靶点、多途径和多环节的明显特点,因此,如何运用中医药改善PCOS患者的卵巢病变,调节激素分泌和维持代谢平衡,是重点研究方向之一。
中药材当归来源于伞形科植物当归Angelicasinensis(Oliv.)Diels的干燥根。有研究发现,当归含有黄酮类、香豆素类和酚酸类等物质,具有抗炎、抗氧化、调节肠道菌群等多种功能,能够防治代谢性疾病[5-6]。临床用药规律分析表明,当归是治疗PCOS中药处方中的核心药物,使用频率很高[7]。研究表明[8-9],PCOS疾病及相关并发症与卵巢氧化应激失衡密切相关,而Keap1/Nrf2/HO-1通路是调控氧化应激的重要信号通路[8-9]。因此,本实验用来曲唑联合高脂饮食诱导大鼠PCOS模型,检测当归醇提物(ethanol extract ofAngelicaeSinensisRadix,EEA)对PCOS大鼠激素、血脂和氧化应激相关指标的影响,同时关注Keap1/Nrf2/HO-1信号通路相关蛋白和基因表达,阐明EEA改善PCOS的潜在机制,为EEA用于临床治疗PCOS提供依据。
1 材料
1.1 实验动物本研究SD雌性大鼠(180±20 )g购自湖南斯莱克景达实验动物有限公司,生产许可证号为SCXK(湘)2020-0006。本实验获得桂林医学院动物伦理委员会批准,批准号GLMC20210039。
1.2 材料与试剂
1.2.1实验药物 来曲唑(K26O10H101137)购自上海源叶生物科技有限公司;二甲双胍(1115-70-4)购自上海阿拉丁生化科技股份有限公司。本研究所用当归采自甘肃岷县,经桂林医学院药物研究所张可锋教授鉴定为当归Angelicasinensis(Oliv.)Diels的干燥根。EEA提取方法:将当归粉末与60%乙醇按1 ∶10(kg·L-1)的比例混合。将混合物浸入圆底烧瓶中4 h,进行2 h的热回流萃取,过滤混合物以收集滤液,使用相同的方法再次提取残渣。合并滤液旋转蒸发浓缩至1.0 kg·L-1的生药浓度(当归粉末的重量除以溶液的体积)。使用安捷伦1260 Infinity II液相色谱仪和Waters ACQUITY UPLC®BHE C18色谱柱(2.1 mm×50 mm,1.7 μm),应用标准品对EEA的组成进行鉴定,结果表明,EEA中含有绿原酸、阿魏酸、洋川芎内酯Ⅰ、洋川芎内酯Ⅱ、洋川芎内酯Ⅲ、阿魏酸松柏酯、藁本内酯和丁烯基苯酞(Fig1)。
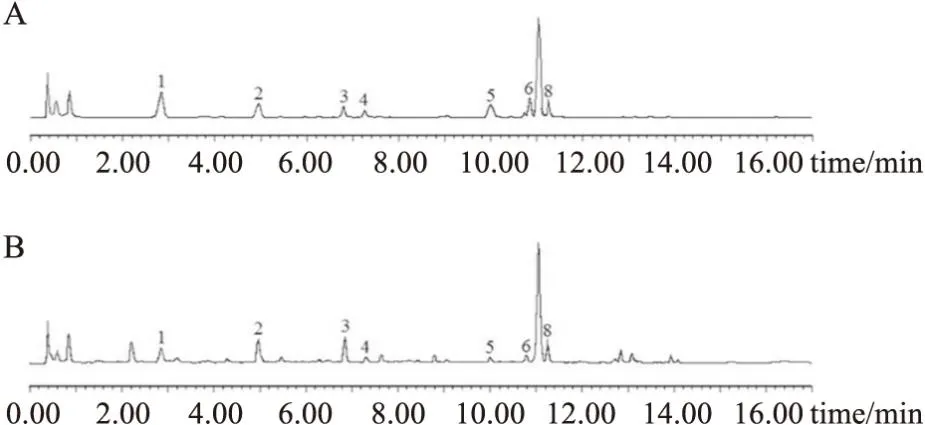
Fig1 UPLC chromatograms of standard (A) and EEA (B)
1.2.2实验试剂 睾酮(testosterone, T)(MM-0577R1)、卵泡刺激素(follicle stimulating hormone, FSH)(MM-0566R1)、黄体生成素(Luteinizing hormone, LH)(MM-0624R1)、雌二醇(estradiol, E2)(MM-0575R1)的ELISA试剂盒购自江苏酶免实业有限公司;超氧化物歧化酶(superoxide Dismutase, SOD)(20210126)、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)(20210320)、丙二醛(malondialdehyde, MDA)(20210222)试剂盒购自南京建成生物工程研究所;甘油三酯(triglyceride, TG)(A110-1-1)、总胆固醇(total cholesterol, TC)(A111-1-1)、低密度脂蛋白胆固醇(Low-density lipoprotein cholesterol, LDL-C)(A112-1-1)和高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)(A113-1-1)的测试盒购自南京建成生物工程研究所;30%丙烯酰胺(A1010)、过硫酸铵(A1030)、十二烷基硫酸钠(S1010)、封闭液(SW3015)、Marker(PR1920)和发光液(SW2040)购自上海碧云天生物技术有限公司;TRIzol试剂(P118)、cDNA第一链合成试剂盒(A214)和预混实时荧光定量快速PCR反应体系(A301)购自北京康润诚业生物科技公司。一抗Keap1(18496-1-AP)、Nrf2(16396-1-AP)、HO-1(19937-1-AP)、GAPDH(10016192)购自Proteintech公司。二抗辣根过氧化物酶标记的山羊抗小鼠(ZB-2305)和山羊抗兔(ZB-2301)购自中杉金桥公司。
1.3 仪器FRESCO 21高速冷冻离心机(美国Thermo Fisher Scientific公司);HM315R型切片机(德国MICROM);POWERPAC BASIC POWER SUPPLY型电泳仪电源、Mini-Protean Tetra Cell型蛋白电泳系统和转印系统(BIO-RAD公司);BX51显微镜(日本OLYMPUS);Epoch型酶标仪(美国Bio-Tek);Tanon 3500全自动数码凝胶成像分析系统(上海天能公司)。
2 方法
2.1 实验分组与处理大鼠适应性喂养1周,随机分为正常组、模型组、二甲双胍组(300 mg·kg-1)、EEA低、中、高剂量组(200、400、800 mg·kg-1)(以生药量计,给药剂量是将临床成人剂量转换为大鼠剂量获得),每组10 只。第1~4 周,正常组标准饮食,每天灌胃1%羧甲基纤维素钠(carboxymethylcellulose sodium, CMC-Na)溶液,其余各组喂食高脂饮食,每天灌胃含有来曲唑(1 mg·kg-1)的1% CMC-Na溶液;第5~8周,给药组灌胃对应药物,正常组和模型组给予等体积的蒸馏水。禁食不禁水16 h,麻醉大鼠后采集血液并收集卵巢。将左侧卵巢保存到-80 ℃液氮中,右侧卵巢用4%多聚甲醛溶液固定。
2.2 苏木精-伊红(HE)染色检查大鼠卵巢组织病变在多聚甲醛溶液中固定48 h后的卵巢组织,依次经过脱水、石蜡包埋、切片、脱蜡、苏木精和伊红染色,中性树胶封片后在显微镜下观察病理情况。
2.3 酶联免疫吸附法(ELISA)检测血清中T、FSH、LH和E2的含量将采集的血液常温静置1.5 h后,用低温离心机以5 000 r·min-1离心12 min,收集血清后按照试剂盒说明书指示,检测并计算血清中T、FSH、LH和E2含量。
2.4 生化法检测血清中TG、TC、LDL-C、HDL-C含量收集血清后按照试剂盒说明书指示,检测并计算血清中TG、TC、LDL-C和HDL-C含量。
2.5 生化法检测卵巢组织中SOD、GSH-Px、MDA的活性或含量用组织匀浆机加生理盐水制备10%卵巢组织匀浆,离心后取上清液,按照试剂盒说明书步骤检测并计算此3种因子的活性或含量。
2.6 蛋白免疫印迹法(Western blot)检测Keap1、Nrf2和HO-1的蛋白表达选取正常组、模型组和EEA高剂量组卵巢组织进行检测,首先使用配置好的裂解液(PMSF:RIPA=1 ∶100)制备5%卵巢组织匀浆,制备蛋白样本,将蛋白样本进行电泳分离,在300 mA恒定电流下转膜1 h,然后进行转膜和封闭,在一抗中孵育过夜,一抗孵育浓度分别为:HO-1(1 ∶5 000)、Nrf2(1 ∶5 000))、Keap1(1 ∶1 000)、GAPDH(1 ∶ 2000)。最后,二抗(稀释比1 ∶4 000)孵育2 h后进行化学发光显影。采用ImageJ软件标定蛋白条带的灰度值,以GAPDH为内参,得到目的蛋白的相对表达值;本实验数据相对表达值均以正常组为标准做归一化处理。
2.7 实时定量逆转录聚合酶链式反应(qRT-PCR)检测Keap1、Nrf2和HO-1的mRNA表达用TRIzol试剂裂解卵巢组织,在4 ℃离心后,获得总RNA。定量后根据试剂盒说明书进行逆转录,最后根据SYBR试剂盒的反应条件在Quant Studio3 PCR仪上扩增。根据CT值计算2-ΔΔCT,并以GAPDH为参照,对各组的表达进行归一化处理,计算相对表达。PCR引物为Keap1:上游5′-TGCCCCTGTGGTCAAAGTG-3′,下游5′-GGTTCGGTTACCGTCCTGC-3′;Nrf2:上游5′-TCTTGGAGTAAGTCGAGAAGTGT-3′,下游5′-GTTGAAACTGAGCGAAAAAGGC-3′;HO-1:上游5′-AAGCCGAGAATGCTGAGTTCA-3′,下游5′-GCCGTGTAGATATGGTACAAGGA-3′;内参GAPDH:上游5′-AGGTCGGTGTGAACGGATTTG-3′,下游5′-GGGGTCGTTGATGGCAACA-3′。
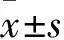
3 结果
3.1 EEA对PCOS大鼠病理形态的影响阴道涂片结果显示(Fig2),正常组大鼠表现为有规律的动情周期,依次为动情前期、动情期、动情后期和动情间期;而造模14 d后模型组大鼠基本处于动情间期(Tab1),提示动情周期出现紊乱。卵巢形态可以看出(Fig3),与正常组相比,模型组能明显观察到卵巢多囊样变;与模型组相比,治疗组多囊样变得到改善。HE染色结果显示(Fig4),与正常组比较,模型组大鼠卵巢组织中颗粒细胞层明显减少,囊状扩张明显,黄体数量明显减少;与模型组比较,二甲双胍组、EEA中、高剂量组囊状扩张得到改善,颗粒细胞层数明显增加,且黄体数目增加。为了确定EEA在改善PCOS的同时是否对其他器官有毒性,对EEA高剂量组的脑、心、肺、肝、脾和肾进行了HE染色。结果显示(Fig5)EEA高剂量组脑、心、肺、肝、脾和肾组织细胞结构清晰,无明显病理学变化,这证实EAA可改善PCOS,且对大鼠主要器官无明显毒副作用。
Tab1 Effect of EEA on letrozole-induced estrous cycle grading in PCOS rats(number)
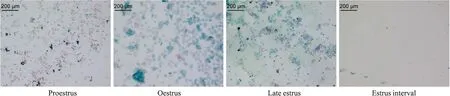
Fig2 Rat vaginal smear during estrous cycle(Pap staining, ×100)

Fig3 Morphology of rat ovaries
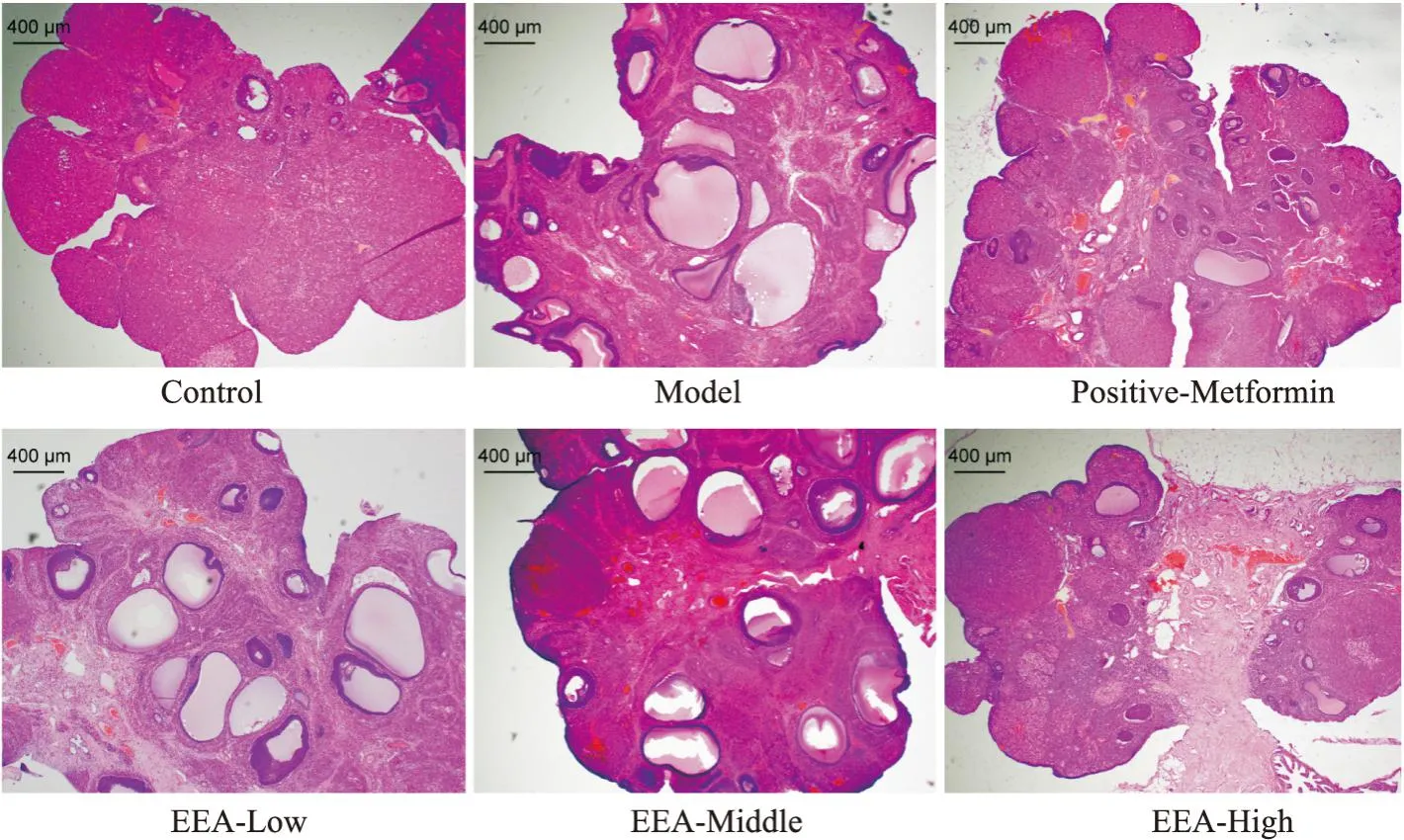
Fig4 Effect of EEA on ovarian pathology in PCOS rats induced by letrozole(HE staining, ×40)
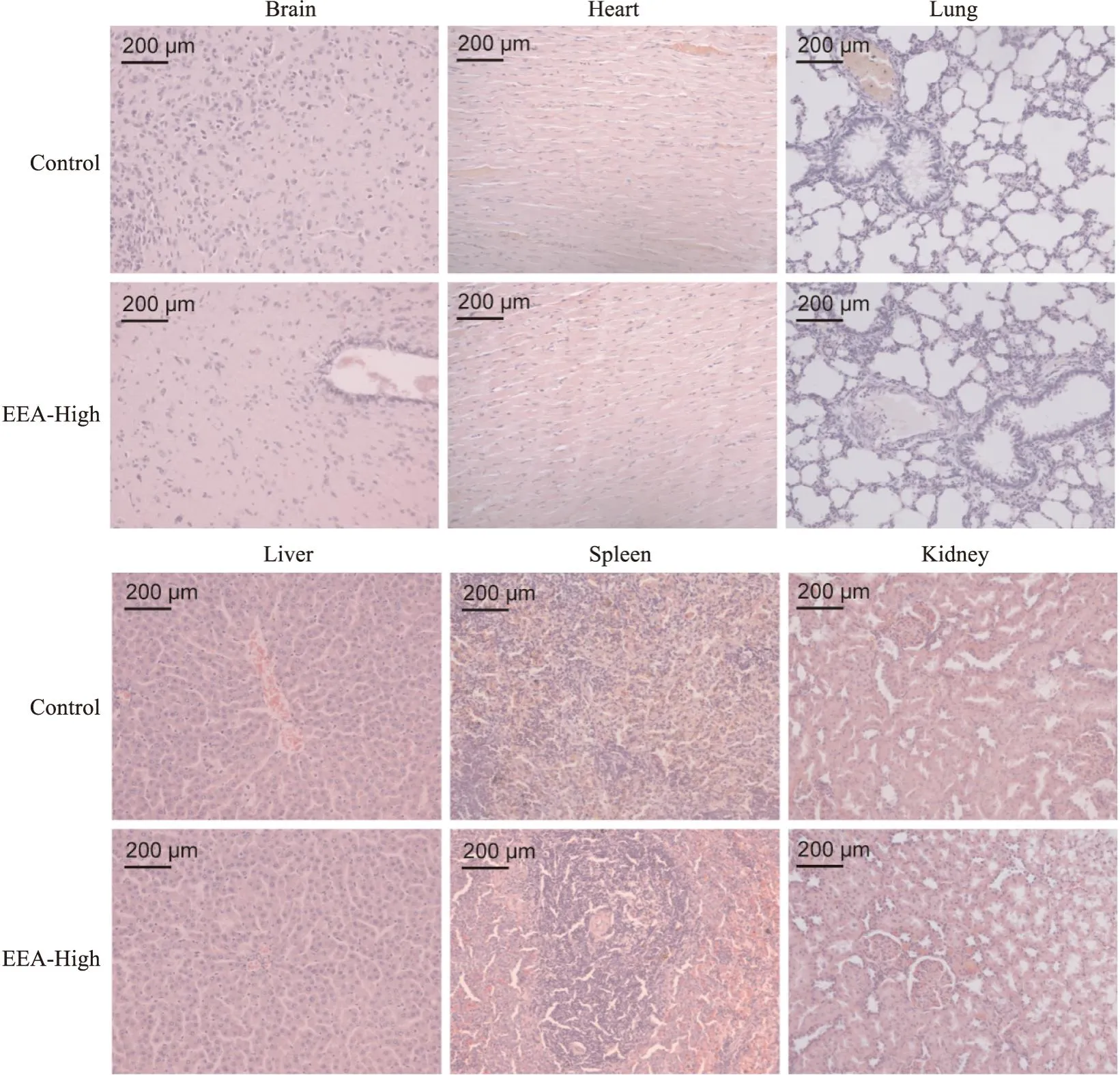
Fig5 Effect of EEA on pathology of important organs in PCOS rats(HE staining, × 100)
3.2 EEA对PCOS大鼠模型血清中T、FSH、LH和E2的影响与正常组相比,模型组血清中LH、LH/FSH和T含量升高,E2含量明显减少(P<0.05或P<0.01);与模型组相比,二甲双胍组、EEA中剂量组和EEA高剂量组大鼠血清中LH、LH/FSH和T含量下降,且E2含量明显增加(P<0.05或P<0.01)(Tab2)。
Tab2 Effect of EEA on levels of T, E2, LH, and FSH in serum of PCOS rat n=10)
3.3 EEA对PCOS大鼠血清中TG、TC、LDL-C、HDL-C含量的影响与正常组相比,模型组大鼠血清中TG、TC、LDL-C含量明显升高,而HDL-C含量明显降低;与模型组相比,二甲双胍组和EEA中、高剂量组大鼠血清中TG、TC、LDL-C含量明显降低,而HDL-C含量明显升高(P<0.01)(Tab3)。
Tab3 Effect of EEA on serum levels of TG, TC, LDL-C and HDL-C in PCOS n=10)
3.4 EEA对PCOS大鼠卵巢组织中SOD、GSH-Px、MDA活性或含量的影响与正常组相比,模型组大鼠卵巢组织中SOD、GSH-Px活性明显降低、MDA含量明显升高;与模型组相比,二甲双胍组和EEA中、高剂量组卵巢组织中SOD、GSH-Px活性明显升高,MDA含量明显降低(P<0.01)(Tab4)。
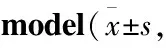
Tab4 Effect of EEA on SOD, GSH-Px activity, and MDA content in ovarian tissue of PCOS rat n=10)
3.5 EEA对PCOS大鼠卵巢中Keap1、Nrf2和HO-1蛋白和mRNA表达的影响与正常组相比,模型组大鼠卵巢组织中Keap1蛋白和mRNA表达明显上调,而Nrf2和HO-1 蛋白和mRNA表达明显下调(P<0.01);与模型组比较,二甲双胍组、EEA中剂量组和EEA高剂量组中Keap1蛋白和mRNA表达明显下调,而Nrf2和HO-1蛋白和mRNA表达明显上调(P<0.01)(Fig6,Tab5和Tab6)。
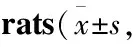
Tab5 Effect of EEA on expression of Keap1, Nrf2, and HO-1 proteins in ovarian tissue of PCOS n=3)
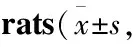
Tab6 Effect of EEA on mRNA expression of Keap1, Nrf2, and HO-1 in ovarian tissue of PCOS n=3)

Fig6 Effect of EEA on expression of Keap1, Nrf2, and HO-1 proteins in ovarian tissue of PCOS rats
4 讨论
PCOS的发生率约为10%,是导致排卵异常的最常见原因,且通常伴有胰岛素抵抗,并与糖尿病和卵巢癌症等疾病的高风险相关。PCOS对育龄妇女的身心健康有严重影响,青少年PCOS患者更易出现抑郁和焦虑[10]。然而,PCOS病因复杂,其潜在机制尚不明确,目前尚无根治PCOS的特效药物。
来曲唑通过抑制芳香化酶的活性,阻断雄激素向雌激素的转化,导致体内雄激素,特别是卵巢内雄激素水平升高,高浓度的雄激素影响卵巢功能,引起排卵障碍和卵巢多囊症的发生[11]。T通过影响卵泡内颗粒细胞的分化和功能发挥,如类固醇分泌等,从而干扰卵泡发育的正常过程,可能导致卵泡异常或发育不全[12]。本研究中,在来曲唑联合高脂饮食诱导的大鼠中观察到模型组大鼠动情周期紊乱,T、LH和LH/FSH明显增加,E2含量明显降低,而TG、TC、LDL-C含量明显升高,HDL-C含量明显降低,这与同类研究相一致[13],说明建模成功。活性氧的平衡在女性生殖系统的几个过程中发挥着重要的生理作用,包括卵子成熟、排卵和受精等[14]。各种研究表明,氧化应激是影响PCOS患者的另一个系统性问题[15]。当机体内的氧化还原平衡被破坏时,活性氧产生增多,导致SOD和GSH-Px活性下降,无法及时清除产生的活性氧,MDA水平升高累积,高浓度的MDA对组织细胞产生毒性伤害,从而影响机体的正常功能[16]。本实验研究结果显示,经过EEA治疗后,PCOS大鼠动情周期恢复正常,肉眼也可治疗组大鼠多囊样变减轻,显微镜下观察发现卵巢组织颗粒细胞层数增多,卵泡囊状扩张明显好转;T、LH和LH/FSH水平降低,E2含量明显升高,TG、TC、LDL-C含量明显降低,HDL-C含量明显升高,SOD、GSH-Px的活性明显升高,MDA含量明显降低。因此,我们推测EEA缓解大鼠PCOS的作用可能与调节血脂和抑制氧化应激有关。
目前研究表明,机体对抗氧化应激的保护机制主要来源于两方面:一方面是抗氧化酶可以清除活性氧;另一方面是Nrf2/HO-1抗氧化信号通路的激活,它可以增强细胞自身抗氧化能力来抵御氧化损伤,这两种途径共同构成了机体抵御氧化应激的主要保护机制[17]。在正常生理条件下,Nrf2与Keap1结合;当细胞受到氧化应激刺激时,Nrf2被激活,从Keap1分离,从细胞质转移到细胞核,并诱导HO-1的表达,激活HO-1可以增强细胞自身的抗氧化能力,清除活性氧,从而发挥抑制氧化应激的积极作用[18]。本研究Western bolt和qRT-PCR结果表明,与正常组相比,模型组大鼠卵巢组织中Keap1蛋白和mRNA表达明显上调,而Nrf2和HO-1蛋白和mRNA表达明显下调;在经过EEA治疗后,PCOS大鼠卵巢组织中Keap1蛋白和mRNA表达明显下调,而Nrf2和HO-1蛋白和mRNA表达明显上调。这表明EEA可以发挥抗氧化应激的保护作用,从而缓解PCOS大鼠卵巢组织损伤。
综上,EEA能够有效缓解大鼠PCOS,抑制卵巢组织氧化应激,其作用机制可能与Keap1/Nrf2/HO-1信号通路有关(Fig7)。本研究可为EEA的临床应用提供新思路。

Fig7 EEA improved PCOS through Keap1/Nrf2/HO-1 signaling pathway
