眼镜蛇神经毒素分离纯化及其经大鼠直肠给药吸收的实验研究
2024-04-23张学荣孔露平胡少聪肖曼琪张子彦罗小玲
张 昊,廖 明,张学荣,周 怡,孔露平,胡少聪,肖曼琪,张子彦,罗小玲,3
(广西医科大学1.基础医学院、2.生命科学研究院, 3.广西医科大学附属肿瘤医院实验研究部,广西 南宁 530021)
神经毒素是眼镜蛇属蛇毒的主要致死成分,是一种分子量约为7 ku的碱性小分子多肽。神经毒素的肽链结构包含15~18种氨基酸类别和60~74个氨基酸数量[1]。眼镜蛇神经毒素是一种从眼镜蛇蛇毒中分离出来的短链肽,具有中枢镇痛作用,该神经毒素在镇痛方面有着高效性、无耐受性、无成瘾性、不良反应少等特点[2]。
经口给药是最常见的给药方式,对口服药物,需要考虑在胃肠道恶劣的消化环境中,保证药物的稳定性和利用率[3]。将药物递送到作用靶点以及提高药物的利用率,一直是口服药物待解决的重要难题。选择直肠给药的方式可以避免胃肠道的破坏和肝脏的首过效应,药物通过直肠黏膜快速吸收达到一定血药浓度,从而发挥药理作用。避免了口服给药、静脉注射等方式带来的不良反应[4]。对部分肝脏毒性较强、刺激性较强的药物是一种安全可替代给药途径。同时,由于直肠内具有没有消化液并且药物可以长期存留的特点,特殊制作的栓剂或者凝胶系统可以显著提高部分药物的溶解度和生物利用度[5]。
1 材料与方法
1.1 实验动物健康KM小鼠,雌雄各半,清洁级,18~22 g;健康SD大鼠,雌雄各半,清洁级,180~220 g。均购自广西医科大学实验动物中心,生产许可证号为SCXK(桂)2020-0003,使用许可证号为SCXK(桂)2020-0004,伦理审查编号为202112062。动物实验遵循动物伦理原则。
1.2 材料眼镜蛇蛇毒冻干粉(广西医科大学蛇毒研究所,粗毒LD100为 0.7 mg·kg-1,干毒含水量<5%,非水溶物含量<0.8%);CM Sephadex Fast Flow色谱柱(美国Pharmacia Biotech公司,17-0719-01);Sephadex G-50色谱柱(美国Pharmacia Biotech公司,17-0043-01);磷酸二氢钠(天津市大茂化学试剂厂,3494);磷酸氢二钠(天津市大茂化学试剂厂,3497);氯化钠(成都市科龙化工试剂厂,7647-14-5);Tris-Tricine-SDS-PAGE凝胶制备试剂盒(北京索莱宝科技有限公司,P1320);考马斯亮蓝R-250(北京索莱宝科技有限公司,6104-59-2);马抗眼镜蛇毒血清(赛伦生物公司);HRP标记山羊抗马IgG(武汉三鹰生物公司,5A00001-13)
1.3 主要仪器KTATMstart层析系统(美国GE公司);LGJ-18冷冻干燥机(北京松源华兴科技发展公司);GS-800凝胶扫描仪器(美国BIO-RAD公司);Mini-PROTEAN Tetra电泳仪(美国 BIO-RAD公司);JB-P5包埋机(武汉俊杰电子有限公司);RM2016病理切片机(上海徕卡仪器有限公司)
1.4 方法
1.4.1眼镜蛇神经毒素分离纯化及纯度鉴定 (1)称取2.0 g眼镜蛇蛇毒冻干粉,取10 mL浓度为0.05 mol·L-1(pH 6.8)的PB缓冲液溶解,4 ℃过夜;第二天,用低温离心机10 000 r·min-1离心10 min后,取上清液经0.45 μm滤器过滤至新离心管。(2)收集到的上清液采用KTATMstart层析系统,首先进行CM Sepharose Fast Flow阳离子交换层析。用0.05 mol·L-1的PB缓冲液平衡后,再用0~0.5 mol·L-1的含NaCl的PB缓冲液进行阶段性梯度洗脱,流速1 mL·min-1,平衡液不收集,收集洗脱液,10 mL每一管。收集最高致死峰进行透析脱盐、冻干浓缩处理,用于下一步分离纯化。(3)选择最高致死峰进行Sephadex G-50 凝胶过滤色谱。冻干粉取5 mL浓度为0.05 mol·L-1(pH 6.8)的PB缓冲液溶解,预处理过程同上。采用KTATMstart色谱系统,全程使用0.05 mol·L-1的PB缓冲液进行平衡,流速2 mL·min-1,收集平衡液,10 mL每一管。收集最高致死峰进行透析脱盐、冻干浓缩处理,用于下一步SDS-PAGE电泳纯鉴定及后续实验。(4)取Sephadex G-50 凝胶过滤色谱后的最高致死峰进行Tris-SDS-PAGE凝胶电泳。取15 μL浓度为5 g·L-1的样品与15 μL的Tris-Tricine-SDS-PAGE上样缓冲液(2×)混合。采用15.5%分离胶、10%夹层胶、4%浓缩胶进行电泳。取20 μL混合物上样到样品槽内,标准蛋白使用预染超低分子量蛋白质Marker。浓缩胶电压30 V,夹层胶与分离胶电压100 V。(5)电泳完成后,使用考马斯亮蓝R-250进行染色,脱色后,使用凝胶扫描仪器进行成像。
1.4.2眼镜蛇神经毒素蛋白含量测定 使用BCA法测定蛋白峰浓度。根据样品数量配置足量BCA 工作液后,配置0.5 g·L-1的标准蛋白。将标准品按要求稀释成不同浓度,分别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5 g·L-1。将样品和标准品加入到96孔板中,各孔再加入 200 μL配置好的 BCA 工作液,37 ℃ 放置20~30 min,用酶标仪测定562 nm的吸光度。根据标准曲线计算出样品的蛋白浓度。
1.4.3眼镜蛇神经毒素小鼠腹腔注射全数致死量(LD100)测定[6]预实验通过少量小鼠确定最小全死量(Dm) 和最大全不死量(Dn)。确定神经毒素的全数致死量(LD100)在 100 μg·kg-1~500μg·kg-1此范围内,再按等差值设置各剂量组进行正式实验。将60只KM小鼠随机分为6组,每组10只,分别给小鼠腹腔注射眼镜蛇神经毒素100、200、300、400、500 μg·kg-1及生理盐水,注射体积为0.2 mL,注射完成后观察小鼠生命体征和死亡情况,确定小鼠腹腔注射LD100。观察24 h内小鼠所产生的行为反应及死亡情况,并将死亡的小鼠进行解剖观察内部脏器变化。
1.4.4眼镜蛇神经毒素大鼠直肠灌注给药急性毒性测定[7]由于并未有文献报道神经毒素直肠给药的安全剂量,参照部分参考文献的口服安全剂量进行相应实验。此剂量约为腹腔注射剂量的 100 倍。确定后续实验大鼠直肠给药的安全剂量。将60只SD大鼠随机分为6组,每组10只,分别给直肠灌注10、20、30、40 和50 mg·kg-1眼镜蛇神经毒素及生理盐水,灌注体积为2 mL。直肠灌注后观察大鼠的生命体征和死亡情况,检测大鼠直肠灌注眼镜蛇神经毒素急性毒性。
1.4.5眼镜蛇神经毒素大鼠直肠灌注实验分组和给药 探究眼镜蛇神经毒素能否通过直肠给药途径进入大鼠血液,使用SD大鼠进行直肠给药实验。将大鼠分为对照组和3 h实验组两组,每组2只大鼠。3 h实验组在0 h时给药眼镜蛇神经毒素,对照组在0 h给药相同体积的生理盐水。给药方式为直肠灌注给药。直肠灌注前禁食不禁水24 h,且在正式实验前用少量生理盐水润洗肠道,将大鼠肠道内的粪便排清。将大鼠头部固定,尾部抬高约与桌面形成60度角的高度,保持尾高头低的姿势,用灌胃针深入大鼠直肠约5 cm进行直肠灌注。灌注完成以后用小型橡胶塞堵住直肠口,并且保持头低尾高约15 min。根据上述直肠灌注给药急性毒性测定的最大安全剂量给药。以50 mg·kg-1大鼠体质量的剂量直肠给药上述提取的眼镜蛇神经毒素,给药体积为2 mL。
1.4.6大鼠直肠组织取材及石蜡组织切片的制作 给药完成3 h后将两组大鼠进行麻醉。分别解剖取材对照组和3 h实验组大鼠直肠,用生理盐水冲洗3~4次实验组肠道内外,去除肠道内容物及可能残留的眼镜蛇神经毒素。用眼科剪取3 cm长的直肠组织,用滤纸吸干组织表面液体,放入多聚甲醛中浸泡。直肠组织在多聚甲醛中浸泡48 h后,进行组织包埋。先将直肠组织采用梯度乙醇浸泡脱水,乙醇浓度依次为:50%、70%、80%、95% Ⅰ、95% Ⅱ、无水乙醇Ⅰ、无水乙醇Ⅱ。每种浓度浸泡时间:30 min,其中在95%乙醇中浸泡12 h以上。然后直肠组织依次浸泡于二甲苯Ⅰ、Ⅱ、Ⅲ中透明,每种溶剂中浸泡10 min。直肠组织浸蜡后,用石蜡包埋成组织蜡块。用切片机将组织蜡块切成厚度为5 μm的组织横向切片。
1.4.7利用免疫组化技术观察神经毒素在大鼠直肠组织中的分布 组织切片采用免疫组织化学技术,通过化学标记法对肠道组织中的眼镜蛇神经毒素分布进行横向定位。对照组和3 h实验组采用同等实验条件,一抗选择马抗眼镜蛇毒血清、二抗选择HRP标记羊抗马IgG进行显色。实验完成后每组各选择一张切片进行镜下观察,观察各组直肠切片中眼镜蛇神经毒素在直肠黏膜中的分布。对于每个直肠样本,选择10个代表性视野,并计算每个视野相关评分。整个直肠样本的评分是这10个单个视野评分的算术平均值。将镜下200×视野使用Aipathwell软件进行自动分析,将阳性部分用黄色像素点表示。根据AI计算出各项评分,从阳性面积比率、平均光密度值、H-SCORE值三项指标进行评价,使用统计软件分析比对对照组与3 h实验组免疫组织化学镜下结果的差异性。
1.4.8Shotgun质谱技术检测大鼠血浆中神经毒素 将神经毒素直肠给药3 h后的实验组大鼠进行腹主动脉取血,离心分离血浆。SDT法裂解蛋白质后,BCA法对蛋白质进行定量。使用胰蛋白酶将蛋白质酶解成为肽段,采用C18Cartridge对肽段进行脱盐,脱盐后将样本冻干,再使用40 μL 0.1%甲酸溶液复溶。复溶后,样品进行LC-MS/MS分析,采用HPLC液相系统进行分离。缓冲液A液为0.1%甲酸水溶液,B液为0.1%甲酸乙腈水溶液(乙腈为84%)。先用95%的A液平衡色谱柱,再经过分析柱分离样品。经过分离柱后的样品,通过高分辨率质谱仪进行质谱分析,检测方式为正离子。质谱分析原始数据为RAW文件,采用软件(Maxquant)进行查库鉴定及定量分析。搜索蛋白质数据库相关参数设置见Tab1。

Tab1 (Maxquant) Parameter settings for checking library identification
1.4.9HE染色观察神经毒素对大鼠直肠的组织结构影响 同上述条件,完成直肠取材后,制作直肠石蜡组织切片。切片使用HE染液进行染色。在显微镜下浏览组织切片情况,对切片中基本病理改变如充血、淤血、出血、水肿、变性、坏死、增生、纤维化、机化、肉芽组织、炎性变化等情况进行观察,观察神经毒素对大鼠直肠的组织结构变化。
1.4.10醋酸扭体法测定眼镜蛇神经毒素经直肠给药镇痛活性 将50只小鼠随机分为5组,每组10只,分别为NS对照组(生理盐水)、直肠低剂量组(10 mg·kg-1神经毒素)、直肠中剂量组(30 mg·kg-1神经毒素)、直肠高剂量组(50 mg·kg-1神经毒素)、腹腔注射组(0.1 mg·kg-1神经毒素)。给药体积为0.2 mL。环境温度为25 ℃。给药后3 h测量疼痛阈值。醋酸扭体法测定镇痛活性,小鼠腹腔注射0.01 mL·g-10.6%的醋酸溶液,记录醋酸注射后15 min内的扭体次数,并计算各组对扭体反应的抑制率。抑制率=(阴性对照组扭体次数-实验组扭体次数)/阴性对照组扭体次数×100%。
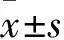
2 结果
2.1 眼镜蛇毒分离纯化色谱结果及蛋白浓度测定结果如Fig1,眼镜蛇粗毒经CM Sepharose Fast Flow阳离子交换色谱后得到6个洗脱峰。取Ⅲ峰进行第二步分离纯化。经过Sephadex G-50 凝胶过滤色谱后获得单一主峰Ⅲa峰,如Fig2所示。此峰收集的蛇毒蛋白致死能力最强,浓度为5 g·L-1。
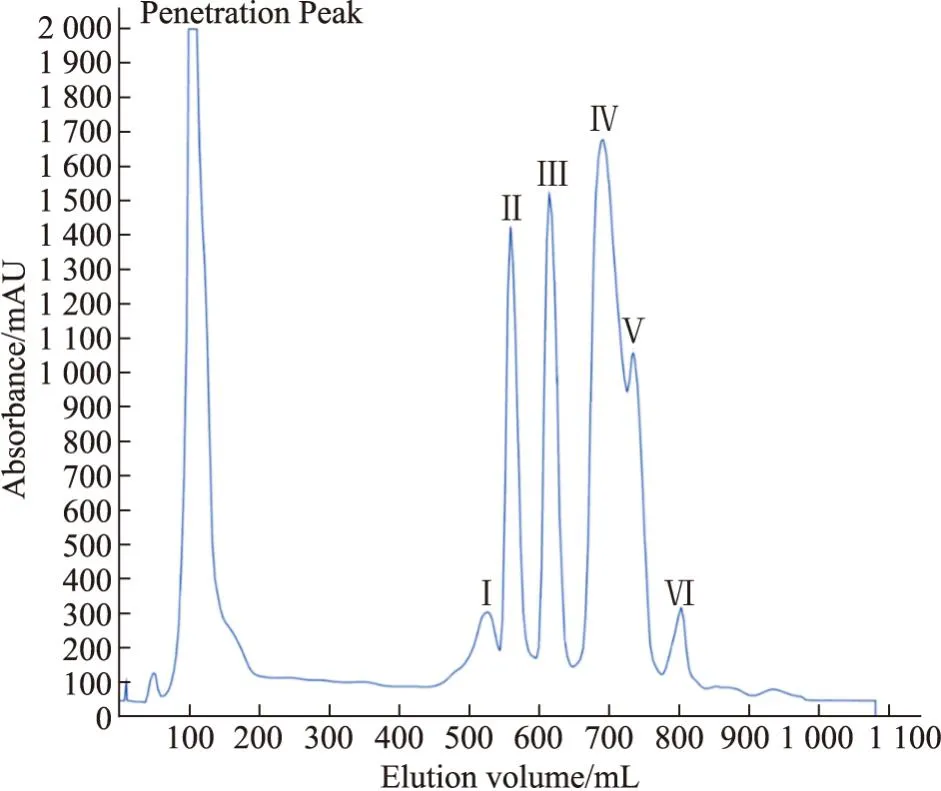
Fig1 CM Sepharose Fast Flow cation exchange chromatograms
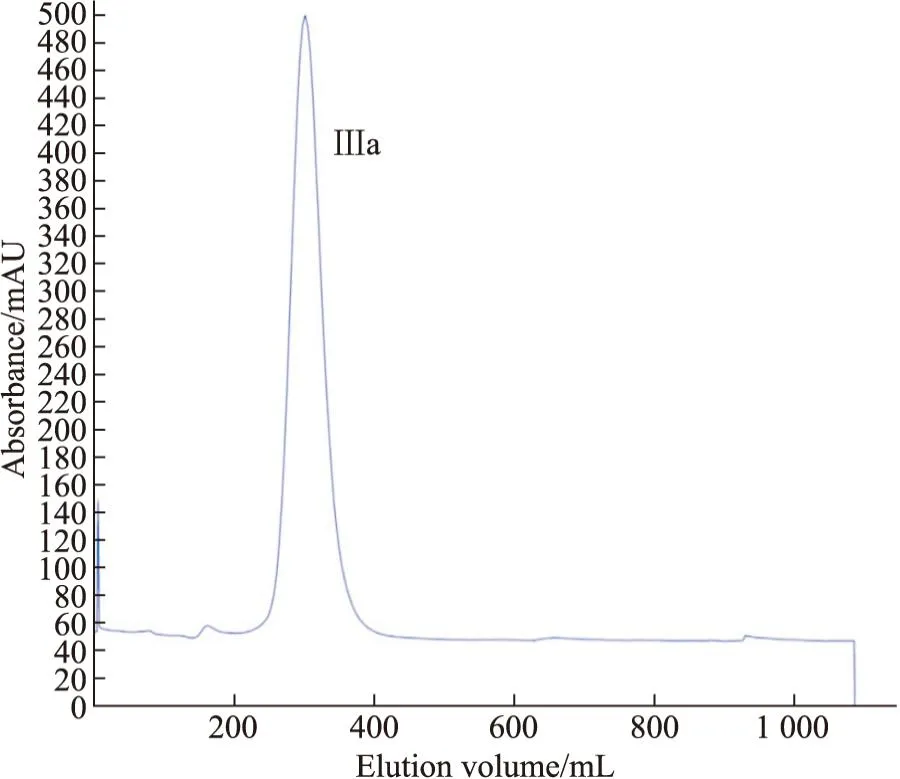
Fig2 Sephadex G-50 gel filtration chromatograms
2.2 Tris-SDS-PAGE凝胶电泳神经毒素纯度鉴定取Sephadex G-50 凝胶过滤色谱后的Ⅲa峰进行Tris-SDS-PAGE凝胶电泳,显示如Fig3所示为单一条带,神经毒素达到电泳纯,分子量在7 ku左右。
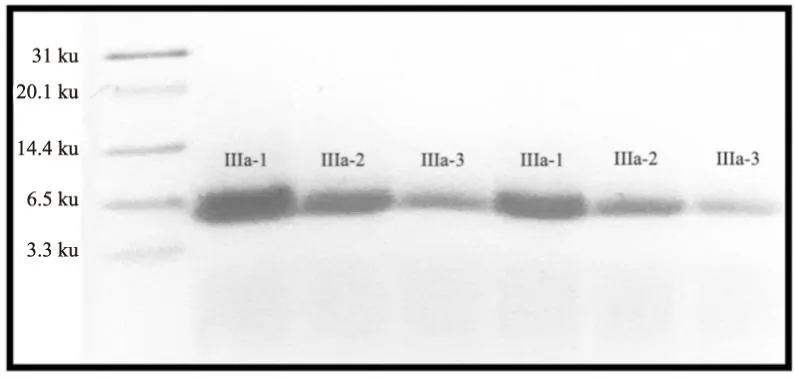
Fig3 Tris-SDS-PAGE gel electrophoresis results of neurotoxin electrophoresis(Ⅲa-1, 75 μg of protein; Ⅲa-2, Ⅲa-3, sequential doubling dilution of 1/2 concentration)
2.3 眼镜蛇神经毒素小鼠腹腔注射LD100检测结果腹腔注射神经毒素中毒症状表现为行动安静迟缓,逐渐发展至全身肌张力降低,俯卧于笼中、腹部贴地,呼吸急促并伴随有深度腹式呼吸,惊跳翻正反射消失等,最终表现为中毒死亡。部分动物死亡时眼球明显外凸,经组织解剖,心、肝、脾、肺、肾、脑等脏器未出现明显异常改变。不同剂量的死亡情况见Tab2,当腹腔注射剂量达到400 μg·kg-1时,24 h内小鼠达到全数致死。
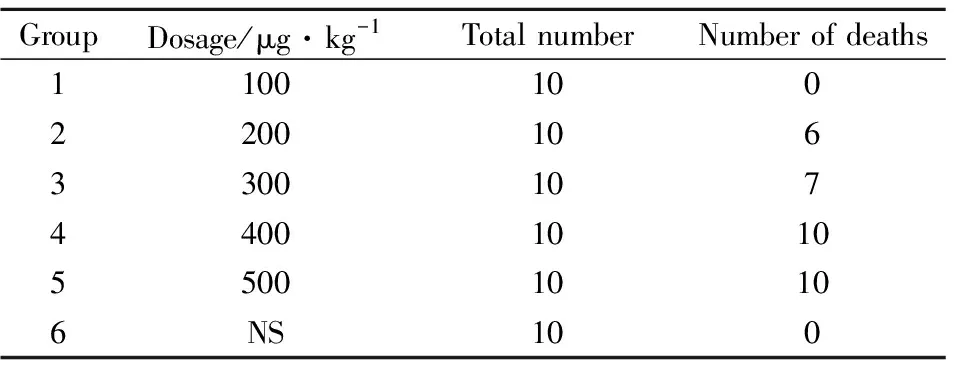
Tab2 Deaths of cobra neurotoxin mice injected intraperitoneally
2.4 眼镜蛇神经毒素大鼠直肠灌注给药急性毒性测定结果给大鼠直肠灌注不同剂量的眼镜蛇神经毒素后,大鼠呼吸频率正常、饮食正常、无异常呼吸音、生命体征良好,未出现明显中毒症状。由Tab3可知,直肠给药大剂量的眼镜蛇神经毒素毒性较低,均未出现大鼠死亡。50 mg·kg-1直肠给药仍然是安全剂量。

Tab3 Death by rectal instillation in cobra neurotoxin rats
2.5 眼镜蛇神经毒素在大鼠直肠组织中的分布对照组和3 h实验组同步实验,取对照组和3 h实验组每一组中的一张石蜡切片,在显微镜下观察。相比于对照组,3 h实验组的大鼠直肠显示眼镜蛇神经毒素在直肠组织黏膜层大量分布,并且深入黏膜下层。此部分组织内含有大量杯状细胞、血管、淋巴管。提示眼镜蛇神经毒素通过直肠进入到了体内,结果如Fig4所示。

Fig4 Distribution of cobra neurotoxin in rectal tissue (yellow markers are positive markers measured by computer) ×200
2.6 眼镜蛇神经毒素在两组大鼠直肠镜下视野差异性分析采用阳性面积比率、平均光密度值、H-SCORE评分指标,半定量分析标本。通过随取获取标本200×的放大倍数下10个视野均值作为此标本的评分指数。累计不同视野下不同等级阳性像素面积、累计光密度值、组织像素面积,从而计算出阳性面积比率、平均光密度值、H-SCORE,对照组和3 h实验组的抗原位点分布有着明显的统计学差异,详见Tab4。

Tab4 Analysis of variance of results of 10 randomized visual field scores in control group and 3 h experimental
2.7 Shotgun质谱技术检测大鼠血浆神经毒素剔除大鼠血浆原有蛋白质,质谱的Besepeak图谱如Fig5所示,为不同时间点不同肽段产生不同的信号强度,与眼镜蛇蛋白数据库进行匹配,鉴定到的蛋白质和多肽汇总见Tab5,6。质谱结果显示,3 h实验组血液中共筛选到7种眼镜蛇毒有关蛋白,15种眼镜蛇毒有关多肽片段。其中包括Cobra venom factor和Zinc finger protein的片段,此片段与神经毒素片段有高度相关性。提示神经毒素能够以直肠给药的方式进入大鼠血液中。
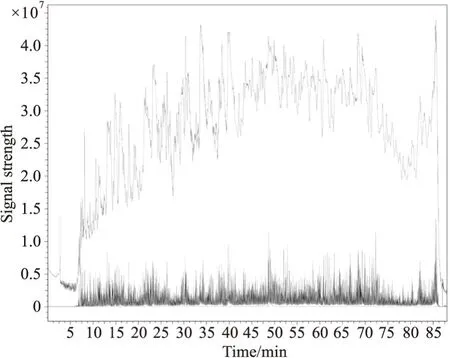
Fig5 Rat plasma Basepeak plot

Tab5 Cobra proteins detected by mass spectrometry in rat plasma

Tab6 Cobra peptide fragments detected by mass spectrometry in rat plasma
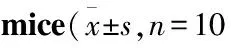
Tab7 Calculation of number of acetic acid torsion and inhibition rate in different groups of )
2.8 神经毒素对大鼠直肠组织结构的影响HE染色结果显示,相比于对照组,大鼠直肠给药神经毒素后,直肠组织各层结构清晰,黏膜上皮完整,固有层肠腺数量丰富,排列紧密,间质偶见少量炎性细胞,肌层肌纤维排列规则,未见其它明显异常。对照组和3 h实验组没有明显差异,结果如Fig6。说明眼镜蛇神经毒素对大鼠直肠组织不会产生损伤,组织结构无明显病理变化。

Fig6 Pathological and histological characteristics of rat rectum ×20.0
2.9 眼镜蛇神经毒素经直肠给药后镇痛活性测定在醋酸扭体实验当中,直肠给药眼镜蛇神经毒素3 h后能够起到降低醋酸引起的化学疼痛作用,与对照组相比,高剂量组和中剂量组镇痛作用明显,差异有统计学意义。低剂量组没有明显的镇痛效果(P>0.05)。直肠给药组的镇痛效果稍差于腹腔注射组。直肠给药组小鼠醋酸扭体抑制率达50%。说明眼镜蛇神经毒素通过直肠途径给药发挥了镇痛作用。
3 讨论
本实验通过阳离子交换和凝胶过滤两步法提取了纯度较高的眼镜蛇神经毒素。通过直肠灌注方式给药,对药物吸收的直肠黏膜部位进行免疫组化,同时进行血浆质谱蛋白质检测和小鼠镇痛活性测定,是证明神经毒素从直肠黏膜吸收并且入血继而发挥全身镇痛作用的动态定性验证过程。本研究提纯的神经毒素具有阻断神经肌肉传导的作用,这是发挥镇痛作用的基础,且分子量与Liang等[8]的结果相符合。由于有研究证实眼镜蛇毒成分中具有镇痛物质,本文选择眼镜蛇毒中起镇痛主要作用的神经毒素作为研究对象。提纯后的单一成分相较于复杂的眼镜蛇粗毒混合物具有更稳定更有效的镇痛效果。
疼痛是一种应激反应,也是由身体损伤或疾病引起的症状。与细胞中的信号分子密切相关,这些分子包括激素、细胞因子、神经递质、淋巴因子、生长因子和趋化因子,它们可以改变细胞中的离子,从而引起疼痛。非甾体抗炎药(NSAIDs)或吗啡类止痛药被广泛用作抗炎药物。但非甾体抗炎药可能会造成胃肠道损伤,吗啡类药物有成瘾性、耐受性等不良并发症和副作用[9]。镇痛研究的重点是寻找无耐受性、无依赖性和无副作用的天然药物[10]。本研究证实眼镜蛇神经毒素直肠灌注方式能够发挥镇痛作用,且高剂量组和中剂量组镇痛作用明显,有别于其他已经报道的通过静脉或者腹腔注射眼镜蛇毒素的方式发挥镇痛作用。如部分文献报道的:静脉注射LD50为1.987 5 mg·kg-1的眼镜蛇毒液中的新型小分子肽,可提高小鼠的疼痛阈值;腹腔注射0.2 mg·kg-1的NTXI可以将小鼠在热板上的痛阈值从100%提高到184.35%,镇痛作用起效缓慢,在治疗后2 h开始,4 h后达到最大效果,且无耐受性、无依赖性[11]。相较于以上给药方式,直肠给药方式起镇痛作用起效时间没有较大差别,发挥镇痛作用的时间相差不大,3 h后便能起到镇痛作用,能够达到和注射相近的镇痛效果。同时,对直肠给药以后的肠道黏膜进行了病理分析,确定该药物对直肠组织不会产生明显损伤。
如今研究较多关于药物发挥吸收作用的方式,其中最常见方式有口服给药、静脉注射给药、腹腔注射给药、皮下注射给药等。直肠的环境相对稳定,酶活性较低,有利于解决一些药物口服吸收差、首过代谢效应广泛、对胃有刺激、在胃环境中稳定性不好等问题。直肠给药有相较于其他给药方式的优势。国内外临床批准了许多用于局部吸收和全身吸收的直肠制剂,其中包括布洛芬、水合氯醛、咖啡因、对乙酰氨基酚等一些常见的镇痛剂[12]。同时,直肠给药系统中,如何提高药物的生物利用度也是一项需要解决的问题。某些药物,需要通过加入适当的吸收促进剂来达到有效血药浓度,现代制药和新型直肠药物输送系统(RDDS) 的帮助下,让药物提高生物利用度和控制释放成为可能[13]。神经毒素本身是一种分子量较小的多肽,为三指毒素能够从直肠黏膜渗透到体内提供的可能。直肠给药副作用小,起效快。对小孩、老年或昏迷患者这些特殊人群,选择直肠给药可以降低治疗风险,降低操作难度[14]。具体直肠给药方式的选择也是一项值得讨论的问题,常见的直肠给药有灌肠和栓剂两种方式,本文选择的是灌肠的方式给药。有关于其他镇痛药如布洛芬的药代动力学比较研究,认为灌肠方式的药物吸收量大,吸收速度快,相比于直肠栓剂能更快的发挥镇痛和解热作用[15]。
眼镜蛇神经毒素为一种小分子量多肽,分子量小,进入血液循环以后分散成为多种片段,本文质谱检测到的Cobra venom factor为神经毒素有关片段,也是眼镜蛇毒液中的重要成分,具有神经毒性。具有镇痛[16]、抗炎、抗肿瘤[17]等作用。本实验进行大鼠血浆蛋白质组学分析用到的是Shotgun质谱检测技术,它是一种高通量的蛋白质分析方法,也称为蛋白质组学中的无序分析。该技术通过将蛋白质样品消化成小片段,然后利用质谱仪进行分析,以确定它们的氨基酸序列和相对丰度[18]。这种方法得以在单次实验中同时鉴定和定量数千个蛋白质。通过此方法,更加精确有效的寻找到了大鼠血浆中的蛇毒片段。但本研究存在的局限性是无法确定直肠给药制剂发挥镇痛效果的量效关系,只能确定目标蛋白质在血液当中的相对丰度,无法做到定量检测具体进入体内药物浓度的大小,此次检测为定性检测血液中是否存在蛇毒成分。后续进一步可通过质谱结合标记技术定量化检测进入血液的蛇毒含量,探索发挥有效药理作用的药物浓度,并且比较不同时间点不同给药方式的镇痛效果,会更加拥有实际价值。
综上所述,眼镜蛇神经毒素作为一种生物毒素具有很大的临床药物开发价值,通过直肠方式灌注给药眼镜蛇神经毒素能够通过此途径入血并且发挥镇痛作用。后续神经毒素若能够与相应促进药物吸收的促进剂结合,其吸收效果可能会更加明显。此研究为后续研究神经毒素直肠给药新制剂提供实验依据,为临床镇痛药物开发提供方向。
