硝化应激在肺动脉高压中的研究进展
2024-04-23芦殿香
冀 磊,杨 进,芦殿香
(1.青海省人民医院,青海 西宁 810007;2.成都大学附属医院,四川 成都 610081)
肺动脉高压(pulmonary hypertension,PH)是一种以血管过度收缩和闭塞重构为特征的破坏性疾病,最终因右心衰竭而过早死亡。构成肺血管的主要细胞成分如内皮细胞、平滑肌细胞、成纤维细胞和免疫细胞等多种细胞处在高血压环境中导致细胞行为发生改变,促进PH的发生发展。内皮细胞是与血液接触的第一层细胞,也是第一个暴露于任何氧气水平变化中的细胞。内皮依赖性的血管张力调节依赖于多种血管活性因子,包括一氧化氮(nitric oxide,NO)、前列环素和内皮源性超极化因子,而血管收缩因子主要是内皮素-1、血栓素和血管紧张素II。在这些物质中,NO是心血管功能、代谢、神经传递、免疫等的关键调节因子,而异常的NO信号是许多疾病的核心特征。NO既可以作为活性舒血管物质发挥抗动脉粥样硬化、抑制血管平滑肌细胞增殖、血小板聚集和白细胞黏附等多种功能,也可以参与活性氮(reactive nitrogen species,RNS)产生,而RNS的过量产生在PH的发生发展中起到重要作用[1]。
本文围绕RNS以及由此引发的硝化应激在PH中的作用进行综述,以期在PH中以靶向抗硝化治疗的临床应用提供参考依据。
1 RNS的种类
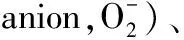

Tab1 Reactive nitrogen species
2 PH中RNS的来源
NO是一种快速扩散的气体,生理状态下主要由eNOS在肺血管内皮细胞中合成,一旦合成,NO能迅速扩散通过细胞膜,传递至血管平滑肌细胞,NO和血管平滑肌内可溶性鸟苷酸环化酶(soluble guanylyl cyclase,sGC)中的铁原子结合,使三磷酸鸟苷变为环磷酸鸟苷(cyclic guanosine monophosphate,cGMP),继而激活环磷酸鸟苷依赖蛋白激酶G(protein kinase G,PKG),使胞质Ca2+外流或回收至胞内钙储存库中,导致胞质内游离Ca2+下降,抑制钙调蛋白介导的肌球蛋白轻链磷酸化,抑制肌球蛋白与肌动蛋白的结合,从而使血管平滑肌舒张。NO作为肺循环中强有力的血管扩张剂,其合成减少可以导致肺血管收缩,进而促进PH的发生发展。
NO的作用主要取决于其浓度,低水平时刺激sGC,引起血管舒张,高水平时以硝化应激为主要途径,引起血管内皮广泛损伤。NO作为自由基参与硝化应激,其来源主要有以下几种途径。
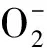

2.3 诱导型一氧化氮合酶和神经元型一氧化氮合酶的诱导表达生理状态下,除eNOS在肺血管内皮细胞中合成NO外,iNOS和nNOS也可以合成少量NO。但在病理状态下,如低氧诱导的PH,与常氧大鼠相比,低氧暴露增加了大鼠肺中iNOS基因和蛋白水平,抑制iNOS可减轻低氧诱导的大鼠PH[5],表明iNOS来源的NO在低氧诱导的PH中起到致病作用。另一项研究显示,低氧暴露后,大鼠肺中nNOS基因和蛋白表达水平也有类似的增加[6]。
2.4 饮食来源饮食是人类亚硝酸盐的主要来源,包括绿叶蔬菜的摄入以及食品添加剂和防腐剂。唾液腺将硝酸盐从血浆中浓缩并分泌到口腔,口腔中的共生细菌将硝酸盐还原为亚硝酸盐,进入胃肠道,进而被吸收到循环血中,或者在胃里被还原为NO。亚硝酸盐生成NO,包括酶促和非酶促两种反应。铜、抗坏血酸和多酚类物质可促进NO的非酶促生成,而含金属的蛋白质如碳酸酐酶、血红蛋白和肌红蛋白可促进NO酶促生成。然而,关于饮食中亚硝酸盐衍生的NO在硝化应激诱导的PH发病机制中的作用知之甚少。有研究表明[7],雾化吸入亚硝酸钠可以改善射血分数保留的肺动脉高压患者的肺血管顺应性,减轻肺血管阻力,缓解右心衰竭。
3 硝化应激对PH发生发展的影响
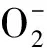
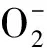
3.2 Cav-1作为硝化应激成员对PH发生发展的影响在敲除脯氨酸羟基化酶(Egl-9 family hypoxia inducible factor 1,Egln1)基因的小鼠肺血管病变中RNS和NT增多,提示存在显著的硝化应激,这是由于HIF-2α和eNOS的激活导致内皮细胞Cav-1缺陷,肺血管内皮功能障碍所致,在给予CRISPR-Cas9介导的eNOS敲低或转基因表达Cav-1干预后,可抑制硝化应激反应,改善闭塞性肺血管重塑,并减轻小鼠PH[1]。在低氧诱导的PH模型中也发现Cav-1基因和蛋白水平均降低,在给予抗氧化剂N-乙酰半胱氨酸干预后,可减轻低氧诱导PH大鼠右心室收缩压及肺血管重构[11]。可见,Cav-1作为eNOS的互作蛋白,Cav-1缺失可导致eNOS活性增加,由此生成的NO参与了硝化应激反应,促进了PH的发生发展。
3.3 eNOS作为硝化应激成员对PH发生发展的影响目前对于PH中肺内eNOS表达的结果存在不同的报道。这些eNOS在PH中表达的差异可能是由于使用了不同的研究模型和不同的实验方法以及疾病进展阶段不同,但不管何种原因,研究者普遍认为NO信号在PH中受损。PH时NO生物利用度和活性受损是由于eNOS辅因子可用性降低或eNOS解偶联导致的,而不是eNOS水平本身的降低[12]。eNOS、锌指结构、钙调蛋白以及各种辅因子共同构成了多聚体蛋白复合物,eNOS作为该蛋白复合物中的一员,不仅调节该复合物整体活性,还影响该复合物的完整性。eNOS衍生的NO除了作为血管扩张剂外,还可以促进血管生成。丛状病变是重度PH的一个标志,研究表明,在丛状病变中发现了高水平的eNOS,而eNOS来源的NO,已被证明在血管重构过程中发挥了促进血管生成的作用[13]。由此可见,eNOS辅因子的缺乏,导致eNOS解偶联,此时生成的NO作为RNS参与了硝化应激反应,进而导致PH的发生发展。
3.4 NO-cGMP-PKG异常作为硝化应激成员对PH发生发展的影响在PH动物模型,随着NO的减少,内皮依赖性的血管舒张功能受损,这并不是由于sGC表达减少导致的,因为在特发性PH(idiopathic pulmonary arterial hypertension,IPAH)患者及PH动物模型中sGC水平是升高的,在ROS和RNS升高的情况下,NO的受体sGC被氧化,使其对NO信号不敏感,从而降低了NO舒张血管的能力,sGC激动剂的应用可以有效改善PH[14]。5型磷酸二酯酶(phosphodiesterase type 5,PDE5)主要表达于血管平滑肌,可以降解cGMP,PDE5在PH中表达增加,靶向PDE5的药物,如西地那非在PH动物模型和PH患者中具有改善PH的作用[15],这也间接支持cGMP消耗增加导致NO依赖性血管舒张受损。cGMP可以激活PKG影响平滑肌细胞的功能。PKG基因缺失可以诱导PH的发生。

3.6 硝化应激影响PH发生发展的临床证据通过对PH患者中硝化应激标记物的观察性研究,或靶向硝化应激信号通路疗法对临床结果影响的研究,表明硝化应激在PH发病机制中起到了重要作用。酪氨酸硝化是硝化应激的标志物,通过对原发或者继发PH患者肺组织进行免疫组化染色,结果显示硝基酪氨酸明显升高,提示PH患者的肺部处于硝化应激状态[18]。eNOS作为NO的主要来源,在IPAH肺丛状病变中大量表达,也有研究表明,与健康对照者相比,eNOS蛋白水平在IPAH患者的肺中虽然没有显著变化,但活性显著增加,导致ONOO-生成增多,诱导肺血管内皮细胞和平滑肌细胞损伤[4]。这些研究均表明PH患者体内硝化应激增加,提示抗硝化治疗在临床上可能是有益的。
4 靶向RNS的治疗方法
目前靶向RNS在PH中的治疗方法主要有:增加NO含量、他汀类药物调节炎症和氧化酶活性、补充BH4、抗氧化剂清除ROS/RNS、NOX酶抑制剂减少ROS生成等几个方面,最终达到减少ROS/RNS,恢复NO和蛋白质正常功能,改善PH的目的。具体如下:
4.1 增加NO含量目前临床上治疗PH的药物主要是针对肺血管进行调控,如抑制血管收缩或促进血管扩张,主要包括前列环素类似物、内皮素受体拮抗剂、PDE5抑制剂和sGC抑制剂、钙通道阻滞剂[19],其中,只有PDE5抑制剂直接靶向NO信号通路。作为PDE5抑制剂,西地那非、他达拉非和伐地那非已批准用于PH患者的治疗。研究表明,上述药物可以改善动脉性PH(pulmonary arterial hypertension,PAH)患者6米步行时间、WHO功能分级,西地那非还可以改善中国PAH患者运动耐量及血流动力学,与传统治疗相比,西地那非可改善PAH患者1年、2年和3年的生存率[20]。
吸入NO早在1999年就被批准用于治疗新生儿持续PH,对于缓解成人PH也部分有效。然而,这种治疗并没有降低呼吸衰竭危重患儿的死亡率。此外,高达40%的婴儿对吸入的NO没有反应[21],原因可能是与吸入的NO从治疗作用转化成有害的活性氮有关,如形成NO2或ONOO-。
4.2 他汀类药物调节炎症和氧化酶活性他汀类药物在调节炎症和血管氧化酶活性方面具有广泛的作用,已被证明在动物模型中可以改善PH。他汀类药物可以通过抑制RAS同源基因家族成员A的激活,也可以通过上调eNOS的表达来改变血管张力。然而,在PH患者中使用他汀类药物的证据并不像在动物模型研究中那样有说服力,一项三盲、随机对照试验、结果显示,瑞舒伐他汀用于慢性阻塞性肺疾病合并PH有降低肺动脉收缩压趋势,但与对照组相比差异无统计学意义[22]。另一项研究表明,阿托伐他汀可有效降低慢性阻塞性肺疾病合并PH患者的肺动脉压力[23]。他汀类药物对于临床PH患者的有效性仍需要随机临床试验进行验证。
4.3 补充BH4BH4是eNOS的重要辅助因子。BH4由三磷酸鸟苷从头合成,以三磷酸鸟苷水解酶I作为该途径中的第一个限速酶,过表达三磷酸鸟苷水解酶的转基因小鼠对PH具有保护作用。在氧化应激条件下,BH4很容易被解偶联eNOS衍生的ONOO-氧化为BH2。由此导致的BH4减少是eNOS解偶联的主要原因,eNOS解偶联进一步导致硝化应激。补充BH4在PH动物模型和PH患者中取得了一定的成效,动物实验表明,降低细胞内BH4水平,可以减少内皮细胞和离体血管中NO的合成并增强超氧化物的生成,而给予BH4以剂量依赖性方式抑制超氧化物的生成。外源性补充BH4可以减少eNOS解偶联,提高NO生物活性,减少超氧化物生成[24],但其有益作用可能并不完全来自于eNOS功能的改善。
4.4 抗氧化剂清除ROS/RNS在PH实验动物模型中,已表明抗氧化剂可逆转PH的发生发展。在PH患者中也表明与氧化应激有关的关键氧化酶活性上调。尽管大量的实验证据表明,抗氧化剂对PH以及心肌肥厚向右心衰竭的转变具有保护作用,但PH患者是否应该接受药物和/或膳食抗氧化剂治疗尚无明确证据。抗氧化剂曾被考虑用于治疗与PH相关的疾病,如应用N-乙酰半胱氨酸治疗特发性肺纤维化,在泼尼松联合硫唑嘌呤的标准治疗基础上加用N-乙酰半胱氨酸可能有利于特发性肺纤维化的治疗。然而,另一项评估特发性肺纤维化反应的研究报告表明,联合使用泼尼松、硫唑嘌呤和N-乙酰半胱氨酸会增加患者死亡和住院的风险。抗氧化剂N-乙酰半胱氨酸治疗可减轻慢性缺氧诱导的大鼠PH[11]。锰卟啉作为另一种ROS/RNS清除剂,可减轻Cav-1缺陷小鼠的右心室收缩压和血管重构[1],然而,另一种抗氧化剂TEMPOL,在缺氧和SU5416/缺氧诱导的PH大鼠中具有减少右心室收缩压的作用,但对肺动脉重塑没有影响[25],因此,抗氧化治疗在PH的临床前模型中是否有效仍存在争议,这可能是与选择的药物、剂量和实验设计有关。例如,根据浓度和肺细胞类型,TEMPOL可以是促氧化剂或抗氧化剂[26]。对于PH患者是否应给予抗氧化剂治疗这一问题,需要进一步的研究。
4.5 NOX酶抑制剂减少ROS生成模拟Cav-1支架结构域的多肽是eNOS和NOX酶活性的有效抑制剂,并且在动物模型中被证明可以有效预防PH。这种方法的临床实用性尚未得到证明,Cav-1的多肽是否可以减少PH中过量的ROS和RNS仍有待确定。抑制ROS生成在预防PH中也有一定的应用前景,包括使用夹竹桃麻素抑制免疫细胞中的NOX 2或使用选择性的NOX 1或NOX 4抑制剂以减少ROS的生成[27],进而抑制硝化应激反应。
5 结语和展望
硝化应激增加是PH的标志。在PH肺组织存在明显的ONOO-、NT和特定蛋白的硝基化。硝化应激导致肺血管细胞发生细胞毒性,影响蛋白质的翻译后修饰及其功能,并诱导eNOS解偶联,导致血管扩张剂NO的生物利用度减低,最终引起血管收缩和血管重构导致PH(Fig1)。

Fig1 Nitrative stress in pathogenesis of pulmonary hypertension
目前,对于PH的研究主要集中在对血管舒缩功能进行调控,针对PAH的靶向治疗旨在纠正内皮功能障碍。虽然eNOS在PH患者肺组织中的表达水平与对照组相比有上调、不变或下调,但目前研究普遍强调NO对PH的保护作用。但我们之前的研究发现,NO与PH之间的关系复杂,推测在PH中NO作为舒血管活性物质发挥保护作用与作为自由基发挥氧化/硝化应激损害作用之间可能存在一个阈值[28]。因此,对于PH的治疗,抑制硝化应激可能会改善PH患者临床预后,但是通过吸入或膳食增加NO作为治疗PH的方案需要斟酌,推测与疾病发展阶段密切相关,疾病早期增加NO可能有益,疾病晚期或弊大于利。
