lncRNA ENST00000452996.1通过ERK/GSK-3β/β-catenin信号通路调控肝癌细胞增殖、迁移及侵袭
2024-04-23林丽彬郑伟男林扬元
谢 群,林丽彬,郑伟男,徐 丽,林扬元
(莆田学院1. 肿瘤转化医学福建省高校重点实验室、2. 护理学院、3. 基础医学院,福建 莆田 351100)
肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌中最常见的类型,具有高侵袭性、转移性和低生存率等特点。研究HCC侵袭转移等分子机制,探寻新的基因治疗靶点及其作用机制,对于提高患者生存率及改善预后有着重要价值[1]。长链非编码RNA(long non-coding RNA,lncRNA)是一类长度大于200核苷酸,且不编码蛋白质产物的片段,可通过表观遗传、转录前及转录后调控等方式来调控基因表达,从而影响肿瘤侵袭转移、凋亡和自噬等[2]。lncRNA作为致癌基因或抑癌基因,参与肿瘤细胞的多种生物学过程,被证实在包括HCC在内的多种癌症的诊断、预后预测和治疗中具有潜在价值,例如:H19的高表达与HCC发生、预后、生存相关,可作为判断HCC患者预后的候选指标[3];OGFRP1和DRHC分别通过AKT/mTOR、Wnt/β-catenin或MEK/ERK信号通路,调控HCC增殖、侵袭和转移[4-5]。但是,大部分lncRNA的功能及调控机制还很不明确,探讨与HCC相关lncRNA的生物学功能及作用机制对于揭示HCC分子机制具有重要意义,也是靶向功能性lncRNA以期达到治疗目的的新思路。
AC245100.1是课题组新近发现的一种新的lncRNA,本研究通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据集,分析AC245100.1的转录本之一ENST00000452996.1在HCC中的表达模式及临床意义,同时构建靶向ENST00000452996.1的shRNA慢病毒载体,探讨其对肝癌细胞生物学功能的影响及调控机制,以期为HCC诊治提供新的思路。
1 材料与方法
1.1 细胞株人肝癌细胞HepG2(货号:SCSP-510)、Hep3B(货号:SCSP-5045)和Huh-7(货号:SCSP-526),以及人胚肾细胞293T(货号:SCSP-502),均购自中国科学院上海细胞库;人肝癌细胞JHH-7(货号:CTCC-004-0053)由浙江美森细胞科技有限公司提供。
1.2 试剂MEM(货号:MA0217)和DMEM/F12(货号:MA0214)培养基、AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号:MA0220)、细胞核蛋白与细胞质蛋白抽提试剂盒(货号:MA0211),均购自大连美仑生物技术有限公司;DMEM培养基(货号:C11995500BT)、TRIzol试剂,均购自Invitrogen公司;CCK-8试剂盒、GSK-3β抑制剂TDZD-8(货号:B1249),购自美国APExBIO公司;Transwell小室(货号:353097),购自美国Becton Dickinson公司;Matrigel胶(货号:356234),购自美国Corning公司;抗体ERK1/2(货号#4695)、p-ERK1/2(货号#4370)、p-GSK-3βSer9(货号#5558)、GSK-3β(货号#12456)、β-catenin(货号#9562)、p-β-catenin(货号#9561),均购自Cell Signaling Technology公司;β-actin(货号:AF5001)和Histone H3(货号:AH433)抗体,购自碧云天生物技术公司;shRNA干扰序列,由上海吉凯基因医学科技股份有限公司合成;原位荧光杂交(fluorescent in situ hybridization,FISH)探针,由武汉赛维尔生物科技有限公司合成;表皮生长因子(epidermal growth factor,EGF)(货号:C029),购自Novoprotein公司。
1.3 仪器Eclipse CI显微镜(Nikon公司);MultiskanTM FC酶标仪(ThermoFisher Scientific公司);FACS Calibur流式细胞仪(Becton Dickinson公司);垂直电泳仪及转膜仪(Bio-Rad公司)。
1.4 方法
1.4.1数据获取与分析 采用TCGA数据集下载数据并进行分析。下载HCC组织及其癌旁组织50对,分析ENST00000452996.1在HCC组织及其癌旁组织中的差异表达。下载371例HCC组织中ENST00000452996.1表达及其临床病理学特征相关数据,其中365例具有完整的Edmondson-Steiner分级数据,367例具有完整肿瘤淋巴结转移(tumor-node-metastasis,TNM)分期临床特征,347例具有完整病理分期临床特征。分别分析ENST000004 52996.1表达及其与临床病理学特征的相关性,此外,326例具有完整生存时间的病例纳入生存分析。
1.4.2细胞培养 Hep3B和HepG2细胞用含10%胎牛血清的MEM培养基,Huh-7和293T细胞用含10%胎牛血清的DMEM培养基,JHH-7细胞用含10%胎牛血清的DMEM/F12培养基,置37 ℃、5% CO2培养箱中培养。
1.4.3qRT-PCR检测 TRIzol提取总RNA,使用SYBR Master Mixture进行qRT-PCR,检测肝癌细胞中ENST00000452996.1表达。引物序列为:ENST0000 0452996.1:上游5′-ATGAACCCACCATCACCATA-3′,下游5′-CTCCCTCAGTGCTAGACCCT-3′;内参照GAPDH:上游5′-TGACTTCAACAGCGACACCCA-3′,下游5′-CACCCTGTTGCTGTAGCCAAA-3′。
1.4.4FISH检测 采用FISH法检测ENST00000 452996.1在肝癌细胞中的表达及亚细胞定位。FISH探针序列5′-CGAAGCTTAGTGAAACGGCG-3′。融合生长的细胞用4%多聚甲醛固定,蛋白酶K(20 mg·L-1)37 ℃作用15 min,加入预杂交液37 ℃孵育60 min,于探针液中40 ℃孵育过夜,依次用2×柠檬酸钠(saline sodium citrate,SSC)、1×SSC和0.5×SSC洗涤,最后用DAPI返染,使用显微镜拍照分析。
1.4.5慢病毒shRNA载体构建与病毒包装设计 采用靶向ENST00000452996.1的shRNA干扰序列(5′-CGGGAAATCTCGTAATGGCAT-3′),设置对照序列(5′-TTCTCCGAACGTGTCACGT-3′),将shRNA干扰序列和对照序列分别克隆到含慢病毒绿色荧光蛋白的载体GV493,用Helper系统共转染293T细胞,48 h后,收集含病毒的细胞上清液,经离心、过滤及浓缩后,梯度稀释法测定病毒滴度。将病毒浓缩液置-80 ℃保存,实验组与对照组分别命名为shENST00000452996.1和shCtrl。
1.4.6肝癌细胞生物学功能检测
1.4.6.1 CCK-8检测细胞增殖活性 细胞以每孔1×104个接种于96孔板,shENST00000452996.1和shCtrl分别感染细胞,分别在24、48、72、96、120 h时,每孔添加CCK-8溶液10 μL,37 ℃孵育2 h后,酶标仪450 nm处测量吸光度(absorbance,A)。
1.4.6.2 平板克隆实验 细胞以每孔3×103个接种于6孔板中,shENST00000452996.1和shCtrl分别感染细胞,观察细胞克隆形成,于培养12 d时,观察细胞可见克隆形成(每个克隆≥10个细胞)后,4%多聚甲醛固定,0.1%结晶紫染色,显微镜下拍照计数每孔形成的克隆数。
1.4.6.3 细胞凋亡检测 细胞以每孔7×105个接种于6 cm培养皿,shENST00000452996.1和shCtrl分别感染细胞48 h,按照Annexin-V/PI双染色法凋亡检测试剂盒说明书操作,流式细胞仪检测细胞凋亡情况,TreestarFlowJo v10.6.2分析数据。
1.4.6.4 划痕实验 细胞以每孔3×105个接种于6孔板,待细胞融合后,用200 μL的移液器吸头在培养板底部呈“一”字型划痕,并拍照记录划痕位置,shENST00000452996.1和shCtrl分别感染细胞48 h,在同一位置拍摄记录划痕区域细胞迁移情况。采用ImageJ软件测定划痕区域面积(area,A),细胞迁移率/%=(A0 h-A48 h)/A0 h×100。
1.4.6.5 Transwell检测 迁移实验时,细胞以每孔3×104个接种于Transwell小室上室内,shENST000 00452996.1和shCtrl分别感染细胞,上室内加入200 μL含1%胎牛血清的培养基,下室内加入600 μL含20%胎牛血清的培养基,培养48 h后,擦除上室内未穿膜的细胞,4%多聚甲醛固定,0.1%结晶紫染色,显微镜下随机选取5个视野拍照,并计算穿膜细胞数平均值。侵袭实验时,Transwell小室聚碳酸酯膜内侧预铺Matrigel胶,其他步骤与迁移实验相同。
1.4.7Western blot检测ERK/GSK-3β/β-catenin信号相关蛋白的表达 分别提取shENST0000045 2996.1和shCtrl感染细胞48 h的全细胞蛋白,Western blot法分别检测ERK1/2、p-ERK1/2、GSK-3β、p-GSK-3βSer9、β-catenin和p-β-catenin蛋白表达,以β-actin作为内参照。采用细胞核蛋白抽提试剂盒提取核蛋白,检测细胞核β-catenin蛋白表达,以Histone H3作为内参照,分别分析各种蛋白相对表达量。此外,shENST00000452996.1感染细胞的同时,分别加入ERK激动剂EGF(40 μg·L-1)和GSK-3β抑制剂TDZD-8(20 μmol·L-1)作用48 h,检测全细胞ERK1/2、p-ERK1/2、p-GSK-3βSer9、GSK-3β、β-catenin、p-β-catenin及细胞核β-catenin的蛋白表达。
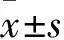
2 结果
2.1 生物信息学分析结果TCGA数据集50对HCC组织和癌旁组织中,与癌旁组织相比,HCC组织中ENST00000452996.1表达明显增高(Fig1A)。分析365例具有完整Edmondson-Steiner分级临床信息发现,高表达的ENST00000452996.1与Edmondson-Steiner分级密切相关(Tab1),分析367例具有完整TNM分期临床信息和347例具有完整病理分期临床信息发现,ENST00000452996.1表达与TNM分期和病理分期均不相关。对326例具有完整生存期的临床资料进行Kaplan-Meier分析显示,高表达的ENST00000452996.1与患者低生存率紧密相关,见Fig1B。
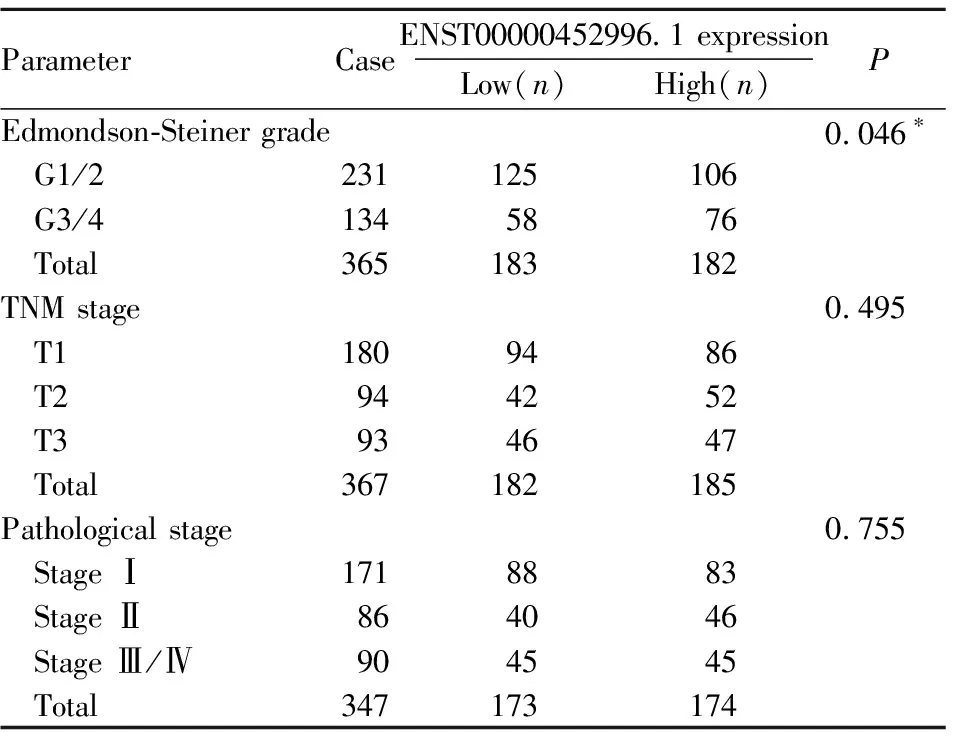
Tab1 Relationship between lncRNA ENST00000452996.1 expression and clinicopathological parameters in HCC using TCGA database
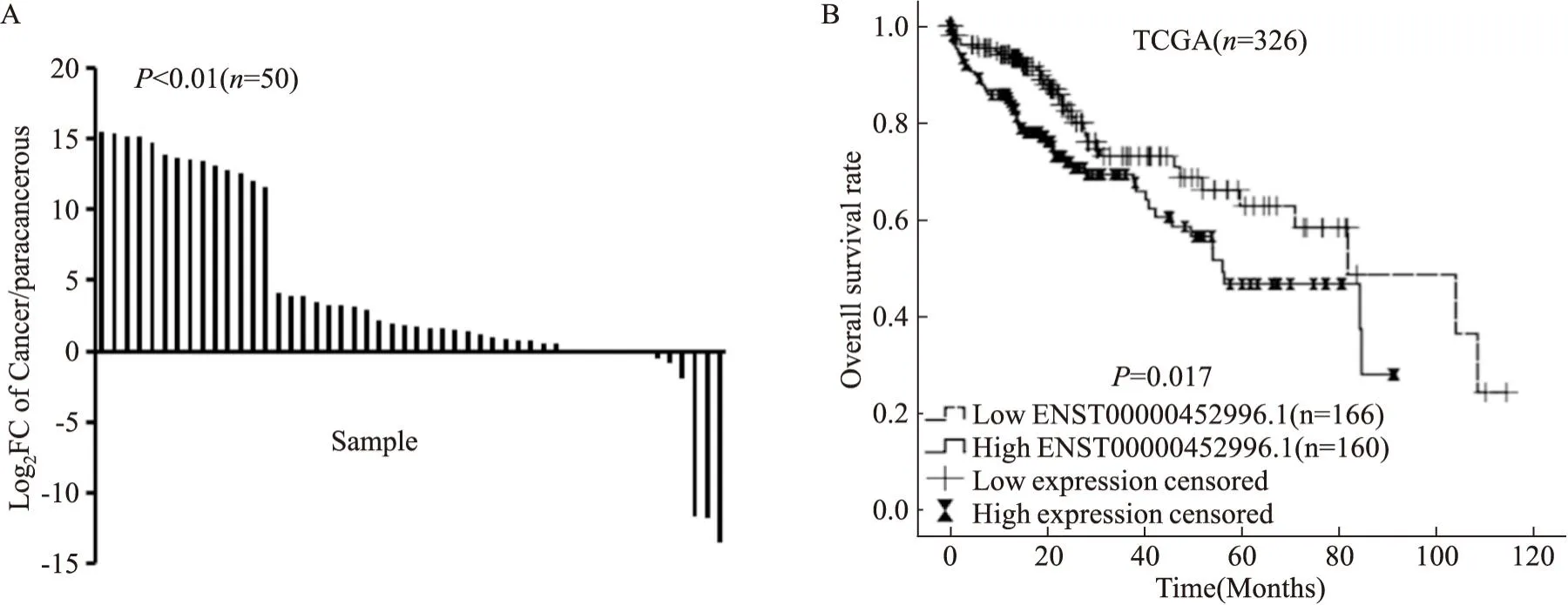
Fig1 The expression level of lncRNA ENST00000452996.1 in HCC tissues based on TCGA database
2.2 lncRNA ENST00000452996.1在HCC细胞系中的表达及亚细胞定位采用qRT-PCR法检测ENST00000452996.1在HCC细胞系中的表达。如Fig2A所示,ENST00000452996.1在Huh-7、JHH-7、Hep3B和HepG2细胞中均有表达。采用FISH法检测ENST00000452996.1的亚细胞定位,发现其主要位于细胞质中(Fig2B)。

Fig2 lncRNA ENST00000452996.1 expression levels and cellular distribution in
2.3 干扰lncRNA ENST00000452996.1表达对Huh-7细胞增殖能力的影响CCK-8结果显示(Fig3A),与shCtrl组比较,shENST00000452996.1作用Huh-7细胞24 h,其吸光度值无明显变化,从48 h开始,吸光度值随着时间增加而明显下降,提示细胞增殖能力减弱。克隆形成实验结果显示(Fig3B、3C),干扰ENST00000452996.1表达后,细胞的集落形成数量明显少于shCtrl对照组。结果提示,shENST 00000452996.1抑制细胞增殖,表明ENST0000045 2996.1促进肝癌细胞增殖。
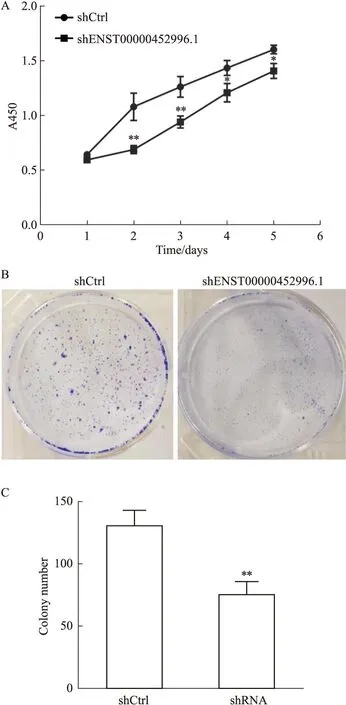
Fig3 Effect of shENST00000452996.1 on proliferation
2.4 干扰lncRNA ENST00000452996.1表达对Huh-7细胞凋亡的影响流式细胞术检测结果显示(Fig4),与shCtrl组比较,shENST00000452996.1作用48 h后,凋亡细胞明显增加,提示其促进细胞凋亡,表明ENST00000452996.1抑制Huh-7细胞凋亡。
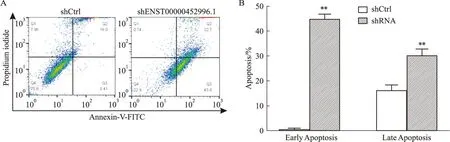
Fig4 Effect of shENST00000452996.1 on apoptosis of Huh-7 n=3)
2.5 干扰lncRNA ENST00000452996.1表达对Huh-7细胞迁移、侵袭的影响划痕实验结果显示(Fig5A、5B),划痕处的创面愈合率由shCtrl组的(27.6±6.2)%降至shENST00000452996.1组的(14.8±2.9)%,提示干扰ENST00000452996.1表达可明显降低细胞的迁移能力。Transwell实验结果显示(Fig5C、5D),与shCtrl组比较,shENST000 00452996.1组细胞的迁移和侵袭能力均明显减弱。结果提示shENST00000452996.1抑制细胞的迁移和侵袭,表明ENST00000452996.1能够促进肝癌细胞迁移和侵袭。

Fig5 Effects of lncRNA ENST00000452996.1 knockdown on migration and invasion of Huh-7
2.6 干扰lncRNA ENST00000452996.1表达对肝癌细胞ERK/GSK-3β/β-catenin信号通路的影响为了进一步探讨ENST00000452996.1对肝癌细胞恶性生物学行为的调控机制,对ERK/GSK-3β/β-catenin信号通路相关蛋白表达进行检测。如Fig6所示,与shCtrl组比较,干扰ENST00000452996.1表达后,全细胞的p-ERK1/2、p-GSK-3βSer9和β-catenin表达均明显下调,而GSK-3β和p-β-catenin表达明显上调,细胞核β-catenin表达明显下降。分别采用ERK1/2激动剂EGF、GSK-3β抑制剂TDZD-8激活或阻断相应通路的活性,Western blot结果显示,与shENST00000452996.1组比较,EGF明显提高干扰ENST00000452996.1表达后全细胞p-ERK1/2、p-GSK-3βSer9、β-catenin,以及核β-catenin的表达水平,降低了GSK-3β和p-β-catenin的表达水平;与shENST00000452996.1组比较,TDZD-8明显提高干扰ENST00000452996.1表达后全细胞p-GSK-3βSer9、β-catenin及细胞核β-catenin的表达,明显降低GSK-3β和p-β-catenin的表达。以上结果提示,干扰ENST00000452996.1表达通过ERK/GSK-3β/β-catenin信号通路,调控肝癌细胞恶性生物学行为,表明ENST00000452996.1通过调控ERK/GSK-3β/β-catenin信号通路,发挥促进肝癌细胞增殖、迁移、侵袭的作用。
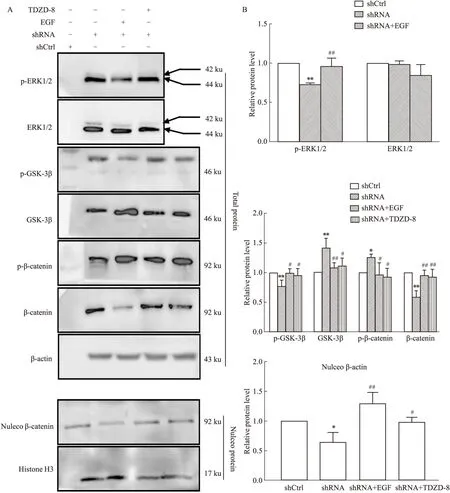
Fig6 Effects of lncRNA ENST00000452996.1 knockdown on ERK/GSK-3β/β-catenin signaling
3 讨论
近年来,相继报道了许多lncRNA参与HCC的发生发展,但只有少数lncRNA的功能与作用机制被研究。本研究报道了1个由人1号染色体CH17-172B3克隆上基因编码的新lncRNA,AC245100.1,其生物学作用及相关机制尚未见报道。TCGA分析发现,lncRNA AC245100.1的转录本之一ENST00000452996.1在HCC组织中呈现高表达,且与HCC组织Edmondson-Steiner分级及患者低生存率密切相关,而Edmondson-Steiner分级是肿瘤预后的重要因素,由此提示ENST00000452996.1可能参与HCC发生发展过程[6]。
为了探讨ENST00000452996.1的致癌作用及生物学功能,本研究通过构建靶向ENST00000452 996.1的shRNA慢病毒载体,感染Huh-7细胞,检测发现细胞的增殖、迁移和侵袭能力均减弱,细胞凋亡能力增强,表明ENST00000452996.1能够增强肝癌细胞的增殖、迁移和侵袭,并阻止细胞凋亡,提示其能够促进HCC的恶性进展。鉴于ENST00000452 996.1促进肝癌细胞恶性生物学行为的作用,有必要对其致癌作用机制进行深入探讨。
ERK/GSK-3β/β-catenin信号通路在肿瘤的增殖和侵袭转移过程中起重要作用[7],但ENST00000452996.1与ERK/GSK-3β/β-catenin信号通路转导的关系尚未见报道。本研究结果显示,干扰ENST00000452996.1表达后,全细胞的ERK1/2总蛋白变化不明显,p-ERK1/2、p-GSK-3βSer9、β-catenin和细胞核β-catenin表达均下调,而GSK-3β和p-β-catenin表达增强。ERK1/2是被广泛研究的丝裂原活化蛋白激酶信号通路调控因子,通过磷酸化激活下游转录因子,促进细胞因子和生长因子等的磷酸化,将细胞外信号向细胞核中逐级传递,促进肿瘤细胞增殖、分化等过程[8]。GSK3β是一种丝氨酸/苏氨酸激酶,作用的底物包括转录因子、信号蛋白等百余种,参与调节糖代谢、细胞增殖、分化、迁移、凋亡等诸多事件[9]。有研究报道,活化ERK在Thr43位点磷酸化可以通过90 ku核糖体S6激酶(p90RSK)触发GSK-3β丝氨酸9(Ser9)位点的磷酸化,导致GSK-3β失活[10]。本研究中,干扰ENST00000452996.1表达后,ERK1/2磷酸化受到抑制,GSK3β在Ser9位点上的磷酸化随即也受到抑制,GSK-3β活性增加,β-catenin磷酸化增强,β-catenin核转位受到抑制,说明ENST00000452996.1能够增强ERK1/2的磷酸化,导致GSK3β在Ser9位点发生磷酸化,失活的GSK-3β与β-catenin解离,促进β-catenin的核转位。细胞核β-catenin的积累是GSK-3β信号激活的关键事件,GSK-3β通路失活会导致细胞核中β-catenin的异常积累,GSK-3β信号通过磷酸化β-catenin,调控参与癌症进展的细胞活动[11-12]。当GSK-3β信号通路被激活时,β-catenin从细胞质转运到细胞核,与T细胞转录因子(T cell factor,TCF)和淋巴增强因子(lymphoid enhancer factor,LEF)结合,触发c-Myc、细胞周期蛋白D1、基质金属蛋白酶7等靶基因,以及上皮-间质转化相关标记物的转录,激活下游基因转录,促进肿瘤进展[13-14]。
为了进一步阐明ERK1/2与GSK-3β之间的关系,选用ERK1/2激动剂EGF处理干扰ENST00000452996.1表达后的细胞,消除了ERK1/2磷酸化受抑制的状态,此时GSK-3在Ser9位点的磷酸化得以恢复,GSK-3β出现失活,意味着ERK信号转导是GSK3β失活所必需的。TDZD-8是GSK-3β非ATP竞争性的小分子抑制剂,主要磷酸化GSK-3β的Ser9位点,从而降低GSK-3β的活性[15-16]。为了证实GSK-3β与β-catenin之间的关系,本研究证实了用TDZD-8处理干扰ENST00000 452996.1表达的细胞,GSK-3β在Ser9位点的磷酸化得以恢复,削弱感染细胞GSK-3β的激活状态,降低对β-catenin的磷酸化,且GSK-3β与β-catenin解离,β-catenin核转位效应得以增强。进一步佐证了干扰ENST00000452996.1表达可以抑制ERK1/2磷酸化,继而阻止GSK-3β的Ser9位点磷酸化,增加GSK-3β活性,导致β-catenin磷酸化,β-catenin核转位受到抑制。推断ENST00000452996.1通过ERK/GSK-3β/β-catenin信号通路,增强肝癌细胞增殖、迁移及侵袭能力,抑制细胞凋亡,从而发挥促进HCC的作用。
综上所述,本研究报道了一种新的致癌lncRNA ENST00000452996.1,并发现其能够通过ERK/GSK-3β/β-catenin途径,促进肝癌细胞的增殖、迁移和侵袭能力及抑制细胞的凋亡。研究结果为探寻HCC发生发展的分子调控机制及靶基因防治研究提供了实验依据和新思路。
