蛇莓提取物通过GPX4诱导铁死亡抑制肾癌细胞OS-RC-2增殖
2024-04-23游赣花安群英朱建国
游赣花,安群英,何 娟,李 凯,杨 萌,文 周,钱 城,朱建国
(1.贵州省第二人民医院科研科,贵州 贵阳 550004; 2.衡水市第六人民医院全科医学科,河北 衡水 053200;3.贵州中医药大学第二附属医院口腔科,贵州 贵阳 550003;4.贵阳学院生物与环境工程学院,贵州 贵阳 550005;5.遵义医科大学 研究生院,贵州 遵义 563000;6.中国人民解放军联勤保障部队第九二五医院质量管理科,贵州 贵阳 550000;7.贵州省人民医院泌尿外科,贵州 贵阳 550000)
肾细胞癌(renal cell carcinoma,RCC)是泌尿系统最常见的肿瘤之一,也是泌尿系肿瘤中致死率最高的肿瘤之一[1]。2020年,全球新患RCC病例43.1万例,因RCC死亡17.9万例[2]。世界卫生组织根据其分子、遗传特征形态对肾癌进行了分类,肾透明细胞癌是RCC中最常见的亚型。在诊疗过程中,约30%的RCC患者在诊断时被发现肿瘤细胞已经发生转移,30%~70%的RCC患者在手术治疗后仍有可能复发[3]。因此,进一步明确RCC的发病机制,并开发出新型、高效、低毒的化疗药物对于治疗这种恶性肿瘤至关重要。
铁死亡是一种调节性细胞死亡形式,由铁依赖性的脂质过氧化引起[4-5],谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)通过将脂质氢过氧化物转化为无毒脂质醇来预防铁死亡[6-7]。研究表明,抑制GPX4诱导铁死亡已成为触发癌细胞死亡的治疗策略之一[8]。因此,通过诱导肾癌细胞发生铁死亡可能是一种有前景的治疗策略。
本研究旨在探讨蛇莓醇提物诱发活性氧(reactive oxygen species,ROS)积累引发RCC细胞发生铁死亡,进一步抑制肾癌细胞OS-RC-2增殖,为开发具有潜在抗RCC作用的新药提供理论基础。
1 实验材料
1.1 蛇莓蛇莓购买于贵州省贵阳市中药材市场,由贵州省食品药品检验所中药室专家进行鉴定,鉴定结果为蔷薇科蛇莓属植物蛇莓Duchesneaindica(Andr.) Focke。
1.2 细胞株OS-RC-2肾透明细胞癌细胞购买于武汉普诺赛公司,经过STR鉴定。
1.3 主要试剂胰酶(美国Gibco,批号:2428760);RPMI 1640培养液(美国Gibco,批号:8122551);胎牛血清(以色列BI,批号:2351431);ROS分析试剂盒(江苏凯基,批号:20220621);流式凋亡试剂盒(Meilunbio,批号:MA0220);谷胱甘肽(glutathione,GSH)检测试剂盒(上海索莱宝,批号:20220408);丙二醛(malondialdehyde,MDA)检测试剂盒(上海索莱宝,批号:20220414);细胞活力(cell counting kit,CCK-8)检测试剂盒(日本同仁,批号:SX748);BCA蛋白浓度测定试剂盒(上海索莱宝,批号:20220225);超敏化学发光试剂(新赛美,批号:20230208);NAC(MCE,HY-134495);Fer-1(MCE,HY-100579);GAPDH抗体(CST,5174S);GPX4抗体(三鹰,67763-1-lg); HO-抗体(Abcam,ab68477); SLC7A11抗体(Abcam,ab275411);Transferrin抗体(Abcam,ab214039);Dulcitol(上海MCE,CAS号:608-66-2)。
1.4 主要仪器CO2细胞培养箱(日本SANYO);流式细胞仪(美国Beckman);酶标仪(美国Bio-teck);化学发光成像系统(美国SYNGENE)。
2 主要方法
2.1 蛇莓活性成分及潜在作用靶点的获取利用HERB本草组鉴数据库(http://herb.ac.cn/)获取蛇莓化学成分,Swiss target数据库(https://swisstargetprediction.ch)获取蛇莓各成分对应的靶点。利用Genecards(https://www.genecards.org/)数据库,以“ferroptosis”为关键词进行检索,以种属为“Homo(智人)”,相关性大于“1”为筛选标准,获取铁死亡的相关基因,用Cytoscape3.5.1软件展示蛇莓-成分-靶点的关系。
2.2 蛇莓活性成分和铁死亡核心靶点的分子对接利用pubchem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取蛇莓成分的分子结构,保存为SDF格式,利用MOE2020.09软件对分子结构进行能力最小化;利用RCSB PDB(https://www.rcsb.org/)数据库,获取GPX4的蛋白结构,编号为“2OBI”,利用MOE2020.09软件对蛋白结构去除配体、水分子、计算电荷,随后对蛇莓化合物配体和GPX4蛋白受体进行分子对接,对接次数为30次。
2.3 药物的提取及配制蛇莓醇提物:取适量干燥的蛇莓全叶粉碎后用70%乙醇浸泡2 h,回流提取3次(每次1 h),随后合并提取液,过滤后,减压回收溶剂至无醇味,得到浸膏。称取浸膏100 mg充分溶解于DMSO中,加细胞培养液定容至20 mL,0.22 μm小滤器过滤,制备成母液(5 g·L-1)备用。根据需要稀释至所需浓度给药(DMSO终浓度<0.2%)。
2.4 细胞的培养快速从液氮罐中取出细胞,经37 ℃水浴,再加入5~10倍体积的完全培养液低速离心5 min后弃上清液,加入1 mL 10%培养液重悬细胞后,加培养液至4 mL,置于37 ℃含5% CO2培养箱内,24 h后更换新培养液。
2.5 CCK-8检测按4×103个OS-RC-2细胞接种于96孔板,细胞贴壁后进行药物处理,每组分别设3个复孔,并设置2个调零孔,继续培养72 h,然后加入10 μL CCK-8在37 ℃下孵育1.5 h,用酶标仪在450 nm处测量吸光度值。
2.6 ROS水平检测按1×106个/孔将细胞接种于6孔板,按照不同分组分别对相应的孔进行处理,CO2培养箱内培养24 h。向孔中加入DCFH-DA使终浓度为10 μmol·L-1,吹打混匀后放入培养箱内避光孵育。流式细胞仪上机检测,使用488 nm激发波长,525 nm发射波长,各组细胞的平均荧光强度反映了细胞内的ROS水平。
2.7 流式细胞凋亡检测将对数生长期的OS-RC-2细胞接种于6孔板内,进行所需的处理(加药或不加药),48 h后终止培养。收集细胞,加入600 μL 1×Binding Buffer轻轻重悬细胞,加入5 μL Annexin V-FITC轻轻混匀后室温避光孵育20 min,加入10 μL PI染色液,混匀,冰浴避光放置5 min,在30 min内进行流式细胞检测。
2.8 GSH检测5×106个OS-RC-2细胞加入1 mL GSH检测试剂,在液氮或37 ℃水浴锅中反复冻融3次,8 000×g离心10 min,取上清置于冰上待测,并按说明书进行操作。蛋白浓度计算GSH含量(μg·mg-1prot)=x÷Cpr(Cpr:上清液蛋白质浓度,x为标准曲线斜率)。
2.9 MDA检测5×106个细胞离心收集后,超声波破碎,取上清,测定管和空白管分别加入300 μL MDA工作检测液,测定管加入100 μL样品,空白管加入100 μL蒸馏水;混合液在100 ℃水浴中放置60 min,置于冰浴中冷却,10 000g常温离心10 min。吸取200 μL上清液于96孔板中,测定各样本在532 nm和600 nm处的吸光度。MDA含量(nmol·mg-1prot)=53.763×ΔA÷Cpr(Cpr:样本蛋白质浓度,g·L-1)
2.10 Western blot蛋白表达检测提取细胞总蛋白,上样浓度为每孔40 μg,利用SDS-PAGE进行电泳,将蛋白条带转移到PVDF膜上,牛奶封闭液中室温下摇床封闭1 h;加入GPX4、SLC7A11、Transferrin、HO-1一抗工作液置4 ℃冰箱过夜;TBST 缓冲液(pH 7.4)洗膜,室温下孵育稀释的二抗1.5 h;TBST洗膜,ECL发光液显影。同法封闭、孵育GAPDH。ImageJ软件对条带进行灰度分析。
2.11 统计学分析使用GraphPad 9.0软件对数据进行统计分析,结果表示为。对数据进行正态分布检验,服从正态分布时,两两比较采用LSD-t检验,多组间比较采用单因素方差分析;不服从正态分布时,采用Mann-Whitney或Kruskal-Wallis分析两个或多个组之间的差异,检验水准α=0.05。
3 结果
3.1 蛇莓醇提物对OS-RC-2细胞增殖、ROS水平的影响CCK-8检测不同浓度(0~24 mg·L-1)的蛇莓醇提物给药24、48、72 h后对OS-RC-2细胞活力的影响。结果显示,与DMSO对照组相比,蛇莓醇提物可呈时间及浓度依赖性抑制OS-RC-2的细胞活力,见Fig1A。
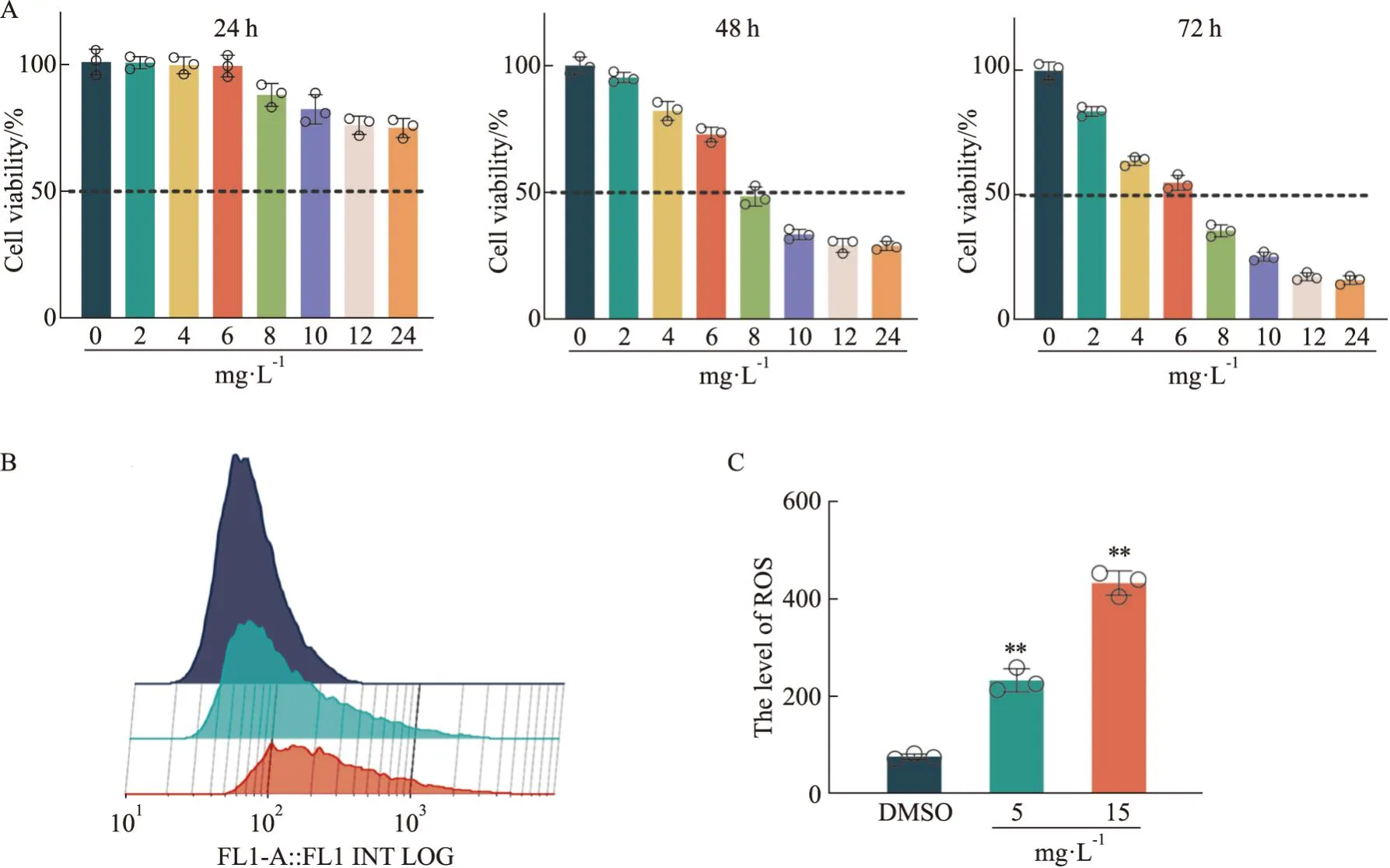
Fig1 Duchesnea indica (Andr.) Focke alcohol extract inhibited OS-RC-2 cell proliferation and increased ROS
采用ROS试剂盒检测蛇莓醇提物对OS-RC-2细胞ROS水平的影响。结果显示,与对照组相比,5、15 mg·L-1两个浓度的蛇莓醇提物明显促进了OS-RC-2细胞的ROS水平,见Fig1B、1C。
3.2 蛇莓醇提物对OS-RC-2细胞凋亡的影响流式细胞仪检测蛇莓醇提物对OS-RC-2细胞凋亡的影响。结果显示,与DMSO对照组相比,1.25、2.5、5、10、20 mg·L-1的蛇莓醇提物给药明显促进OS-RC-2细胞凋亡。然而,5、10、20 mg·L-1的给药浓度引起的各组间细胞凋亡率并无显著差异,提示蛇莓醇提物抑制OS-RC-2细胞增殖可能并非通过凋亡途径,见Fig2。

Fig2 Effect of Duchesnea Indica extract on apoptosis of OS-RC-2
3.3 蛇莓醇提物对OS-RC-2细胞GSH、MDA含量的影响检测5、10、15 mg·L-1蛇莓醇提物对OS-RC-2细胞GSH、MDA含量的影响。结果显示,与DMSO对照组相比,蛇莓醇提物给药后明显降低OS-RC-2细胞的GSH含量,见Fig3A;而MDA含量显著增加,见Fig3B。

Fig3 Effect of Duchesnea Indica (Andr.) Focke alcohol extract on content of OS-RC-2 GSH and
3.4 铁死亡抑制剂、ROS抑制剂对蛇莓醇提物抑制OS-RC-2细胞增殖的影响为进一步研究蛇莓醇提物抑制OS-RC-2细胞增殖的机制,本课题利用铁死亡抑制剂Fer-1或ROS抑制剂NAC预处理细胞,并将实验分为4组,即:DMSO对照组、Fer-1(1 μmol·L-1)组、蛇莓醇提物(10 mg·L-1)组、Fer-1+蛇莓醇提物联合给药组,或:DMSO对照组、NAC(5 mmol·L-1)组、蛇莓醇提物(10 mg·L-1)组、NAC+蛇莓醇提物联合给药组,用CCK-8进行细胞活力检测。结果显示,相较于蛇莓醇提物单独给药组,Fer-1与蛇莓联合给药组显著回复蛇莓醇提物单独给药引起的细胞活力降低,见Fig4A;相较于蛇莓醇提物单独给药组,ROS抑制剂NAC与蛇莓联合给药组逆转了蛇莓醇提物单独给药引起的细胞活力降低,见Fig4B。
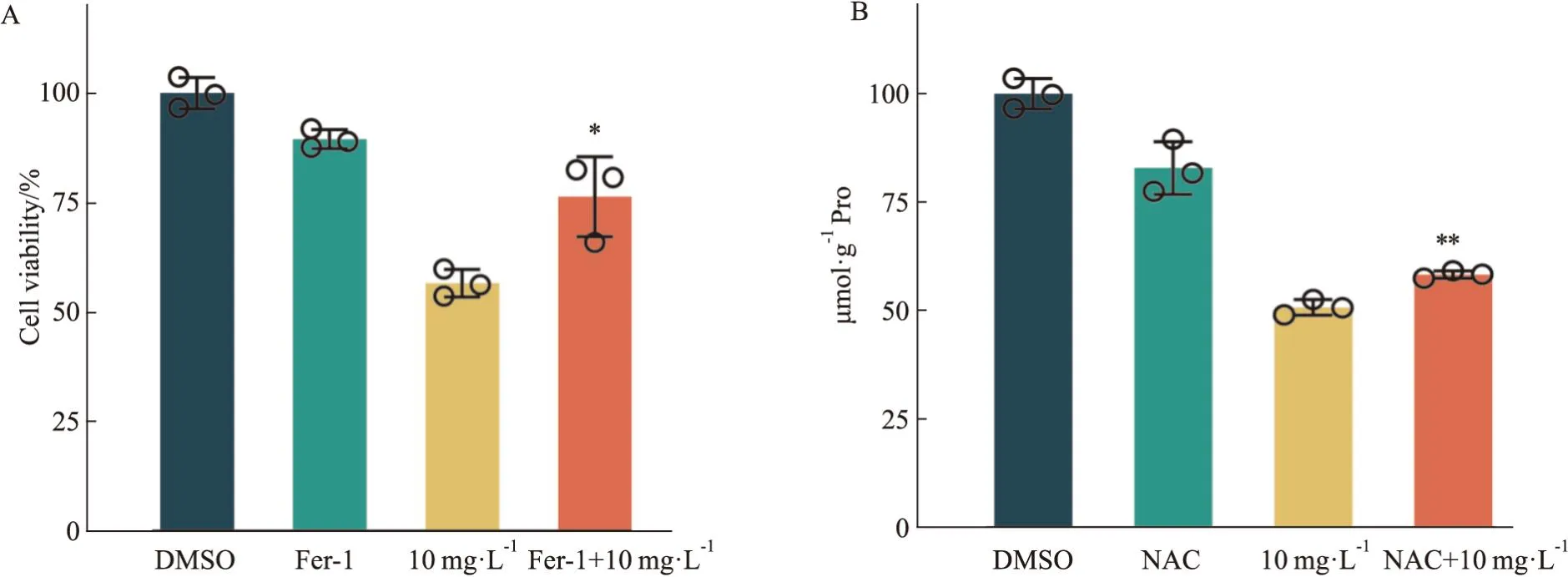
Fig4 Effects of ferroptosis and ROS inhibitors on proliferation of OS-RC-2
3.5 网络药理学、分子对接研究蛇莓中潜在的药效物质利用Herb数据库对蛇莓的主要成分进行查询,蛇莓草药编号为:HERB004977,数据库显示蛇莓主要成分有Ducheside A(蛇莓苷A)、Ducheside B(蛇莓苷B) 、Rosamultin(野蔷薇苷)、Pomolic acid(坡模醇酸)、Dulcitol (卫矛醇)、Roseoside(玫瑰花苷)、Ponalactone A(波那内酯A)等。
随后利用Cytoscape软件对蛇莓-成分-靶点进行可视化,如Fig5A;接下来,利用MOE软件对蛇莓的主要成分与铁死亡的核心靶点GPX4进行分子对接。结果显示,卫矛醇与GPX4蛋白受体-配体复合物结合稳定,结合能为-6.5 kJ·mol-1。卫矛醇与GPX4蛋白受体的ARG-152、ILE-129、LYS-135存在四对相互作用并存在4个氢键,见Fig5B,这提示蛇莓中的卫矛醇可能直接作用于GPX4诱导OS-RC-2细胞发生铁死亡。

Fig5 Composition and target of Duchesnea Indica (Andr.) Focke
3.6 蛇莓醇提物对OS-RC-2细胞铁死亡蛋白标志物的影响因蛇莓醇提物明显降低OS-RC-2细胞的GSH含量并增高MDA含量和ROS水平,铁死亡抑制剂Fer-1和ROS抑制剂NAC逆转了蛇莓醇提物引起的细胞活力下降,且网络药理学和分子对接发现蛇莓醇提物中的卫矛醇可能作用于铁死亡的关键靶点GPX4,表明蛇莓醇提物诱发了OS-RC-2细胞铁死亡。为明确蛇莓醇提物引起OS-RC-2细胞发生铁死亡的分子机制,进行了Western blot检测。结果显示,与DMSO对照组相比,蛇莓醇提物明显增加Transferrin、HO-1蛋白水平并降低了GPX4,SLC7A11蛋白水平,见Fig6A、6B。
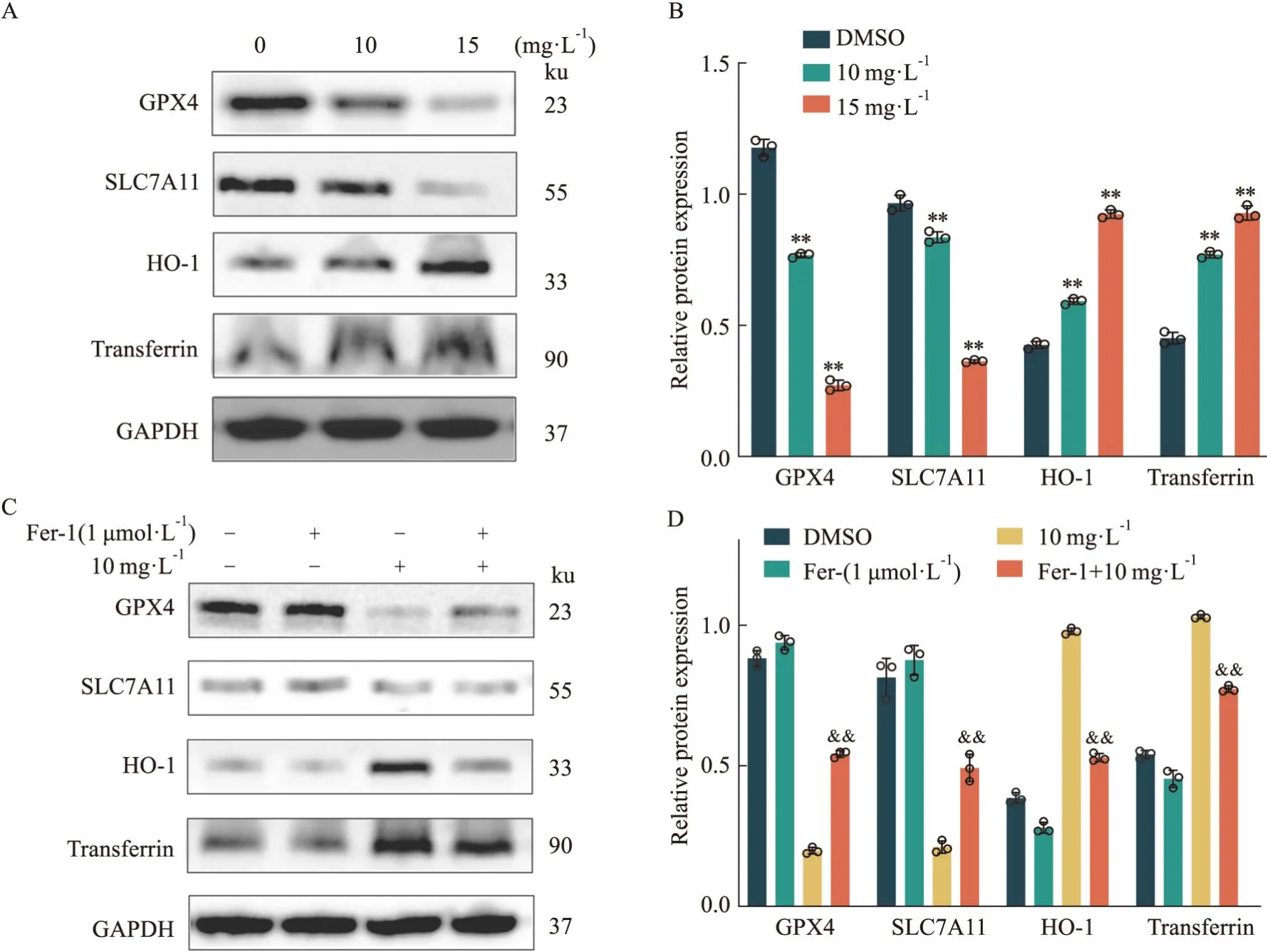
Fig6 Effect of Duchesnea Indica (Andr.) Focke alcohol extract on level of ferroptosis
接下来,将实验分为以下四组:DMSO对照组、Fer-1(1 μmol·L-1)组、蛇莓醇提物(10 mg·L-1)组、Fer-1+蛇莓醇提物联合给药组。Western blot结果显示,Fer-1与蛇莓联合给药组能明显逆转蛇莓单独给药所引起的Transferrin、HO-1蛋白水平升高及GPX4,SLC7A11蛋白水平降低,见Fig6C、6D。
3.7 卫矛醇对OS-RC-2细胞增殖及GPX4蛋白表达的影响为明确蛇莓醇提物中的卫矛醇对OS-RC-2细胞增殖能力及对铁死亡关键蛋白GPX4蛋白表达的影响,课题组用CCK-8检测不同浓度的卫矛醇(0~80 μmol·L-1)给药48、72 h后对OS-RC-2细胞活力的影响,并用Western blot检测卫矛醇给药48 h后GPX4蛋白表达水平的变化。
结果显示,与DMSO对照组相比,蛇莓醇提物中的卫矛醇可抑制OS-RC-2的细胞活力,见Fig7A、7B;并显著降低GPX4的蛋白表达,见Fig7C、7D。
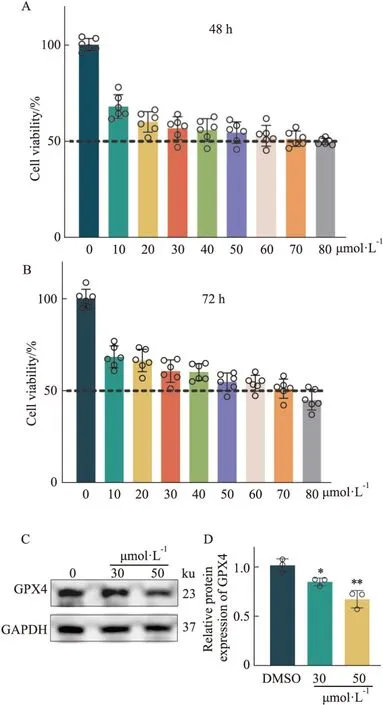
Fig7 Effect of Dulcitol on cell proliferation and protein
4 讨论
蛇莓为蔷薇科蛇莓属植物的叶,其化学成分较为明确,主要包括蛇莓苷A、蛇莓苷B、乌苏酸、齐墩果酸、β-谷甾醇、蔷薇酸、对羟基桂皮酸和芹菜素等[9]。现代药理学研究表明,蛇莓具有抗炎、抗病毒、抗肿瘤的作用[10-11]。如蛇莓提取物可通过MEK/ERK途径抑制MMP-2活性,从而降低口腔癌细胞的转移潜能[12];此外,蛇莓提取物还具有抑制膀胱癌、宫颈癌[13-14]等肿瘤细胞的增殖作用,但在肾透明细胞癌中的作用及其机制尚不清楚。
本研究发现蛇莓呈浓度及时间依赖性抑制肾透明细胞癌OS-RC-2细胞的增殖,并显著增加细胞ROS水平。随后,在与细胞活力呈浓度依赖的范围内(0~20 mg·L-1)进行了细胞凋亡检测,结果显示当蛇莓浓度超过5 mg·L-1后,即使药物浓度增加至20 mg·L-1,OS-RC-2细胞的凋亡率并未随之增加,提示蛇莓引起的细胞活力降低并非由凋亡驱动。
接下来进行了GSH、MDA的含量检测,结果显示蛇莓给药降低OS-RC-2细胞GSH含量并增加MDA的含量。GSH含量降低、MDA含量增加均是铁死亡的标志性事件之一[15],且ROS的积累,导致氧化失衡是铁死亡的必经过程[16]。课题组利用铁死亡的抑制剂Fer-1和活性氧的抑制剂NAC进行了回复实验,探索蛇莓抑制OS-RC-2细胞增殖是否由铁死亡驱动,结果表明Fer-1和NAC均在一定程度上逆转了蛇莓引起的细胞活力降低,提示蛇莓醇提物通过诱导铁死亡发挥抑制OS-RC-2细胞增殖作用。对蛇莓给药后OS-RC-2细胞的铁死亡关键蛋白表达进行检测,显示蛇莓给药后降低了细胞GPX4、SLC7A11蛋白表达水平。
GPX4是铁死亡的关键调节因子[17],研究显示,GPX4活性对于维持细胞中的脂质稳态、防止有毒脂质ROS的积累,从而阻断铁死亡的氧化引起的非凋亡性细胞死亡模式至关重要[18]。为研究蛇莓中潜在的药效物质,我们利用网络药理学和分子对接的方式对蛇莓的成分和靶点进行分析,并与铁死亡关键调控因子GPX4进行了分子对接,结果显示蛇莓主要成分卫矛醇与GPX4蛋白受体-配体复合物结合稳定,结合能为-6.5 kJ·mol-1。现代药理学研究表明,卫矛醇可以通过SIRT1/p53途径抑制肝细胞癌的增殖和迁移[19];可通过调节自噬途径对大鼠C6胶质瘤发挥抑制作用[20],表明卫矛醇可能是一种有潜力化疗剂。为进一步验证卫矛醇的抑癌作用及作用机制,课题组进行了CCK-8及Western blot实验,结果表明卫矛醇可抑制OS-RC-2细胞增殖并降低GPX4的蛋白水平。综上,提示卫矛醇可能直接作用于GPX4驱动肾癌细胞发生铁死亡。
蛇莓醇提物中成分众多,针对类似混合物的研究仅仅使用网络药理学分析的策略可能存在一定的局限性,结合液相-质谱技术对混合物的成分进行检测,随后再进行网络药理学分析可能对其药效成分的探索更具有科学性,本次研究仅仅在细胞层面上证实了蛇莓中的卫矛醇可能是一种铁死亡的驱动剂,但仍需要进一步在动物或者更多的细胞系上验证。
本次研究结果表明,蛇莓中的活性成分卫矛醇可能作为一种潜在的肾癌铁死亡诱导剂,通过降低GPX4的表达,驱动肾癌细胞发生ROS积累、脂质过氧化,进一步驱动肾癌细胞发生铁死亡,此研究有望为开发具有潜在抗RCC作用的新药提供理论基础。
