加味柴胡桂姜汤介导乳腺癌细胞黏附分子PSGL-1改善炎症-黏附-转移作用研究
2024-04-23陈丽华李文卉何美辰方春平胡晨霞
王 淼,陈丽华,李文卉,何美辰,方春平,胡晨霞
(广州中医药大学中药学院,广东 广州 510006)
乳腺癌是全球女性癌症死亡的主要原因,严重危害着女性的生命安全及身心健康[1]。三阴性乳腺癌(triple-negative breast cancer,TNBC)转移性强,预后差,死亡风险高,是乳腺癌研究领域长期未曾突破的难题[2],其传统治疗方法主要为手术治疗、化疗、放疗等。然而,原发肿瘤经手术或放、化疗等治疗数月甚至数年后,一些播散于体内的微转移肿瘤细胞,被重新“唤醒”引起复发和转移。
最新研究发现,体内炎症部位往往成为肿瘤转移灶的好发部位,转移器官炎症与临床休眠期后癌症复发高风险密切相关[3-4]。因此,探索炎症信号影响转移微环境诱导肿瘤复发机制,寻求阻断“炎症-癌转移”靶向药物,对预防和控制肿瘤复发转移,提高患者生存率意义重大。
中医认为乳腺癌多因患者气郁体质,加之七情内伤、肝郁化火、忧思伤脾,导致痰阻、气滞、瘀血相互凝结阻于乳络,日久成核成岩形成癌毒[5]。加味柴胡桂姜汤(Jiawei Chaihu Guijiang decoction,CGGD)由《伤寒论》柴胡桂枝干姜汤化裁而来,方中主药柴胡疏肝理气,桂枝、干姜辛行温通、温化痰饮,黄芩、白花蛇舌草清解热毒、湿毒,全蝎攻毒散结,全方共奏行气活血、化痰解毒之效[6]。临床实践证明,应用该方在乳腺癌术后肿瘤康复综合治疗方面,对改善患者气郁体质,抑制残存肿瘤细胞,缓解临床症状,预防肿瘤复发转移方面起到显著疗效[7-8]。
近期研究发现,一些在肿瘤细胞及中性粒细胞上高表达的黏蛋白能够与选择素相互作用参与癌症发展,成为预防或减轻癌症的治疗靶点。P-选择素糖蛋白配体-1(P-selectin glycoprotein ligand-1,PSGL-1)是由糖基转移酶对支架蛋白的翻译后修饰形成的聚糖结构,是L/P/E-3种选择素的最佳配体,在中性粒细胞迁移过程中发挥重要作用[9]。我们前期研究发现黏附分子PSGL-1在高转移乳腺癌中异常表达,提示炎症微环境下募集的中性粒细胞表面L-selectin与其配体PSGL-1结合可能是炎症诱导癌转移的关键路径。
本实验选择高转移人乳腺癌MDA-MB-231细胞株,研究炎症微环境下PSGL-1异常表达对乳腺癌细胞增殖、黏附、侵袭迁移能力的影响及CGGD是否能够通过靶向调控PSGL-1干预乳腺癌上皮细胞-间充质细胞转化 (epithelial-mesenchymal transition, EMT)进程从而抑制细胞侵袭及迁移作用,为揭示中医经典方剂柴胡桂枝干姜汤针对乳腺癌“痰瘀结毒”核心病机重塑微环境防治肿瘤转移综合效应提供实验依据。
1 材料
1.1 细胞人源乳腺癌细胞MDA-MB-231细胞购自上海中乔新舟公司。
1.2 动物无特定病原体 (specific pathogen free ,SPF) 级SD大鼠,体质量(200±15)g,购自广州中医药大学实验动物中心,许可证号SCXK(粤)2018-0034,饲养于广州中医药大学中药学院动物房的SPF级屏障环境内。
1.3 药物及试剂CGGD药材:柴胡、桂枝、干姜、天花粉、黄芩、牡蛎、炙甘草、白花蛇舌草、全蝎(广州杏园春药房有限责任公司);脂多糖 (lipopolysaccharide, LPS)、顺铂、结晶紫粉末(美国Sigma公司);PSGL-1中和抗体(美国Bioxcell公司);青霉素链霉素溶液、0.25%胰蛋白酶-EDTA、DMEM培养基(美国Gibco公司);PAN南美胎牛血清(德国PAN-Biotech GmbH公司)、CCK-8检测试剂盒(美国Glpbio公司);BCA试剂盒(杭州弗德生物科技公司)。
1.4 仪器二氧化碳培养箱(上海力申有限公司);超净工作台(苏州净化科技有限公司);酶标仪(美国PerkinElmer公司);倒置显微镜(Motic公司);立式压力蒸汽灭菌锅(上海申安公司);恒温摇床(上海知楚仪器有限公司);化学发光仪(上海天能科技有限公司);冷冻高速离心机(上海天美服务平台)。
2 方法
2.1 制备CGGD含药血清按原方比例称取CGGD药材各组分,10倍质量纯水浸泡1 h,微沸回流,收集药液并浓缩。大鼠随机分2组,给药组大鼠灌胃3 mL药物浓缩液,2次/ d,连续给药7 d;空白对照组灌胃等体积纯水。给药最后1 d大鼠提前禁食,戊巴比妥麻醉,分离主动脉采血,室温静置4 h,高速离心取上清,56 ℃水浴30 min,恢复至室温后-80 ℃冰箱保存。
2.2 乳腺癌黏附分子PSGL-1异常表达分析使用癌症基因组图谱TCGA (http://cancergenome.nih.gov/)数据库,对不同类型乳腺癌肿瘤组织PSGL-1表达进行分析,预测PSGL-1与肿瘤生长、转移之间的关系。
2.3 实验分组及药物处理将MDA-MB-231细胞分组:Control组(含10%大鼠空白血清)、Cisplatin组(含2.5 mg·L-1Cisplatin+10%大鼠空白血清)、CGGD低剂量组(CGGD-L:7.5%大鼠空白血清+2.5%含药血清)、CGGD中剂量组(CGGD-M:5%大鼠空白血清+5%含药血清)、CGGD高剂量组(CGGD-H:10%含药血清),分组给药进行实验,筛选含药血清最佳给药浓度。
2.4 细胞增殖及黏附能力检测处于对数生长期的MDA-MB-231细胞接种于96孔板中,每孔5.0×103个细胞,置于培养箱中培养24 h后分组给药,采用CCK-8法在450 nm检测细胞吸光度,测定各组细胞活性。制备明胶溶液,均匀铺于24孔板,洗涤备用。细胞给药后重悬,计数,按照2×105个/孔接种于铺好明胶的24孔板中,培养2 h后移除培养基,洗涤,固定,透化,染色,倒置显微镜观察并拍照,ImageJ软件分析计数。
2.5 细胞迁移能力检测将细胞接种于6孔板中,7×105个/孔,待细胞密度达80%~90%,枪头垂直刮擦形成划痕,PBS洗涤后于倒置显微镜下拍照记录0、12、24 h划痕的区域大小,Image J软件分析划痕面积,计算划痕愈合率。划痕愈合率=[(0 h划痕面积-观察时间点划痕面积)/ 0 h划痕面积]×100%。
2.6 检测细胞侵袭能力将基质胶稀释后均匀铺于Transwell小室,培养箱凝胶1 h,细胞分组给药后重悬,计数,按照2×104个/孔接种于Transwell上室,下室加入含30% FBS的完全培养基,48 h后移除培养基,棉签擦去未侵袭细胞,洗涤,固定,透化,洗涤后染色,倒置显微镜观察并拍照,Image J软件分析计数。
2.7 检测MDA-MB-231细胞黏附分子转录水平表达细胞分组给药后提取总RNA,逆转录成cDNA,进行PCR扩增,通过荧光强度变化对PCR反应进行实时监测,BioRadCFX Manager软件分析扩增曲线和图谱。
2.8 检测MDA-MB-231细胞黏附分子及EMT基因蛋白水平表达细胞分组给药后提取蛋白,BCA法测量蛋白浓度,加样,SDS-PAGE电泳分离转移至PVDF膜后,5%脱脂牛奶封闭3~4 h,TBST清洗3次,一抗4 ℃孵育过夜,二抗室温孵育1 h,化学发光凝胶成像系统曝光,Image J软件分析目的条带灰度值,观察各组蛋白表达。
3 结果
3.1 CGGD含药血清浓度筛选CCK-8实验结果表明,CGGD处理细胞48 h和72 h后,药物低、中、高剂量均能抑制MDA-MB-231细胞增殖,高剂量组最为明显(P<0.05,Fig1A);细胞黏附实验表明,CGGD-H组细胞黏附数较Control组降低(P<0.01,Fig1B-C);Transwell实验及细胞划痕实验显示,相比Control组,CGGD-H组细胞侵袭迁移数降低(P<0.01,Fig1D-G)。提示CGGD-H能够抑制MDA-MB-231细胞增殖、黏附、侵袭及迁移能力。
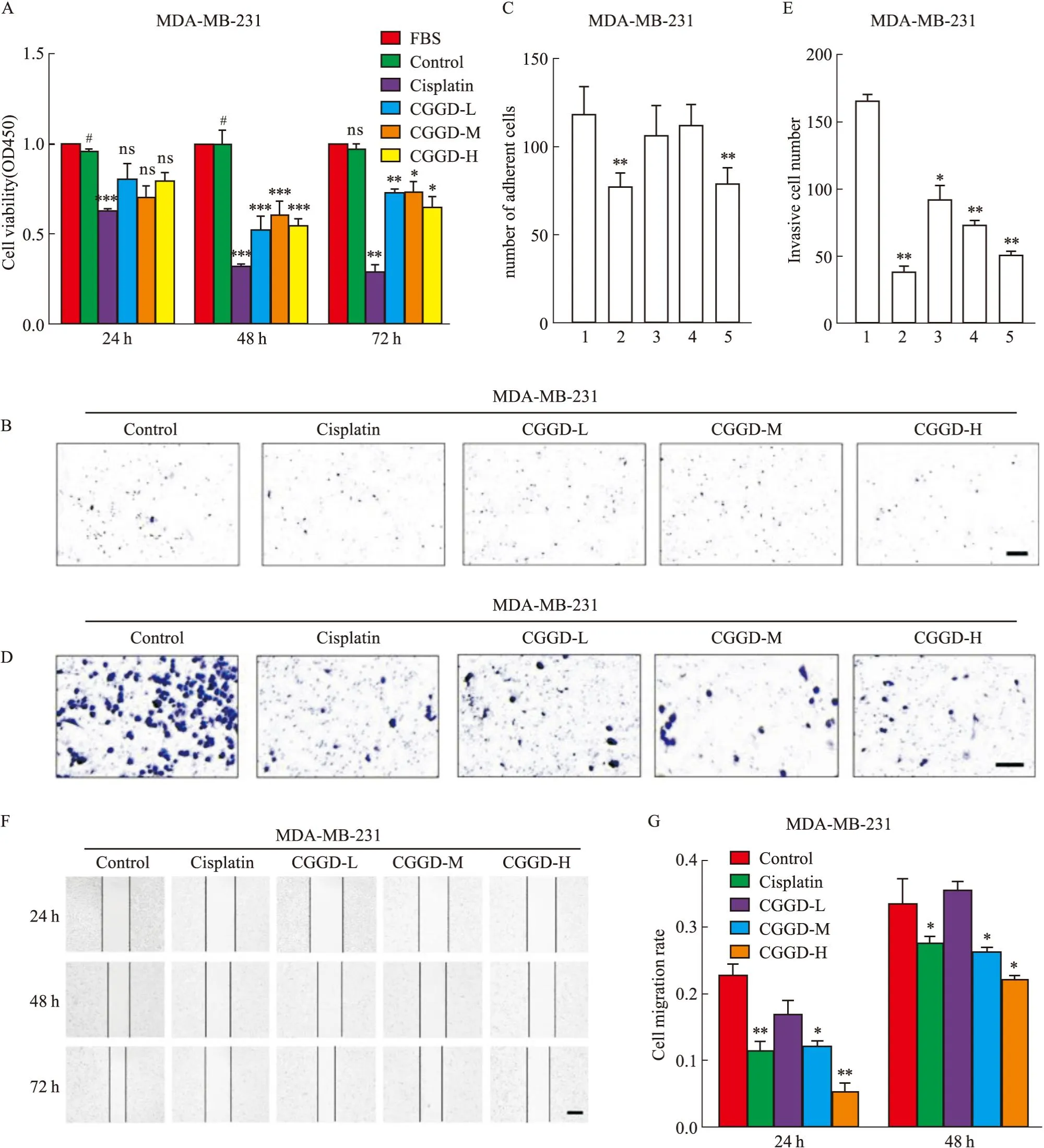
Fig1 Effect of CGGD on cell biological behavior
3.2 乳腺癌黏附分子PSGL-1在乳腺癌组织及细胞中异常表达
3.2.1不同亚型乳腺癌肿瘤组织中PSGL-1表达 TCGA数据库分析表明,不同亚型乳腺癌患者肿瘤组织PSGL-1表达均高于癌旁组织(P<0.01,Fig2A),原发性和转移性乳腺癌肿瘤组织PSGL-1表达高于癌旁组织(P<0.01,Fig2B-C),差异均具有统计学意义。
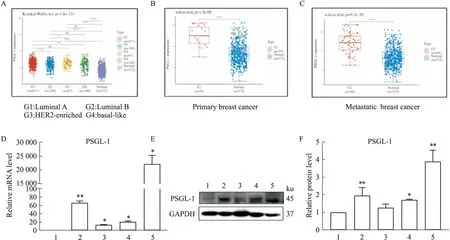
Fig2 Abnormal expression of adhesion molecule PSGL-1 in breast cancer tissue and cells
3.2.2黏附分子PSGL-1在不同转移能力乳腺癌细胞中的表达 qRT-PCR、Western blot实验检测中性粒细胞及不同转移能力乳腺癌细胞中黏附分子PSGL-1的表达。结果显示,高转移乳腺癌MDA-MB-231及4T1细胞PSGL-1表达高于低转移细胞MCF 7,差异具有统计学意义,(P<0.05,Fig2D-F)。
3.3 CGGD调控PSGL-1对乳腺癌细胞生物学行为的影响
3.3.1CGGD介导PSGL-1对细胞增殖及黏附能力的影响 收集MDA-MB-231对数生长期细胞,分为Control组(大鼠空白血清)、LPS模型组(LPS:大鼠空白血清+5 mg·L-1LPS)、PSGL-1中和抗体组(anti PSGL-1:大鼠空白血清+LPS+6 mg·L-1PSGL-1中和抗体)、CGGD高剂量组(CGGDH:10% CGGD+LPS)、联合治疗组(CGGDH+ anti PSGL-1)。实验结果显示,LPS刺激细胞后增殖能力无明显变化(P>0.05),但是细胞黏附能力显著增加(P<0.01,Fig3B-C);给药24 h后,药物组细胞增殖及黏附能力较LPS组明显降低(P<0.01,Fig3A-C)。

Fig3 CGGDH regulated ability of PSGL-1 to affect cell biological behavior
3.3.2CGGD通过调控PSGL-1对细胞侵袭及迁移能力的影响 Transwell实验结果表明,相比Control组,LPS组细胞侵袭数目增多;anti PSGL-1、CGGDH及联合给药组细胞侵袭数较LPS组减少;联合给药组细胞侵袭能力较单独CGGDH组增强(P<0.01,Fig3D-E);细胞划痕实验表明,LPS刺激后细胞迁移能力较Control组增强;与LPS组比较,anti PSGL-1、CGGDH及联合组细胞迁移能力降低;联合给药组迁移能力较单独CGGDH组升高(P<0.01,Fig3F-G)。
3.4 CGGD对乳腺癌黏附分子mRNA水平表达的影响实验结果显示,LPS刺激后细胞PSGL-1、P-selectin、L-selectin在mRNA水平表达较Control组升高;anti PSGL-1、CGGDH组与LPS组比较,黏附分子表达降低;联合治疗组较CGGDH组表达升高(P<0.05,Fig4A-C)。
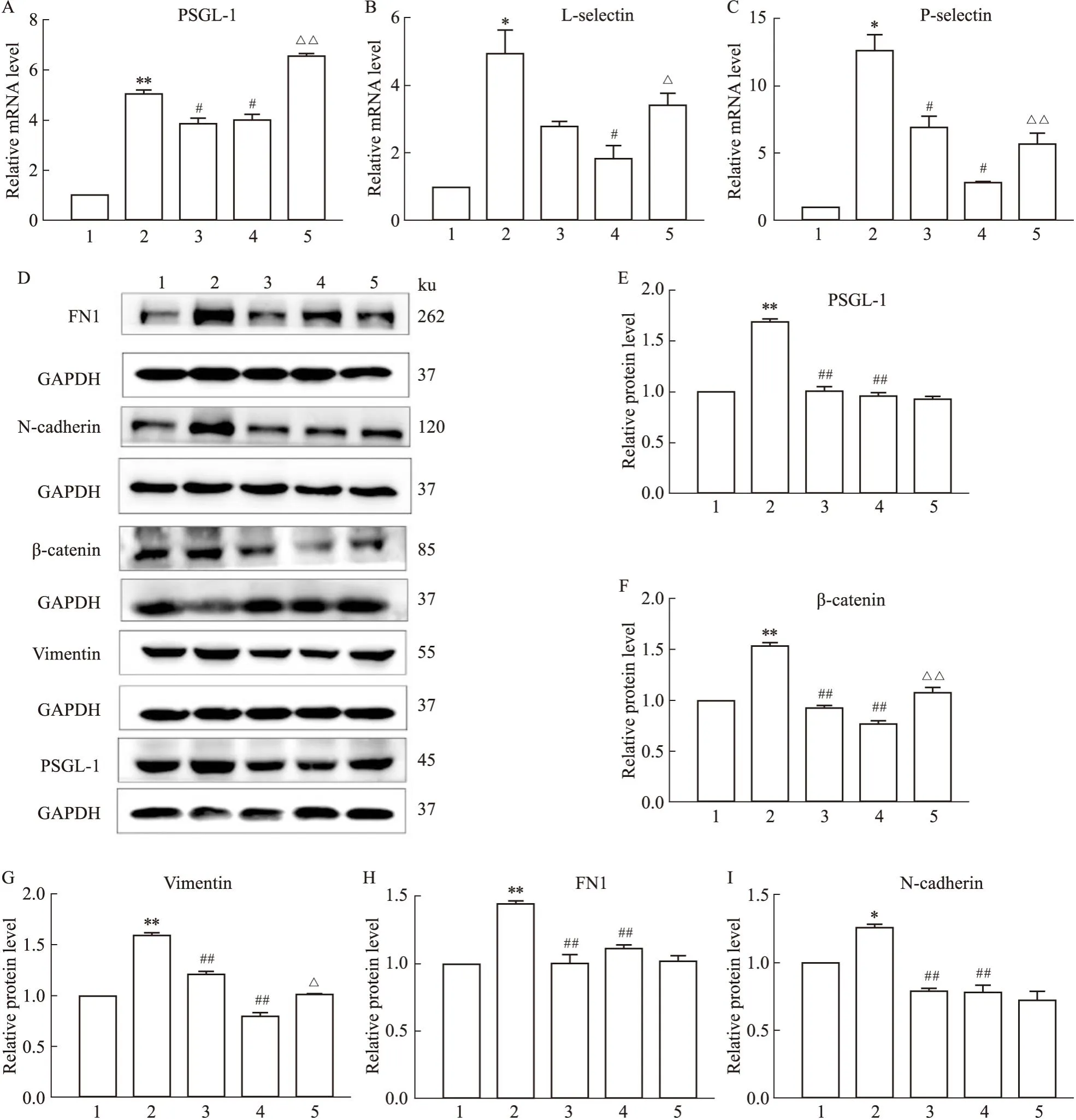
Fig4 Changes in transcription and protein expression of cell adhesion molecules and EMT related genes in breast cancer )
3.5 CGGD对乳腺癌黏附分子及EMT相关基蛋白水平表达的影响Western blot实验结果显示,LPS组细胞黏附分子及EMT相关基因表达较Control组升高(P<0.05);与LPS组相比,anti PSGL-1、CGGDH组蛋白表达降低(P<0.05,Fig4D-H)。表明LPS能够促进肿瘤细胞PSGL-1表达及EMT进程,且能被CGGDH抑制,联合给药组能逆转这种抑制作用(P<0.05),提示CGGDH的抑制作用可能是通过介导PSGL-1实现的。
4 讨论
TNBC是最具有攻击性的乳腺癌亚型,其特征是ER、PR和HER2的阴性表达,由于相关受体均不表达,无法从内分泌治疗及传统抗HER-2靶向治疗中获益,复发转移仍是TNBC术后患者的主要致死原因[10]。中医药在预防肿瘤复发转移、延长生存期、改善生存质量方面具有较强优势。
炎症肿瘤微环境是由肿瘤细胞及周围浸润的炎细胞、基质细胞、趋化因子、细胞因子等构成。炎细胞一方面可以分泌大量细胞因子和毒性介质以发挥抗肿瘤免疫效应,另一方面也可以诱导促炎因子、趋化因子以及蛋白酶的释放,引起氧化损伤、DNA突变和微环境变化,影响组织代谢,促进细胞恶性转化,在肿瘤的发生、存活、侵袭和转移阶段起着决定性作用[11]。研究发现,肿瘤炎症微环境中聚集大量炎症因子、黏附分子等,为播散癌细胞提供适宜的转移前生态位[12]。LPS是革兰阴性菌外壁的成分,它由脂质A、核心寡糖和O抗原构成,可以通过促进免疫细胞浸润,形成免疫抑制,诱导炎症肿瘤微环境的形成,从而促进体内外肿瘤细胞的增殖、迁移、侵袭和转移过程[13]。本研究运用LPS作为炎症诱导剂,刺激乳腺癌MDA-MB-231细胞形成肿瘤炎症微环境,结果表明,LPS(5 mg·L-1)能够增强乳腺癌细胞黏附、侵袭及迁移能力。
黏附分子(adhesion molecules ,AM)是介导细胞与细胞、细胞外基质之间相互接触和黏附的分子,它通过与其特异性配体结合,参与细胞辨识、活化、信号传导、细胞增殖分化和移动且在维持正常组织结构、胚胎发育和分化、炎症与免疫应答、凝血与血栓形成、伤口修复、以及肿瘤浸润和转移等多种生理、病理过程中发挥重要作用[14]。选择素(selectin)是黏附分子家族中的一大类,分为L、P、E 3种。其中PSGL-1是3种选择素的最佳配体,广泛表达在中性粒细胞表面,介导中性粒细胞迁移[15]。最新临床和实验证据表明,一些转移性较强的癌症包括结肠癌、胃癌、胰腺癌和肺癌等,在癌症进展期间,其糖基化蛋白质上检测到PSGL-1[16]。研究表明,肿瘤细胞转移和传播过程中,肿瘤细胞表达的PSGL-1可以与活化血小板P-selectin及中性粒细胞表面L-selectin结合,使肿瘤细胞、血小板、中性粒细胞组成独特聚集体,提高肿瘤细胞对机体免疫细胞杀伤及血流剪切的抵抗力,并通过TGF-β和NF-κB途径激活诱导EMT,增强肿瘤细胞聚集体的转移性[17]。因此,阻断选择素及其特异性配体的结合可能是阻止癌症转移的重要环节。本实验研究结果表明乳腺癌黏附分子PSGL-1在高转移性乳腺癌组织及细胞中异常表达,且PSGL-1能够促进乳腺癌细胞黏附、侵袭和迁移能力,提示PSGL-1与乳腺癌发展、侵袭及转移密切相关。
肿瘤炎症微环境大量炎性细胞浸润、黏附及癌栓形成与乳腺癌“痰瘀结毒”核心病机具有高度相似性。临床应用CGGD针对乳腺癌患者,在改善气郁体质、缓解临床症状、减轻放化疗副作用及预防肿瘤复发转移等术后康复治疗方面疗效较好[18]。前期我们研究发现,CGGD能够抑制小鼠乳腺癌移植瘤生长及肺转移,可降低小鼠原发灶选择素P-selectin及EMT标志物Vimentin、N-Cadherin表达。本实验进一步探讨其是否能够通过介导选择素配体改善肿瘤炎性微环境作用机制,结果表明CGGD能抑制由LPS诱导的乳腺癌细胞黏附、侵袭和迁移能力的增强,与PSGL-1中和抗体联合治疗组较CGGDH组抑制作用降低,提示PSGL-1可能是CGGD的靶点之一,其具体分子机制有待后续进一步应用过表达PSGL-1稳转乳腺癌细胞株及小鼠动物模型开展研究。
