放线菌4-1的鉴定及其发酵液抑菌作用和稳定性探究
2024-04-23郭宇豪刘绍波葛菁萍平文祥
郭宇豪,刘绍波,葛菁萍,2,平文祥,2
(1黑龙江大学,生命科学学院,农业微生物技术教育部工程研究中心,黑龙江省寒区植物基因与生物发酵重点实验室,黑龙江省普通高校分子生物学重点实验室,哈尔滨 150080;2河北环境工程学院,河北省农业生态安全重点实验室,河北秦皇岛 066102)
0 引言
放线菌是产生抗生素的重要的微生物资源。其中链霉菌属(Streptomycessp.)产生的抗生素物质超过7000 种,占微生物来源的活性物质的一半以上[1]。探索稀有放线菌并寻找有价值的活性物质是目前的科学研究热点[2]。
目前人们已经从不同来源的放线菌中分离得到多样化的抑菌物质,例如从蛇藤(Kennedianigriscan)中分离得到内生放线菌StreptomycesNRRL 30562[3],其产生对结核分枝杆菌(Mycobacteriumtuberculosis)有抑制作用的抗生素物质munumbicins A,B,C,D;从高良姜(Alpiniagalanga)的根部分离得到活性化合物Actinomycin D[4],可以有效抑制香蕉炭疽病(Colletotrichummusae)[5]和白色念珠菌(Candida albicans)的生长[6]。放线菌MSU-2110(Streptomycessp.)分离自龟背竹(Monsterasp.),其发酵产物中具有对植物病原真菌有抑制活性的多肽类抗生素coronamycin[7]。而来自于陕西秦岭山区土壤中的放线菌Z139对小麦白粉病的保护作用达到98.6%,对其治疗作用达到86.1%[8]。分离自京郊菜园土壤的吸水链霉菌(Streptomyceshygroscopicus)[9],对果蔬灰霉病菌(Botrytiscinerea)[10]、番茄早疫病菌(Phytophthora infesta)[11]抑制作用相对较强。SINGH等[12]从印度哈里亚纳邦的农业土壤中分离出链霉菌活性微生物菌株,可以有效地抑制金黄色葡萄球菌(Staphylococcusaureus)和铜绿假单胞菌(Pseudomonasaeruginosa)的活性。
放线菌在土壤微生物中占有很大比例[13-14],虽然土壤被认为是分离不同潜力放线菌的极好来源,但目前国内外研究重点是探索不同寻常和以前被忽视的生态系统[15]。因此极端环境中生长的微生物成为研究的侧重点。极端环境包括强酸碱、高盐度、高辐射、高温和低温等[16]。极端微生物产生的新型活性物质使其对极端生活环境有较强的适应性[17]。由于极端环境中的特殊生存条件,使得极端微生物的物种、遗传和代谢机制具有丰富的多样性。并且为了适应极端的生存环境,极端微生物具有产生多种生理活性物质的潜力[18]。极端环境放线菌中的嗜盐碱放线菌是一类适宜生存在一定的盐浓度环境中的革兰氏阳性细菌,已经成为了目前极端环境放线菌研究的主要类群之一[19]。研究人员已从极端环境放线菌中发现了许多具有发展前景的优异菌种[20-21],但是大多数菌种受到生产应用的限制。
课题组之前从黑龙江省肇东市锦绣大地试验基地土壤中分离获得了若干放线菌。该地区地处北纬46°2'23.1'',东经125°55'57.2'',土壤为碱化草甸土类型,pH高达9.90,盐度含量达到0.12%,符合盐碱地区的特点。本研究对其中高盐胁迫下生长最好的4-1进行菌株鉴定及发酵液抑菌活性和稳定性测定。对分离自该生境下的放线菌种类及其产生的代谢物质进行摸索,将有利于扩大极端环境下的微生物资源挖掘及利用。
1 材料和方法
1.1 试验用菌株
实验室前期从肇东市锦绣大地试验基地分离出10 株放线菌,经过耐盐胁迫试验发现,菌株4-1 在7%盐含量下培养可以正常生长,说明其可以耐受高盐胁迫,因此选用于后续试验。
指示细菌包括变形杆菌(Proteusvulgaris),大肠杆菌(Escherichiacoil),金黄色葡萄球菌(Staphylococcus aureus),枯草芽孢杆菌(Bacillussubtilis),铜绿假单胞菌(Pseudomonasaeruginosa)等。
指示真菌包括禾谷镰刀菌(Fusarium graminearum),小麦赤霉菌(Gibberellazeae),瓜果腐霉菌(Pythiummelonii),辣椒根腐菌(Phytophthorapepper)等。
1.2 各菌株所用培养基及培养方式
各指示细菌以1%接种量接入Beef extract Peptone(BP)培养基(g/L)后,37℃,160 r/min振荡培养24~48 h,获得对数生长期菌体;各指示真菌点植于PDA培养基(g/L)中,30℃静止培养后获得菌丝体。将斜面保藏的放线菌4-1 菌株接种到ISP 2 培养基(g/L)(葡萄糖4 g,麦芽浸粉10 g,酵母提取物4 g,pH 7.2~7.4),28℃,140 r/min 下摇床振荡培养7 d,活化4-1 菌株。将过夜培养的4-1 菌株采用三区划线的方法将菌株4-1 转接到ISP 2 固体培养基中,28℃培养箱倒置培养3 d。连续传代培养3~5 代,分别挑取长势良好的单菌落作为出发菌株,进行后续试验。
以琼脂扩散法进行抑菌试验,其中下层为2%的水琼脂培养基,上层为半固体BP培养基。
淀粉水解试验、明胶液化试验、脲酶试验、纤维素水解试验、硝酸盐还原检测、碳源利用试验所需培养基参考文献[22]和[23],在进行碳源利用试验时,在培养基中加入0.5%(g/L)的葡萄糖、半乳糖、乳糖、麦芽糖、肌醇、甘露醇、甘露糖、鼠李糖。
1.3 试验方法
1.3.1 土壤放线菌4-1的鉴定
(1)菌株4-1菌落形态及菌丝形态观察
在ISP 2 液体培养基中接入菌株4-1 的单菌落,180 r/min 振荡培养7 d,在显微镜下观察细胞形态;采用插片法制片,将菌丝完全覆盖在载玻片上,置于显微镜下观察其菌丝形态。
(2)菌株4-1分子生物学测定
采用细菌基因组DNA提取试剂盒(天根生化科技有限公司,目录号DP307-02)提取菌株4-1 基因组DNA。以27F(5’-AGAGTTTGATCCTGGCTC-3’)和1492R(5’-CGGCTACCTTGTTACGACTT-3’)为扩增引物,以细菌基因组为模板进行PCR 扩增,片段全长分别为1509 bp。
向PCR产物中加入0.25µLTaq DNA聚合酶(5 U/μL),在72℃恒温水浴下反应10 min。用DNA 琼脂糖凝胶回收试剂盒(天根生化科技有限公司,目录号DP209)回收目的片段。以DL 2000 为Marker,扩增结果通过1%琼脂糖凝胶电泳检测。
将pMDTM18-T 载体与回收纯化的PCR 产物16℃过夜连接,利用热激法向E.coliDH5α 感受态细胞中转入连接产物,复苏后梯度稀释涂布于LB 琼脂平板(200 mg/mL IPTG、100 μg/mL Amp 和20 mg/mL X-gal)上,37℃过夜培养进行蓝白斑筛选。
在上海生工生物工程股份有限公司进行菌液测序并上传至NCBI进行比对。选择同源性相近种属的序列信息下载,并利用MEGA4.0 软件构建系统发育树,确定放线菌4-1的种属地位。
(3)生理生化特性测定
参照《放线菌的分类和鉴定》[24]对菌株4-1 进行淀粉水解试验、明胶液化试验、过氧化氢酶试验、脲酶试验、纤维素水解试验、硝酸盐还原试验、碳源利用试验,初步推测菌株4-1所在的种属分类。
1.3.2 菌株4-1 生长曲线的绘制菌株4-1 活化后,按1%接种量接入ISP 2 培养基中,并每隔24 h 测定菌体干重,菌体干重(DCW)的计算见公式(1)。以时间为横坐标,DCW为纵坐标绘制菌株的生长曲线。
1.3.3 4-1 发酵液抑菌活性测定将菌株4-1 以1%接种量接入ISP 2 培养基中,28℃,180 r/min 摇瓶发酵培养7 d,取1 mL发酵,4000 r/min,室温离心10 min,取上清液备用。以添加ISP 2培养基作为对照组。
采用琼脂扩散法检测病原性细菌抑菌活性,下层培养基为2%的水琼脂,上层培养基为半固体BP。指示菌浓度为107cfu/mL,测量抑菌圈直径,重复3 次。
采用菌丝生长速率抑制法检测植物病原真菌抑菌活性。在加入发酵上清液的PDA 固体培养基中心点植直径为4~5 mm 的供试真菌菌饼,培养7 d。以培养基作为对照,每个处理重复3 次。采用十字交叉法测定菌落直径。菌丝生长抑制率见公式(2):
1.3.4 4-1发酵液稳定性的测定
(1)发酵液酸碱稳定性测定。分别用l mol/L HCl溶液和1 mol/L NaOH溶液将菌株4-1的发酵液调节至pH 2.0~12.0。在室温下放置1 h 后,将各处理组的pH值调节到与原始菌株发酵液pH值相同(pH 7),以金黄色葡萄球菌(Staphylococcusaureus)为指示菌,参照1.3.3 测定抑菌活性,以原始发酵液为对照,重复3 次。以相对抑菌活性评价抑菌能力。相对抑菌活性见公式(3)。
(2)发酵液热稳定性测定。将菌株4-1 发酵液于50、60、70、80、90、100℃下分别处理10 min 和30 min后,放置至室温后测定其抑菌活性,以金黄色葡萄球菌(Staphylococcusaureus)为指示菌,参照1.3.3 测定抑菌活性,以原始发酵液为对照,重复3次。以相对抑菌活性评价抑菌能力。
(3)发酵液紫外线稳定性测定。将菌株4-1 菌株发酵液静置在波长254 nm,功率20 W的紫外灯下,高度为30 cm左右,放置时间为5、15、30、60、120 min,以金黄色葡萄球菌(Staphylococcusaureus)为指示菌,参照1.3.3 测定抑菌活性,以原始发酵液为对照,重复3次。以相对抑菌活性评价抑菌能力。
2 结果与分析
2.1 土壤放线菌4-1的鉴定
放线菌4-1 的革兰氏染色结果为阳性(图1A),菌丝粗细介于4.5±0.1~5.8±0.1 μm。菌落中间呈紫红色,表面隆起且光滑,边缘白色,菌落质地柔软。利用插片法观察可见基内菌丝纤细,易断裂,气生菌丝较粗,分化形成孢子链,孢子呈链状且弯曲,有分支,孢子椭圆状或长圆状,表面光滑。单菌落形态及菌丝形态如图1B所示。

图1 4-1菌体形态A(1600×)以及单菌落B形态(640×)
2.2 分子生物学鉴定结果
提取放线菌4-1 基因组及PCR 扩增并测序后(图2A),得到1329 bp 片段,选取30 条同源性高于99%的16S rDNA 构建系统发育树,由图2B 可知,与菌株4-1分支最近且相似度最高的是紫赤链霉菌(Streptomycespuniceus)。
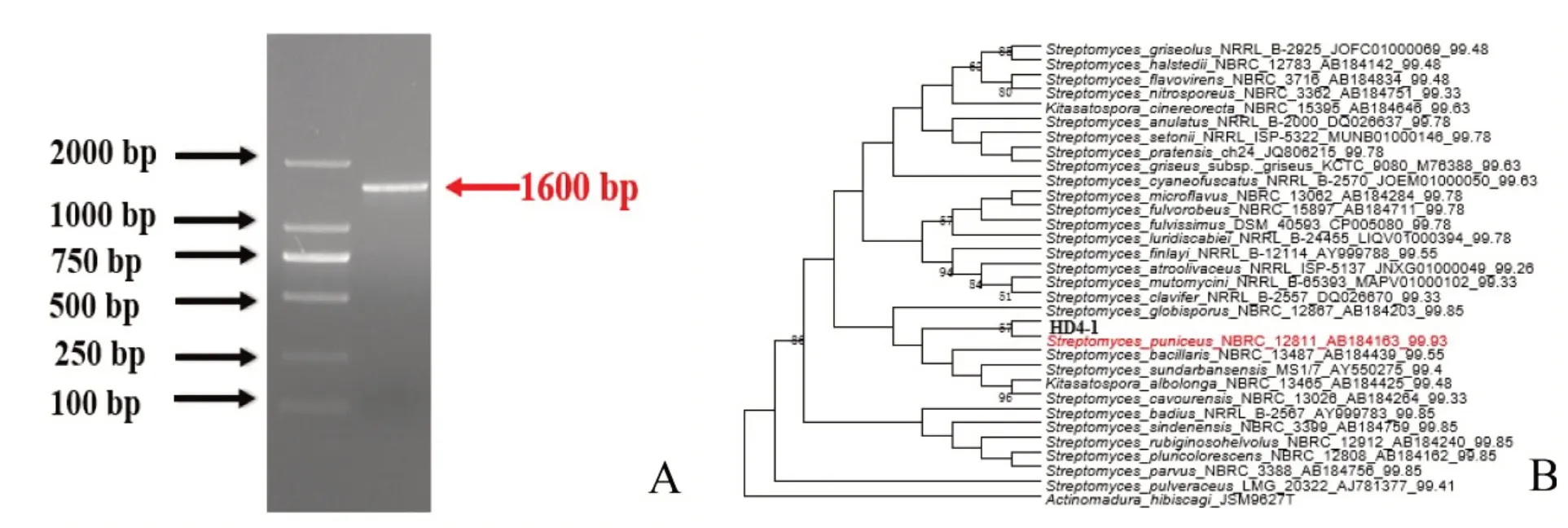
图2 16S rDNA扩增产物电泳图A以及系统发育树B
2.3 菌株4-1生理生化特性
生理生化特性表明,菌株4-1 可以水解淀粉并液化明胶,不能产生过氧化氢酶、尿酶和硫化氢、不能还原硝酸盐和分解纤维素。可以利用半乳糖、葡萄糖、肌醇、乳糖、甘露糖、麦芽糖、鼠李糖。NaCl 耐受范围是0%~7%。
综合形态、生理生化结果和16S rDNA测序结果,菌株4-1 初步鉴定为紫赤链霉菌(Streptomyces puniceus)。
2.4 紫赤链霉菌(Streptomyces puniceus)4-1对病原性细菌的抑制作用
采用琼脂扩散法测定了紫赤链霉菌(Streptomyces.puniceus)4-1 菌株发酵液对供试病原性细菌的抑制作用。由表1 可知,紫赤链霉菌(Streptomycespuniceus)4-1 发酵液对革兰氏阳性细菌有较强的抑制作用,对革兰氏阴性菌的抑制作用较弱。其中金黄色葡萄球菌(Staphylococcusaureus)和枯草芽孢杆菌(Bacillussubtilis)抑菌圈直径最大,而且抑菌圈非常透明;对其余革兰氏阳性菌的抑菌活性次之。在选取的供试革兰氏阴性细菌中,仅对铜绿假单胞菌(Pseudomonasaeruginosa)有较强活性,但抑菌圈并不完全透明,仅为清晰。
2.5 紫赤链霉菌(Streptomyces puniceus)4-1对植物病原真菌的抑制作用
采用菌丝生长速率抑制法测定紫赤链霉菌(Streptomycespuniceus)4-1 发酵液对供试植物病原真菌的抑制作用。紫赤链霉菌(Streptomycespuniceus)4-1 对5 种供试真菌的抑制作用相对较弱(表2),有3 种供试菌株生长抑制率在50%以下,其中禾谷镰刀菌(Fusariumgraminearum)的生长抑制率最高,达到了70%。

表2 紫赤链霉菌(Streptomyces puniceus)4-1发酵液对植物病原真菌菌丝生长的抑制作用
2.6 紫赤链霉菌(Streptomyces puniceus)4-1发酵液稳定性测定
(1)酸碱对发酵液稳定性的影响
紫赤链霉菌(Streptomycespuniceus)4-1 菌株的发酵液对酸碱稳定性的测定结果如图3 所示。发酵液pH在5~12之间时相对抑菌活性波动小,在1 h后指示菌的相对抑菌活性约在94%~100%之间,与对照组的原始发酵液相差不大,差异不显著(P>0.05)。在pH为2 时,相对抑菌活性为86.7%,与对照组差异显著(P<0.05)。由此可见,紫赤链霉菌(Streptomycespuniceus)4-1菌株的发酵液在中性和碱性条件下稳定,在较强酸性条件下(pH 2~4)稳定性较差。

图3 紫赤链霉菌(Streptomyces puniceus)4-1发酵液的酸碱稳定性
(2)热对发酵液稳定性的影响
紫赤链霉菌(Streptomycespuniceus)4-1 菌株的发酵液对热稳定性的测定结果如图4所示。当温度处于50℃~90℃之间时,发酵液的抑菌成分有极强的热稳定性,在80℃下仍有87.1%的相对抑菌活性。当温度大于90℃时,发酵液的相对抑菌活性低至75.1%,已有明显下降,与对照组的原始发酵液差异显著(P<0.05),且随着高温时间的延长,相对抑菌活性也逐渐降低。由此可以看出,紫赤链霉菌(Streptomyces puniceus)4-1菌株发酵液的抑菌成分对温度较耐受,但在高温条件下(T>90℃)不稳定。
(3)紫外线对发酵液稳定性的影响
紫赤链霉菌(Streptomycespuniceus)4-1 菌株的发酵液对紫外线稳定性的测定结果如图5所示。在紫外线照射处理120 min 内,与0 h 的原始发酵液相比,发酵液的相对抑菌活性均没有太大的变化,差异均不显著(P>0.05)。说明菌株发酵液的抑菌成分对紫外线有良好的稳定性。
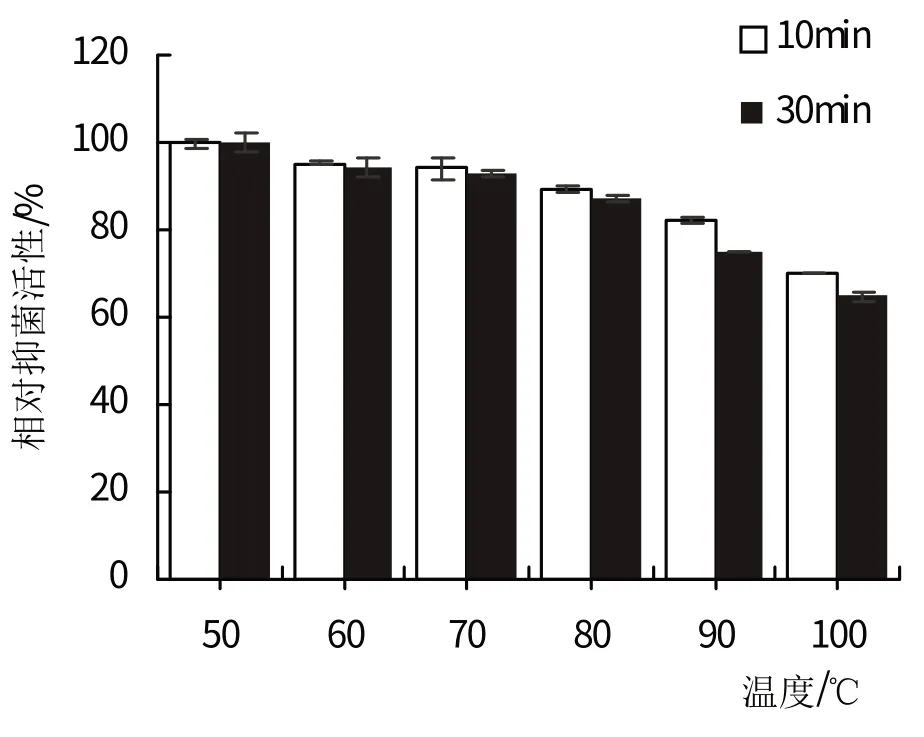
图4 紫赤链霉菌(Streptomyces puniceus)4-1发酵液的热稳定性
3 讨论
本研究中所分离获得的土壤放线菌4-1来自盐碱地带,通过形态、生理生化结果和16S rDNA基因序列分析结果发现[25],该菌株与紫赤链霉菌(Streptomyces puniceus)同源性最高。链霉菌属(Streptomycessp.)是放线菌中分布最广且产生抗生素种类最多的种属之一[26],具有重要的应用价值[27],因此也使本研究中获得的4-1 具有更好地潜在应用性。紫赤链霉菌(Streptomycespuniceus)4-1 发酵液对大部分革兰氏阳性细菌和部分革兰氏阴性细菌有较强的抑制作用,然而这些作用在一定程度上受到环境变化的影响,这也是很多链霉菌发酵液的特点,同时与其他来源菌株相比,4-1发酵液的抑菌及稳定性也具有较大优势。例如枯草芽孢杆菌(Bacillussubtilis)WL2 菌株分离自马铃薯晚疫病病叶,具有抑制致病疫霉菌丝体生长的功能[28],与紫赤链霉菌(Streptomycespuniceus)4-1 相比较,4-1发酵液在强碱性、高温和紫外条件下有更好的稳定性;而陈超等[29]分离出的葡萄座腔菌(Botryosp haeriadothidea)的发酵液热稳定性比紫赤链霉菌(Streptomycespuniceus)4-1要更加稳定,但酸碱和紫外稳定性却较差。赵雅等[30]分离出的贝莱斯芽胞杆菌(Bacillusvelezensis)HN-Q-8菌株的发酵液具有远超紫赤链霉菌(Streptomycespuniceus)4-1 发酵液的热稳定性,但在强酸强碱和紫外条件下的稳定性却难以与之相比。由此可以看出,紫赤链霉菌(Streptomyces puniceus)4-1的抑菌活性以及稳定性受环境影响较大,其发酵液在酸碱和紫外条件下的生物活性远高于正常环境下的部分放线菌,且稳定性也更强。但是相对而言,其热稳定性与正常环境下的放线菌相比却略有不足,尤其当温度高于90℃以上时,发酵液抑菌活性明显下降。紫赤链霉菌(Streptomycespuniceus)4-1 是生存于盐碱地带的放线菌,对于盐碱胁迫有较高的耐受性。但可能长期驯化于北方寒冷气候环境下,其代谢产物稳定性在高温时会有所下降。

图5 紫赤链霉菌(Streptomyces puniceus)4-1发酵液的紫外稳定性
4 结论
研究表明本课题组从盐碱环境中分离得到的菌株4- 1 经综合鉴定为紫赤链霉菌(Streptomyces puniceus)。菌株4-1对6株病原性细菌和5株病原性真菌有抑制作用,其发酵液对酸碱、热、紫外线都有较好的稳定性,但在强酸性条件(pH<4)以及高温条件(T>90℃)下,发酵液抑菌活性下降。以上实验说明紫赤链霉菌(Streptomycespuniceus)4-1 在抑菌作用与稳定性上有较大的开发价值,可为其抑菌作用的次生代谢产物的挖掘利用提供理论基础和参考。
