甘蓝型油菜高亚麻酸CMS的快速选育方法及效果研究
2024-04-23张耀文董育红关周博韦世豪李殿荣李少钦梁峰志
张耀文,董育红,关周博,韦世豪,李殿荣,李少钦,梁峰志
(陕西省杂交油菜研究中心,陕西杨凌 712100)
0 引言
亚麻酸摄入不足已成为中国人群亚健康、慢性疾病(心脑血管疾病)发病率上升的一个重要原因[1-2]。由于缺乏ω3/Δ15脂肪酸脱氢酶(FAD)人体无法将亚油酸转换成亚麻酸,因而必须依赖膳食中的亚麻酸来满足人体的需求[3-5]。近年来亚麻酸的消费量迅速增加,但生物资源较少、亚麻酸的产出量受限,已成为制约亚麻酸产品广泛应用的障碍因素[6-7],亟需寻找、开发新的亚麻酸资源来满足市场对亚麻酸产品的需求。因具有不含胆固醇、抗氧化性较好、提取加工成本低等优势,植物源亚麻酸的应用前景非常广阔[6]。人体摄入50%以上的脂肪酸来自于食用油[5,8],改善食用油的脂肪酸组成是提高人体亚麻酸摄入量的一条重要途径[9-11]。菜籽油是中国居民的重要食用油源也是富含亚麻酸的常用植物油[8,11-14],开展油菜高亚麻酸育种可有效缓解亚麻酸产品供给紧缺的现状。然而,双低育种(低芥酸、低硫苷)在从遗传上除去菜籽(油)中占50%左右的芥酸的同时使亚麻酸含量降低23.81%、亚油酸含量增加92.31%,导致亚油酸与亚麻酸的比例从1.24:1 提高到3.13:1[9-11,14];而营养学要求二者的比例为1:1。因而,基于营养健康的要求也需要提高菜籽(油)中的亚麻酸含量、改变亚油酸与亚麻酸的比例。2016年李殿荣提出在油菜育种中应适当提高亚麻酸含量的建议[15],随后逐步形成了油菜高亚麻酸育种的概念和策略[11,16]。张耀文等[11]、LI 等[17]、于澄宇等[18]、余顺波等[19]、陈俊坤等[20]均已筛选出亚麻酸含量高于15%的甘蓝型油菜种质。柴友荣等[21]、杜卓霖[22]分别在T3 代(导入紫苏PfFAD3基因)、‘中双11’(过表达亚麻荠FAD2和FAD3基因)中获得亚麻酸含量高于30%的甘蓝型油菜种质。张耀文等[7]构建了甘蓝型油菜高亚麻酸种质的筛选方法,育成高亚麻酸杂交种‘秦杂油7号’[11]。余顺波等[19]、陈俊坤等[20]分别育成高亚麻酸油菜新品系‘908’、‘油研712号’。徐劲松等[23]、于澄宇等[24]分别提出了油菜高油酸与高亚麻酸聚合育种,抗草甘膦高亚麻酸油菜的选育方法。
杂种优势利用是提高油菜产量和品质的重要途径,细胞质雄性不育(CMS)是油菜杂种优势利用重要的授粉控制系统之一[25]。由于CMS 提供了杂交种全部的细胞质和1/2 的细胞核基因,因此CMS 的性状对杂交种会有较大影响;对CMS性状的改良已成为油菜杂种优势利用研究的重要内容[26-28]。总所周知,油菜CMS 是原CMS 和保持系的杂交后代,每次测交的结果需要到下一个生殖生长季节才能获知。CMS 的育性稳定、基因纯合都需要5~6代的转育,因冬油菜属于跨年度作物为“2年1熟”、春油菜为“1年1熟”,所以在常规条件下需要5~6年甚至更长时间才能获得遗传稳定的CMS。CMS的品质和农艺性状受原CMS的细胞质和新(保持系)细胞核基因共同作用的影响,因细胞核中来源于保持系的基因比例不同、生长环境条件差异都会造成不同世代的CMS 的品质和农艺性状发生较大变化,需要对其品质农艺性状进行定向筛选才能获得具有目标性状的CMS。近红外分析法、气象色谱分析法均要求1 g以上的种子量才能进行亚麻酸含量的化验分析,而常规转育CMS获得的种子量难以满足化验分析要求,因而对其进行定向筛选的工作较难开展。来自不同部位(主花序、分枝)种子的含油量、亚麻酸含量的差异会影响对CMS 单株进行筛选的准确性。CMS的育性会影响杂交种杂种优势的发挥,异交结实率会影响制种产量[29-31],因此需要通过对不育性、异交结实性等进行综合筛选才能获得具有育种利用价值的CMS。同时,因传统的选育方法对保持系进行了5~6代的连续自交会造成品质、农艺性状发生退化,降低CMS、保持系在育种中的利用价值。综上所述,亟需建立一种即能对含油量、亚麻酸含量进行定向筛选也能对育性和结实率的进行协调和平衡的快速、高效育种方法,筛选出可满足油菜高亚麻酸育种实际需求的CMS。
1 材料和方法
1.1 试验材料
甘蓝型油菜CMS陕6A(陕2A不育胞质),高亚麻酸种质(亚麻酸含量为17.6%)。
1.2 试验方法
1.2.1 CMS 的转育基于对育性、农艺性状比较,在盛花期从陕6A、测恢材料(17gh168)中分别选择出优异单株,去除主花序和倒1、2 分枝基部已开放的花蕾和上部的较小花蕾。在对将在2~3 d内可开放的花蕾数进行统计后,用自交袋将不育株和对应父本套在一起。从套袋后第2天开始,每天上午9:00—10:00、下午3:0—4:00 进行人工摇摆自交袋进行授粉,重复3~5 d。授粉结束3 d后拆除自交袋,让F1代自然成熟。收获前统计成角数。按单株收获、化验;依据表1的筛选指标对F1代进行筛选。在冬油菜、春油菜、温室重复以上操作流程,最终获得F5代、F6代CMS。

表1 不同世代CMS的筛选指标
1.2.2 保持系的选育利用高亚麻酸种质(17gh168)与陕6A 进行测恢,根据F1代、F2代CMS 的育性、品质和对该种质的产量、品质性状遗传稳定性的分析结果,筛选出3个优异单株进行混繁。
1.2.3 花器官的形态测量 在盛花期分别取不育系(YM-1A)、保持系(YM-1B)50朵完全开放的花朵,用游标卡尺测量花瓣长度、宽度、雄蕊长、雌蕊长;取平均值进行统计分析。
1.2.4 不育度与不育率调查在盛花期分别取不育系(YM-1A)、保持系(YM-1B)100 朵完全开放的花朵,按照侯国佐(1991)的方法与标准[31]进行不育度、不育率的调查和不育性级别的划分。
1.2.5 结实系数测定将‘YM-1A’的分枝分成2 份;1份套袋自交,另1 份与‘YM-1B’进行人工授粉。分别记录下处理的花蕾数,待成熟后统计有效结角数。按照“结实系数=有效角果数/处理的花蕾数”分别计算自交、异交结实系数。
1.2.6 产量和品质测定对每个世代的不育系与保持系按单株收获。用称重法计算单株株产量。用近红外分析法测定种子的含油量、亚麻酸含量。按照“亚麻酸产量=单株株产量×含油量×亚麻酸含量”计算单株亚麻酸产出量。
1.2.7 遗传稳定性分析用SPSS 13.0 统计软件分别对‘YM-1B’和F5代、F6代CMS进行亚麻酸含量、含油量、单株产量、单株亚麻酸产量的遗传稳定性分析。
2 高亚麻酸保持系(YM-1B)和CMS(YM-1A)的筛选过程与效果
2.1 ‘YM-1B’的筛选过程与效果
如图1 所示,2017 年7 月利用高亚麻酸种质(17gh168)的8个株系与陕6A进行测恢,2017年9月按单株收获、化验分析。依据2018 年4 月对8 个F2代的育性鉴定结果和2017年9月、2018年6月的农艺性状、产量、品质分析结果,筛选出亚麻酸含量>17.5%、含油量>49%、单株产量>20 g、单株亚麻酸产出量>1.71 g 的3 个优异单株17GH120(17gh69-3 自交)、122(17gh69-4 自交)、128(17gh69-7 自交)进行混繁(代号18GH220),收获的种子用于后续转育CMS。
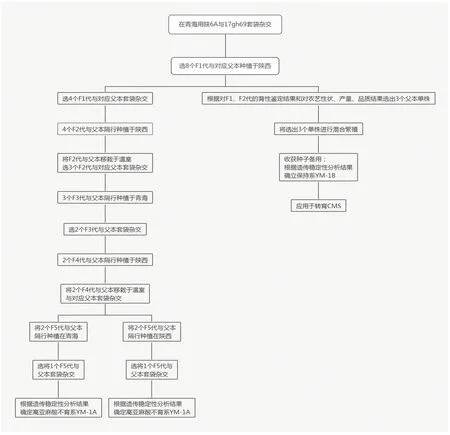
图1 甘蓝型油菜高亚麻酸CMS和保持系的筛选过程
从表2 可知,该种质的亚麻酸含量、含油量、单株产量、单株亚麻酸产量的表型变异在1.78%~4.19%之间,表明遗传稳定;确定其为保持系并命名为‘YM-1B’。
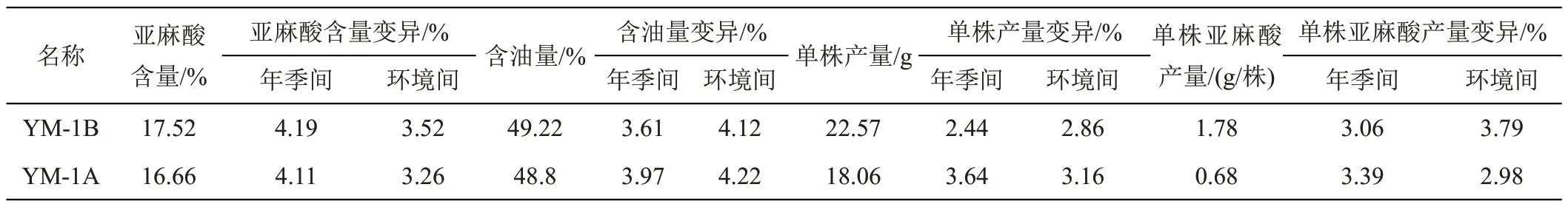
表2 高亚麻酸CMS和保持系的遗传稳定性分析结果
2.2 ‘YM-1A’的筛选过程
2.2.1 在春油菜区通过测恢获得F1代2017年7月按照1.2.1的方法用17gh69的8个株系与陕6A进行测恢获得F1代(图1)。
2.2.2 在冬油菜区筛选、转育出F2代2017 年9 月将8个F1代和对应父本隔行种植,田间编号为17GH115-140。2018 年4 月选择选择不育度>98%、不育率为100%;自交结实系数<0.25、异交结实系数>17.4;亚麻酸含量>11.8%、含油量>45.0%的4 个F1代[17GH119(陕6A×17gh69-3 自交)、17GH121(陕6A×17gh69-4 自交)、17GH125(陕6A×17gh69-5 自交)、17GH127(陕6A×17gh69-7 自交)]与对应的父本[17GH120(17gh69-3 自交)、17GH122(17gh69-4 自交)、17GH125(17gh69-5自交)、17GH128(17gh69-7自交)]按照1.2.1的方法进行套袋杂交获得F2代(图1)。
2.2.3 在温室进行筛选、转育出F3代2018 年9 月选择亚麻酸含量>13.4%、含油量>45.5%的4 个F2代与对应父本隔行种植,田间代号为18GH388~395。2018年11 月将为4 个F2代(18GH388、18GH390、18GH392、18GH394) 及父本(18GH389、18GH391、18GH393、18GH395)移入温室,编号为18GW1~8。2019年1月在选择选择不育度>98%、不育率为100%的3 个F2代18GW3(GH390)、18GW5(GH392)、18GW7(GH394)与对应父本18GW4(GH391)、18GW6(GH393)、18GW8(GH395)按照1.2.1的方法进行杂交获得F3代(图1)。
2.2.4 春油菜区筛选、转育出F4代2019 年4 月选择自交结实系数<0.25、异交结实系数>18.4;亚麻酸含量>14.5%;含油量>46.5%的3 个F3代单株(18GW3、GW5、GW7)与保持系(18GH220)隔行种植,田间代号为19gh65~70。2019年7月选择不育度>98%、不育率100%的2 个F3代19gh65(18GW5)、19gh69(18GW7)与保持系(19gh66、19gh70)按照1.2.1 的方法进行杂交获得F4代(图1)。
2.2.5 在温室转育、筛选出F5代2019 年9 月选择亚麻酸含量>15.39%;含油量>47.3%的2 个F4代单株(19gh65、gh67)与保持系(18GH220)隔行种植在冬油菜区,田间代号为19GH283~286。2019年11月将为2个F4代(19GH283、285)及保持系(19GH284、GH286)移入温室,编号为19GW1~4;2020 年1 月选择选择不育度>98%、不育率为100%的2个F4代19GW3(19GH283)、19GW5(19GH285)与保持系19GW4(GH284)、19GW4(GH286)按照1.2.1的方法进行杂交获得F5代(图1)。
2.2.6 在冬、春油菜区分别转育、筛选出F6代2020年4月、9 月选择自交结实系数<0.25、异交结实系数>18.4;亚麻酸含量>16.36%;含油量>48.2%的F5代(19GW3)与保持系(18GH220)隔行种植于春、冬油菜区;在2020 年7 月、2021 年4 月分别按照1.2.1 的方法进行转育获得F6代(图1)。
2.2.7 ‘YM-1A’的确立从表2可知,该CMS亚麻酸含量、含油量、单株产量、单株亚麻酸产出量的表型变异在2.98%~4.22%之间,说明遗传稳定。确定其为油菜高亚麻酸CMS并命名为“YM-1A”。
2.3 ‘YM-1A’的选育效果
2.3.1 花器官形态的测定结果表明‘YM-1A’属于CMS不育系花器官形态是鉴别油菜雄性不育性的重要指标[27]。从表3可看出,较‘YM-1B’,‘YM-1A’的花朵直径、花瓣长度、花瓣宽度分别降低12.74%、26.97%、31.44%,表明其花朵大小、花瓣长、宽均明显变小;雄蕊长度短57.98%而雌蕊长度无明显差异则表明其雄蕊明显退化而雌蕊发育正常。‘YM-1A’雄蕊长度与雌蕊长度之比为0.46即小于1/2,按侯国佐等[31]的育性分级标准可定为1级。

表3 ‘YM-1A’与‘YM-1B’的花器官形态比较
2.3.2 在选育过程中CMS 的品质性状明显提高从F1代到F6代亚麻酸含量由11.85%提升至16.96%提高了43.12%,年平均增量为1.006 个百分点;不同世代间(年)的增长量逐步降低即F2-F1(1.60个百分点)>F3-F2(1.11个百分点)>F4-F3(0.93个百分点)>F5-F4(0.87个百分点)>F6-F5(0.6个百分点)。从F1代到F6代含油量由45.0%提升至48.8%提高了8.44%,年平均增量为0.759个百分点;不同世代间(年)含油量的增长量之间为F4-F3(0.98 个百分点)>F3-F2(0.78 个百分点)、F5-F4(0.77个百分点)>F6-F5(0.6个百分点)>F2-F1(0.47个百分点)。从F1代到F6代单株亚麻酸产量由0.98 g提升至1.53 g提高了56.12%,年平均增量为0.112 g;不同世代间(年)增长量逐步降低即F2-F1(0.16g)>F3-F2(0.14 g)>F4-F3(0.12g)>F5-F4(0.09g)>F6-F5(0.04 g)(图2)。
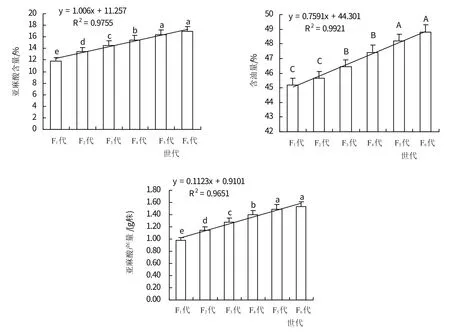
图2 甘蓝型油菜高亚麻酸CMS的筛选效果
2.3.3 ‘YM-1A’的品质、结实性显著提高如表4所示,‘YM-1A’的不育度为99.6%、不育率为100%,含油量为48.8%、亚麻酸含量为16.66%,说明‘YM-1A’符合高油、高亚麻酸CMS的标准。与陕6A相比,‘YM-1A’的含油量、单株产量分别提高8.45%、4.49%;亚麻酸含量、异交结实系数、单株亚麻酸产量分别提高59.43%、12.8%、80.65%;而自交结实系数则降低56.86%。
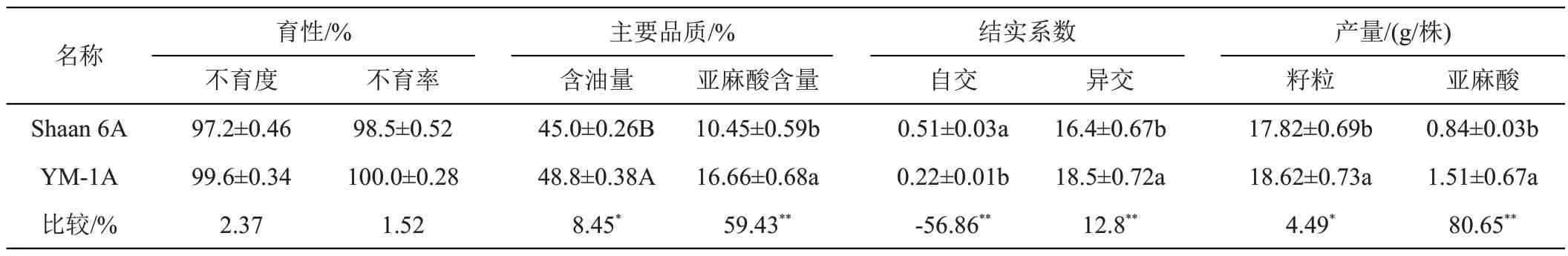
表4 ‘YM-1A’与陕6A的比较结果
3 讨论与结论
3.1 本研究的方法可有效提高CMS 及保持系的选育效率
传统转育CMS的方法需要进行剥蕾、取粉、授粉、套袋、固定、松袋、拆袋等繁琐的操作程序且需要5~6年甚至更长时间才能育成稳定的CMS[27-28,30,32],而本研究采用对父母本间的单株套袋杂交的方法造作较简便,选育周期缩短为4 年。利用自交袋代替杂交袋有效提高了不育株的成角率、角粒数,使收获的种子量可满足化验分析对种子量的要求,有利于对不同世代CMS进行含油量、亚麻酸含量的定向筛选。依据筛选目标,制定出不同环境、不同世代育性、结实性、品质的筛选,对不同世代的CMS 进行单株间比较筛选,即可保证获得具有目标性状(育性、结实性、高亚麻酸)CMS 也可通过定向选择逐步提高CMS 的含油量、亚麻酸含量及结实性。采用不同世代的CMS 的品质指标(含油量、亚麻酸含量)与保持系的比值进行单株间的比较筛选,成功解决了因受不同世代、不同环境影响不同世代CMS 的品质性状难以比较的问题。通过对不同世代的CMS进行固定部位(种子)的结实率、品质(含油量、亚麻酸含量)的定量比较,有效降低了测定结果间的差异,提高了筛选的准确性。采用对CMS进行自交结实系数、异交结实系数筛选的方法解决了需要对CMS 的育性和结实率进行的协调和平衡的问题。对保持系采用混合繁殖不仅可有效解决因连续5~6代自交造成的品质、农艺性状发生退化的问题而且明显减少了工作量。
3.2 ‘YM-1A’的不育性、结实性、品质等性状得到显著提高
与陕6A(原CMS)相比,‘YM-1A’的不育度、不育率无显著差异而异交结实系数提高12.88%、自交结实系数降低56.86%;亚麻酸含量、含油量、单株产量、单株亚麻酸产出量分别提高59.43%、8.45%、4.49%、80.65%,表明‘YM-1A’的不育性、品质、结实性等性状显著提高。较F1代,F6代CMS的亚麻酸含量、含油量、单株亚麻酸产出量分别提高43.12%、8.44%、56.12%,其原因在于选用的保持系(YM-1B)在亚麻酸含量、含油量、单株产量、单株亚麻酸产量等性状方面具有明显的优势,印证了前人的利用优良的保持系可显著是改良CMS 性状的结论[28-31]。在选育过程中,世代间(年)的亚麻酸量的增长量、单株亚麻酸产量均呈现出逐步降低的趋势即F2-F1>F3-F2>F4-F3>F5-F4>F6-F5,其原因可能在于保持系(YM-1B)的亚麻酸含量、单株产量(17.52%、22.57 g)较陕6A(10.45%、17.82 g)分别高67.66%、26.66%即二者之间具有显著差异;随保持系基因导入量的增加,逐步缩小。至于世代间(年)含油量的增长量表现出F4-F3>F3-F2、F5-F4>F6-F5>F2-F1的原因可能在于不同的选择环境对CMS 的含油量产生了一定影响。
3.3 ‘YM-1A’具有较高的育种利用价值
亚麻酸含量、含油量、单株产量、单株亚麻酸产出量的表型变异在2.98%~4.22%之间说明‘YM-1A’的表型性状遗传稳定。CMS的育性、异交结实使判断其育种利用价值高低的重要指标[29-32]。本研究对花器官形态的研究结果表明‘YM-1A’属于CMS;不育度、不育率分别为99.6%、100%及自交结实系数为0.22 表明‘YM-1A’的不育性彻底;含油量、亚麻酸含量分别为48.8%、16.96%表明“‘YM-1A’的品质较优;亚麻酸单株产量为1.51 g、异交结实系数为18.5 表明‘YM-1A’的结实性较好。与陕6A相比,‘YM-1A’的含油量、单株产量、亚麻酸含量、异交结实系数、单株亚麻酸产量显著或极显著提高,自交结实系数极显著降低则表明其的育种价值优于陕6A。同时,由于在不同环境(冬油菜区、春油菜区、温室)在的交互选择,‘YM-1A’可同时适于冬、春油菜区的甘蓝型油菜高亚麻酸杂交育种。随后将利用‘YM-1A’进行优势组合的测配工作,以期尽快选育出甘蓝型油菜高亚麻酸杂交种。
本研究的快速转育方法明显缩短了育种年限、提高了育种选择效率。选育出的高油、高亚麻酸CMS‘YM-1A’具有较高的育种利用价值。
