微生物胞外多糖在环境中的应用
2024-04-23杨义赵守祺葛菁萍宋刚杜仁鹏
杨义,赵守祺,葛菁萍,2,宋刚,2,杜仁鹏,2
(1黑龙江大学生命科学学院,农业微生物技术教育部工程研究中心,黑龙江省寒区植物基因与生物发酵重点实验室,黑龙江省普通高校微生物重点实验室,哈尔滨 150080;2河北环境工程学院,河北省农业生态安全重点实验室,河北秦皇岛 066102)
0 引言
微生物胞外多糖(EPS)是由细菌、真菌、藻类等微生物分泌的次级代谢产物。目前,已报道的能够产EPS 的微生物主要有根瘤菌(Rhizobium)、假单胞菌(Pseudomonasadaceae)、放射形土壤杆菌(Agrobacte riumradiobacter)、葡萄球菌(Staphylococcus)、霍乱弧菌(Vibriocholerae)、短乳杆菌(Lactobacillusbrevis)、肠膜明串珠菌(Leuconostocmesenteroides)、融合魏斯氏菌(Weissellacibaria)、罗伊氏乳杆菌(Lactobacillus reuteri)、出芽短梗霉菌(Aureobasidiumpullulans)、毛霉(Mucorsp.)和小球藻(Chlorellavulgaris)等[1-2]。基于多糖链中的单体组成,EPS 大致可分为同多糖和杂多糖。同多糖主要由D-葡萄糖、果糖或D-半乳糖组成,根据组成不同进一步分为α-D-葡聚糖、β-D-葡聚糖、果聚糖和多聚半乳聚糖。而杂多糖由D-葡萄糖和D-半乳糖以及稀有糖L-鼠李糖、阿拉伯糖、甘露糖、木糖、L-岩藻糖、N-乙酰氨基葡萄糖、N-乙酰半乳糖胺组成。在某些情况下,杂多糖也可能存在非碳水化合物实体,如醋酸酯、甘油酸、丙酸、丙酮酸、琥珀酸、氨基酸、L-谷氨酸、磷酸盐和硫酸盐[3]。
与其他天然多糖相比,微生物EPS 的生产时间较短,提取工艺简单[1]。微生物EPS 具有优异的生物学特性,在免疫调节、益生元、抗癌、抗氧化、抗病毒、抗溃疡和抗胃炎等方面展现较好的功效[4],被广泛应用于制备生物材料、生物医药、食品工业、环境保护等众多领域。随着人类对环境保护意识的不断提高,越来越多的研究者开始关注天然高分子材料在环境中的应用。目前,微生物EPS 在医药和食品工业上的报道较多,但关于微生物EPS 构效关系与环境保护的研究较少且不全面。因此,本文综述了微生物EPS 的构效关系以及其在环境保护中的应用,为微生物EPS 的开发及应用提供理论参考。
1 微生物EPS构效关系
微生物EPS 的分子量、单糖组成、糖苷键、官能团和表面形态等因素都会影响EPS 的功能特性[5]。因此,深入探讨EPS的功能和结构的关系,对于发掘其潜在的应用价值具有重要作用。表1总结了一些微生物EPS的来源、单糖组成和糖苷键与应用之间的联系。
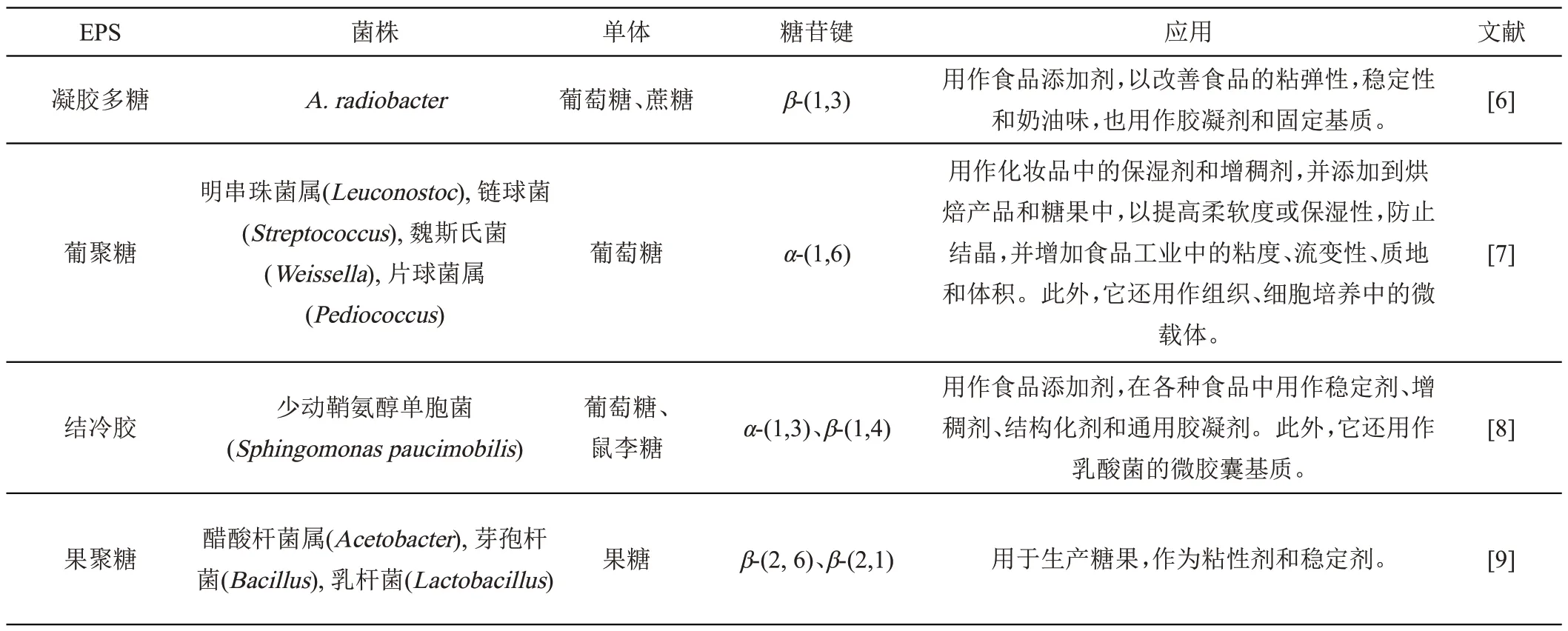
表1 微生物EPS来源及应用
1.1 单糖组成对微生物EPS的影响
EPS是由许多不同单糖组成的细胞外分泌高分子聚合物,这些单糖组成直接影响了EPS的物理化学性质和生物活性。研究表明,尖胞栅藻(Scenedesmus acuminatus)产生的EPS 主要由甘露糖、鼠李糖和糖醛酸组成,其中甘露糖是与铜和铅离子形成复合物的关键糖[15]。EPS中的其他单糖如阿拉伯糖可能有助于细胞聚集,鼠李糖和岩藻糖可以影响絮凝和细胞粘附,而EPS骨架中存在的葡萄糖醛酸残基对于抗凝活性至关重要[16]。此外,研究发现,路德维希肠杆菌(Enterobacterludwigii)产生的EPS是一种带电的六糖,由D-半乳糖、D-葡萄糖、L-岩藻糖和D-葡萄糖醛酸(2:1:2:1)组成[17]。研究EPS的金属结合特性还发现,丙酮化的半乳糖能降低亚麻种子对Cd2+的吸收。因此,不同的单糖组成对EPS的吸附性和絮凝性等都有不同的影响,在环境保护中具有潜在的应用价值。
1.2 分子量对微生物EPS的影响
大部分微生物EPS的分子量在10~106Da之间[18],分子量的不同导致了EPS在絮凝性上的差异。一些研究指出使用高分子量生物絮凝剂进行絮凝作用,其具有更多的吸附位点、更强的桥连作用和更强的絮凝活性,而使用低分子量生物絮凝剂所得到的絮凝效果相对较弱。这是因为分子量较大的絮凝剂通常具有足够数量的游离官能团,桥连作用将许多悬浮颗粒聚集在一起,从而在絮凝反应中产生较大的絮凝体尺寸[19-21]。据报道胶质芽孢杆菌(Bacillusmucilaginosus)产生的高分子量EPS(2.6×106Da)具有很高的絮凝活性(99%),相比之下,谷氨酸棒杆菌(Corynebacterium glutamicum)所产生低分子量(105Da)EPS 的絮凝活性仅为80%[22]。此外,在TANG等[23]的研究中,肠杆菌属(Enterobactersp.)ETH-2 所生成的EPS(1.8×106Da)对高岭土悬浮液也有较高的絮凝表现,絮凝活性为94%。CHEN 等[24]从类芽孢杆菌属(Paenibacillussp.)纯化的EPS(2.38×108Da)在较大的pH 值范围内对高岭土悬浮液(99.8%)、煤废水(98.8%)和高浊度饮用水(89.2%)中表现出较高的絮凝活性。这些研究表明,EPS 的分子量对其絮凝活性具有直接影响,分子量越高,絮凝效果越好。因此高分子量的EPS 有望成为一种有用的生物絮凝剂,应用于废水处理和水资源利用。
1.3 官能团对微生物EPS的影响
微生物EPS具有电负性官能团能够作为生物吸附剂与重金属离子发生离子交换反应、配位络合反应,通过生物吸附、生物转化两种方式处理环境中的重金属离子[25]。而EPS 的羟基、巯基、羧基和磷酸等基团在EPS与重金属结合形成有机金属配合物的过程中至关重要[25]。YE 等[26]研究发现节杆菌(Arthrobacter)ps-5 EPS 中的羟基、羧基、羰基等基团能与重金属离子Cu2+、Pb2+和Cr6+有效结合,对重金属具有较强的吸附能力。CHEN 等[27]的研究也报道了带负电荷官能团如羰基、羟基、氨基等的增加,提高了EPS 对Cd2+的结合能力。此外,BHUNIA 等[25]通过傅里叶红外光谱(FTIR)实验证实EPS 对金属离子的结合能力取决于EPS 表面羟基、羰基、醇、胺、磷酰基、巯基和羧基等负电荷基团的表达。微藻EPS 中的硫酸基团赋予其亲水性和电负性,可以使水溶液中的Ca2+、Mg2+、Zn2+絮凝沉淀下来,所以带有硫酸基团的微藻EPS 可以被当作有效的絮凝剂[28-29]。从以上研究可知,微生物EPS 可以通过生物吸附去除废水中的重金属,主要是因为EPS 中羟基、羧基、氨基、硫酸基团等官能团赋予EPS 电负性,导致EPS能够吸附重金属离子沉淀下去。基于这些研究结果微生物EPS可以被认为是一种有前途的螯合剂,用于去除环境中带正电荷的重金属离子污染。
1.4 糖苷键对微生物EPS的影响
糖苷键是EPS 分子中重要的结构单位,对EPS 的性能具有重要影响。高含量、多类型和特定空间构型的糖苷键调节EPS 的溶解度、稳定性和亲水性。ADAV 等[30]研究发现胞外蛋白质、脂质和α-糖苷键连接的EPS 被酶水解之后,生物聚集体的三维结构未被破坏,而β-糖苷键连接的EPS 被水解后生物聚集体解体,说明β-糖苷键在维持生物聚集体结构稳定性中起到重要作用。WANG 等[31]发现可溶性α-葡聚糖中α-(1,6)糖苷键含量高,而不溶性α-葡聚糖具有93%的α-(1,3)和7%的α-(1,6)糖苷键。这可能因为EPSα-(1,3)糖苷键含量高,导致其分子间交联程度增加,溶解性低且亲水性强。这样的特性还让EPS能够在土壤中形成团聚体,这些团聚体不仅可以储存水分、养分,抵御风蚀和水蚀等自然作用,还能提供物理支撑和空间来改善植物的生长环境[32]。因此,EPS 的存在可以促进土壤的健康和植物的茁壮成长,了解糖苷键对EPS 性能的影响对于深入研究其生物学功能以及开发多功能材料具有重要意义。
1.5 表面形态对微生物EPS的影响
微生物EPS 的表面形态与EPS 的吸附性、亲水性和乳化性密切相关。MATHIVANAN 等[33]研究发现由蜡状芽胞杆菌(Bacilluscereus)KMS3-1 在不同条件下制备的EPS 呈现出不同的表面形态,而这种形态可能与金属离子的耐受性相关。未添加金属离子制备的EPS 表面呈现出不均匀、网状、多孔的结构,而在添加金属离子后制备的EPS表面则更加光滑、坚硬,并具有多孔混凝土状结构,这种多孔混凝土结构的EPS 可以吸附金属离子,增强细胞膜的刚性,从而有效的防止重金属离子进入细菌细胞。其他研究发现表面更光滑,孔隙率更小的EPS对水(105.3%)和油(86.3%)具有较好的吸收能力,对棉籽油、芥子油、汽车油、煤油和柴油也表现出较好的乳化性能[34]。INSULKAR等[35]研究发现地衣芽孢杆菌(Bacilluslicheniformis)PASS26 EPS呈现光滑、致密、孔隙率小的片状结构,对水(98.8%)和油(101.7%)具有良好的吸收能力,并且该EPS对花生油、椰子油、橄榄油和葵花籽油具有中等的乳化活性。以上研究证实了光滑、致密、多孔、孔隙率小的EPS在去污、重金属污染方面具有很大的应用潜力,利用EPS可以有效的保护生态环境。
2 微生物EPS在环境中的应用
2.1 微生物EPS改善农作物生长发育的环境
在农作物生长发育过程中,干旱、土壤盐碱化和重金属污染是具有破坏性的非生物胁迫,近几十年来变得更加强烈,大大降低了农业产量,威胁着可持续农业生产和全球粮食安全[36-38]。有研究发现微生物EPS 能够提高土壤肥力,调节植物细胞渗透压,促进土壤团聚体形成,对重金属具有较强吸附能力,基于这些特性EPS 能保护农作物免受干旱、土壤盐碱化和重金属的侵害[26,39-41]。
2.1.1 微生物EPS改善盐胁迫下农作物生长随着全球气候的变化和人类活动的加剧,土壤盐碱化使耕地面积每年减少约1%~2%[42]。土壤高盐度不仅会损害土壤理化性质和微生物活性,还会对植物的各种生理和代谢过程产生不利影响[43]。据报道利用有益微生物缓解盐胁迫对植物生长的影响,是一种生态友好和可持续农业发展的方法[44]。KUMAR 等[45]研究发现一些植物根际促生菌(PGPR)能够分泌EPS 以维持细胞内渗透压平衡,也可作为在生物和非生物胁迫条件下植物生存的保护屏障,导致PGPR 耐受高盐浓度并促进植物生长。LIU 等[46]研究结果表明PGPR 分泌的EPS 用于保护生长中的根,除了直接改善根系结构外,EPS还形成生物膜作为抵御不利环境压力的物理屏障,并提高光合作用能力和保护植物细胞膜免受盐胁迫引起的氧化损伤。SUN等[47]从海稻的根部分离出了能产生大量EPS 的内生菌(Pantoeaalhagi)NX-16,并使用水培实验研究了EPS 对盐胁迫下水稻幼苗生理反应的影响,研究证实EPS 能减轻盐胁迫的不利影响,增强了水稻幼苗的耐盐性。因此,利用微生物EPS 减弱农作物的盐胁迫是可持续和适应性强的方法,可以在不损害环境的情况下提高农作物在盐碱条件下的性能。
2.1.2 微生物EPS 改善干旱胁迫下农作物生长据估计,世界上三分之一的耕地受到缺水的影响,作物生产受到干旱胁迫的限制[41]。干旱胁迫不仅影响农作物根际微生物的数量和活动,还影响植物的各种生理和生化过程,从而对农业生产造成巨大的损失[48]。而微生物EPS 在保持土壤湿度、提高农作物抗旱性等方面具有显著作用。一些报道指出,土壤微生物将EPS 以黏液物质和胶囊的形式释放到土壤中,在范德华力、氢键和阴离子吸收机制下EPS 可被粘土表面吸收,在土壤中形成保护胶囊结构。含有EPS 的胶囊可以保持水分,比周围环境更慢地干燥,从而保护植物根系和细菌免受干旱胁迫[41,49]。NASEEM等[50]研究发现,产生EPS的菌株结合各自的EPS 对玉米种子进行杀菌,可以改善土壤含水量、植物生物量、根和茎长以及叶面积。在干旱胁迫下,接种植株的相对含水量、蛋白质和糖含量增加。与接种单个PGPR 菌株相比,接种多个PGPR菌株及其各自的EPS表现出更大的抗旱潜力。ILYAS等[51]报道了枯草芽孢杆菌(Bacillussubtilis)MT742976和巴西固氮螺菌(Azospirillumbrasilense)MT742977 组合使用产生大量的EPS,能诱导植物表达更高的激素水平。这些菌株联合接种后,小麦种子发芽率、幼苗活力指数分别提高了18.2%、23.7%。在盆栽试验中,它们对植株生长也有促进作用,其中茎长、根长和叶面积分别增加42.9%、29.8%和33.7%。以上研究结果表明,EPS 能提高农作物抗旱性,改善农作物生长、形态属性、生理参数,因此将EPS应用于植物的抗旱处理中成为了一个新兴的研究方向。
2.1.3 微生物EPS改善重金属胁迫下农作物生长不负责任地处置工业废水、矿山尾矿、城市垃圾和富含重金属的废污泥造成了土壤重金属污染[52]。重金属污染会降低土壤肥力,影响农业生产力,导致粮食减产[53]。一些研究报道微生分泌EPS 通过络合作用与重金属结合,降低土壤中重金属迁移率,最大限度地减少了植物对重金属的吸收,减少了重金属对植物的胁迫[54-55]。JOSHI 等[56]报告了由固氮菌(Azotobacterspp.)产生的EPS可结合15.17±0.58 mg/g的Cd2+和21.9±0.08 mg/g CrO42-,从而减少了小麦中的金属吸收。XU等[57]报道,恶臭假单胞菌(Pseudomonasputida)X4 分泌的EPS 显著降低了白菜中Cd2+的吸收率,白菜枝条的Cd2+吸收率降低了10.0%~62.0%,白菜根部的Cd2+吸收率降低了8.1%~60.1%,增强了将Cd2+固定在土壤中的效率。之前研究发现物理和化学技术可以被用来修复土壤中的重金属污染,但这些方法大多数具有生态毒性,价格昂贵,导致污染物去除不完全等特性[58]。相较而言,利用微生物EPS修复土壤中的重金属污染是一种有前途的技术,在性质上是有效的,具有成本低、环保、高效,比其他传统修复技术具有社会经济重要性,具有广泛的应用前景。
2.2 微生物EPS在污染物处理中的应用
2.2.1 重金属去除工业生产、矿山开采、化石能源的使用等活动造成了土壤、水体中的重金属累积。重金属累积会导致作物减产、生态结构破坏并严重影响人类健康[59]。一些研究发现利微生物EPS 通过生物吸附、生物转化能够有效去除重金属的污染。DIENGDOH等[60]从一条被污染的河流的河岸上分离出藓类念珠藻(Nostocmuscorum),发现N.muscorumEPS能有效的去除水溶液中的Zn2+。通过FTIR 分析证实了EPS 与金属离子的结合能力取决于羟基、羰基、巯基和羧基等负电荷基团。此外,微生物EPS还能够还原金属离子,并进一步将其转化为纳米粒子。例如KANG等[61]发现在不用光和酶的帮助下大肠杆菌(Escherichiacoli) EPS中的半缩醛基团能作为还原剂将Au3+还原为零价转化为AuNPs纳米颗粒,并且EPS可以作为渗透屏障来减弱Au3+的毒性。除了单菌株外,多菌株联合体生产的EPS在去除重金属方面也取得了巨大的成功。从烃类污染水体中分离的细菌联合体分泌的EPS对Cd2+、Zn2+和Cu2+的吸收率分别为87.12%、19.82%和37.64%。由A.radiobacterF2 和球形芽孢杆菌(Bacillus sphaericus) F6 联合产生的EPS 在最优pH 值为7 时,60 min内对镉的吸收率显著[62]。由此可见不同微生物产生的EPS 可以清除由于重金属造成的污染,利用EPS修复可以作为控制重金属污染以及解决环境保护和人类健康问题的可靠方法。
2.2.2 清除有机物合成染料广泛用于纺织品、纸张、印刷、皮革加工、化妆品、塑料、制药和食品加工中的产品着色。这些工业废水中含有大量有毒化合物和合成染料成分,这种未经处理的废水释放到陆地或水体将对水生生物、人类和周围环境产生有害影响[62]。EPS 因为具有氨基、羧基、羟基、磷酸、巯基、酚类等官能团,所有EPS 有着较高的吸附性,可以消除废水中的有机和无机物质[63]。ZHANG 等[63]研究发现奇异变形杆菌(Proteusmirabilis)TJ-1 EPS 中存在羧基、羟基和氨基等吸附基团,并且该EPS 分子量较高具有更多的结合位点和更强的范德华力,导致P.mirabilisEPS 具有优异的染料吸附性能。依据朗谬尔模型,该EPS 对碱性蓝54最大的吸收量为2.005 g/g。KILIC等[64]发现苍白杆菌属(Ochrobactrumsp.)生产的EPS对活性蓝染料的去除效率为89.4%。其他研究发现鲍氏不动杆菌(Acinetobacterbaumannii)YNWH 226 合成的EPS 可用于染料去除,在脱色实验48 h后,EPS对刚果红染料的脱色效率为98.62%[65]。除此,微生物EPS 还能还原降解环境中的有机物,降低水土环境中的有机负荷。JIA等[66]从动胶杆菌属(Zoogloeasp.)和黑曲霉(Aspergillus niger)纯化的EPS均可降解芘,且随着EPS初始浓度的增加,芘的还原量增加。Kang等[67]研究发现,EPS能够将1,3-二硝基苯还原为成3-羟基氨基硝基苯和3-硝基苯胺,在这一过程中鼠李糖和酚类残基起关键作用。由此可见EPS在废水处理和去除染料污染方面的巨大潜力。
2.2.3 清除抗生素医疗、农业等领域抗生素的大量使用,造成了水土环境中的抗生素残留物大量累积。这会导致自然环境中的微生物形成抗性基因,对动植物和人类造成难以估计的负面影响[68]。大量的研究阐明了EPS 在环境修复中的作用,特别是对于抗生素的有效去除[69]。一些研究证实,微生物EPS 是可以阻碍磺胺甲二唑和磺胺类抗生素的扩散,从而减轻细胞和抗生素的直接相互作用以及随后的抑制作用[70-71]。WANG等[72]发现生物膜微生物在缓解抗生素暴露的过程中,对抗生素的吸附主要由EPS 完成。EPS 对四环素(TC)、红霉素(ERY)、氯霉素(CHL)都有较强的吸附能力,这可能与抗生素的亲水性和电荷有关。TC 和ERY 都含有羧基和羟基,而CHL 含有氨基和氯原子。这些官能团可以与EPS中的羧基、羟基、胺基和磷酸基等官能团发生静电作用或氢键作用,从而影响抗生素的吸附。PI 等[73]研究发现克雷伯氏杆菌(Klebsiellasp.) J1 EPS 对水溶液中磺胺类抗生素SMX、SM70、SM0 和SDZ 的生物吸附效率分别为55.1%、51.8%、46.7%和1.2%,显示出EPS 对磺胺类药物的良好吸附能力。这些研究结果可为EPS在环境修复系统中抗生素的转化提供新见解。
2.3 微生物EPS对胃肠道环境的影响
环境微生物的多样性在维持和保护全球遗传资源方面起着重要作用,并构成了地球上大部分的生物多样性。此外,它还对人类健康产生着重要影响。其中肠道微生物群对于维持动物生理平衡、营养代谢和免疫系统的发育至关重要。而某些微生物EPS发挥益生元作用,可以调节肠道微生物群、增强肠道蠕动、维持肠道微生态平衡、减少炎症和改善肠道功能。因此,如何调节肠道菌群已经成为研究的热点。LI等[74]研究发现双歧杆菌(Bifidobacteriumbifidum)WBIN03 EPS 能够作为营养物质来源,显著提高了乳杆菌和总厌氧菌的生长。ASHFAQ 等[75]研究表明,EPS 不仅增加了有益乳酸菌的丰度,而且还降低了家禽肠道中E.coli、沙门氏菌(Salmonella)和肠球菌(Enterococcus)等致病菌的丰度,这表明EPS有可能在家禽饲料中用作抗生素的替代品,以抑制肠道病原体的生长。TIAN等[76]发现EPS 不能被唾液和胃肠道消化,但EPS 可以被人体肠道菌群降解和消耗并促进短链脂肪酸的产生。EPS也可以提高拟杆菌(Bacteroides)的相对丰度,降低致病菌克雷白氏杆菌属(Klebsiella)和梭菌属(Fusobacterium)的相对丰度,从而显著调节肠道菌群组成。此外,EPS能够恢复受损的肠道粘膜屏障,从而增强动物的胃肠道健康。LI 等[77]的细胞培养研究表明,鼠李糖乳杆菌(Lactobacillusrhamnosus)产的EPS能够减少H2O2诱导的猪小肠上皮细胞(IPEC-J2)的氧化损伤,并通过上调细胞紧密连接蛋白显著提高了H2O2受损IPEC-J2的存活率。CHEN 等[78]发现嗜热链球菌(Streptococcus thermophilus)EPS 能在体外和体内维持和恢复小鼠肠粘膜屏障功能,并能增强紧密连接蛋白claudin-1、occludin 和E-cadherin 的表达。这可能因为缺乏紧密连接蛋白会导致肠道屏障的渗透性增加,从而促进病原体和潜在有害抗原的侵入导致肠道炎症[79]。这些研究表明EPS 对于刺激免疫系统,维持肠上皮功能,调节上皮生长并降低炎症和免疫疾病的发生很重要,EPS 有可能用作抗生素的替代品,抑制肠道病原体的生长。
3 展望
微生物EPS 可以赋予微生物抗逆性和储存营养物质的能力,可以构建植物-微生物共生体系帮助植物对抗极端环境,有助于荒漠地区等极端环境的生态恢复,可以与污染物质结合解决多种环境污染问题。然而,由于多数微生物EPS 的产量受限,生物活性不明显等原因,尚未被大规模工业化生产和应用。为了促进其广泛应用,需要进一步改进和优化生产工艺,提高产量和活性。因此可以加强以下几个方面的研究,以解决微生物EPS 应用受限的困难:(1)利用基因工程手段和代谢途径分析,实现微生物EPS 的大规模生产和应用。通过基因水平的修饰,改变微生物EPS 的单糖组成或结构,从而改变其生物活性和功能,制造出符合需求的产物;(2)通过结构修饰,显著提高微生物EPS 的生物活性。例如,改变EPS 的分子量或增加取代基,可以调节其水溶性、吸附性等理化性质,为创造新型生态修复手段提供可能;(3)优化发酵条件和培养介质,提高微生物EPS 的产量和质量。选择适宜微生物生长和EPS 产生的培养条件,如温度、pH 值、营养成分等,可以提高微生物EPS 的产量和活性。
