外源添加苯甲酸对紫苏种子发芽和幼苗生长的影响
2024-04-23薛彤彤谢萌蒙孙辉李冲伟
薛彤彤,谢萌蒙,孙辉,李冲伟,
(1黑龙江大学生命科学学院/农业微生物技术教育部工程研究中心/黑龙江省寒地生态修复与资源利用重点实验室/黑龙江省普通高校微生物重点实验室,哈尔滨 150080;2桦南农盛园食品有限公司,黑龙江桦南 154400)
0 引言
紫苏(Perillafrutescens)又名荏、赤苏等,是唇形科紫苏属且生长周期较短的一年生草本植物,是中国卫生部颁发的第一批药用和食用同源的植物[1]。紫苏籽和叶均可直接食用,根茎可入中药[2],紫苏籽富含α-亚麻酸、油酸、维生素B1和其他不饱和脂肪酸,具有血脂调节功能、增强记忆力、止咳平喘、解热消炎、抗衰、抗过敏和抗肿瘤等功能[3],在营养学领域堪称“植物脑黄金”[4],具有极高的开发价值。紫苏原产于东亚地区,因经济效益显著,现美国、加拿大、俄罗斯也有大面积商业种植[5]。紫苏在中国华北、西北、华南、西南、华中及台湾均有分布和栽培,其栽培史距今已超过2000年。中国是紫苏出口量最大的国家,常年出口日本、韩国等地[6]。近年来,随着紫苏种植面积的不断增加,紫苏种植过程中的连作障碍现象越来越严重,这给紫苏籽的品质和产量带来了严重的影响[7]。
已有研究证实,引起作物连作障碍的原因,除了土壤理化性质劣变、微生物群落结构改变和病原微生物丰度增加外,自毒作用也是导致作物连作障碍的一个主要因素[8]。作物在生长过程中不断向环境释放次生代谢物作为信号因子,包括有机酸、酚类、醌类、香豆素、黄酮类和甾族化合物等物质,其中以酚酸类物质较多。随着作物种植年限的增长,在土壤中这些信号分子积累到一定浓度反过来会对植物生长产生影响,往往表现为对植物的毒害作用[9]。近年来,酚酸作为一类主要的植物化感物质被学者广泛关注[10]。
酚酸类化感物质主要包括苯甲酸、对羟基苯甲酸、肉桂酸和迷迭香酸等[11]。蔡淼[12]研究表明,苯甲酸是穿心莲连作障碍的化感物质,它们通过破坏穿心莲抗氧化酶代谢合成过程,对穿心莲的生长造成不利影响。李培栋等[13]研究发现,酚酸物质可以降低黄瓜幼苗根系活力,增加花生植株的发病率抑制幼苗的生长。焦焕然等[14]研究发现,酚酸类化感物质导致植物根际土壤病原真菌丰度增加,对植物根系造成损害,引起中药材产量、品质下降。Zhou 等[15]研究表明,阿魏酸(肉桂酸衍生物)能够通过改变土壤微生物群落结构抑制黄瓜幼苗的生长。Cui 等[16]以兰州百合为研究对象,配制不同浓度的根际分泌物2,4-DTBP,探究其对根际土壤微生物群落结构的影响,结果表明微生物群落结构组成发生变化,土壤真菌病原微生物增加,有益微生物丰度降低。近年来,对化感作用的研究主要集中在化感物质的来源方面(植物根系分泌物、秸秆分解和根际土壤提取液),单一化感物质对植物自毒作用的研究相对较少[17]。课题组前期利用高效液相色谱检测到连作2年和连作3年紫苏根际土壤中存在着一定浓度的苯甲酸(2.08 mmol/L),因此,笔者以紫苏种子为研究对象,在催芽过程中添加不同浓度的苯甲酸,探讨苯甲酸作为化感物质对紫苏种子萌发、幼苗生长及叶片抗氧化酶活性的影响,旨在为探究紫苏连作障碍机理提供理论基础。
1 材料与方法
1.1 实验时间、地点
实验于2021年9—12月在黑龙江大学生命科学学院生态学专业实验室进行。
1.2 实验材料
供试紫苏种子为‘龙紫苏1 号’,由黑龙江省农业科学院大庆分院魏国江提供。
将0.1221 g 苯甲酸溶解于100 mL 蒸馏水得到10 mmol/L 苯甲酸母液,将母液稀释,蒸馏水作为对照,配制0、1、1.5、2、2.5、3 mmol/L苯甲酸溶液。
1.3 实验方法
1.3.1 种子萌发实验选择大而饱满的紫苏种子,浸种30 min后取出洗净,实验采用培养皿培养法,在每个培养皿中铺设2 层滤纸,分别添加5 mL 各浓度处理液,每个培养皿摆放30粒种子,每组做3次重复。将它们随机放置在25℃的培养箱中进行培养。每天轮换添加等量的蒸馏水和苯甲酸溶液,在每个培养皿中保持相同的溶液浓度,定期记录每个培养皿内发芽的种子数量。发芽判别参考GB/T 3543.4—1995,当紫苏种子胚根与种子的长度相同,胚芽长为种子长度的一半时,判定为种子发芽。测量紫苏种子胚根、胚轴、株鲜重和连续7 d种子发芽情况,计算发芽率(Gp)、发芽势(GE)、发芽指数(GI)、活力指数。
活力指数=种苗生长量×GI…………………… (4)
式中,M1为发芽势天数内的正常发芽粒数,M为实验种子数,Gt为发芽实验周期内每日发芽数,Dt为发芽日数。1.3.2 幼苗生长实验幼苗生长实验采用于育苗盒育苗法,每个浓度培养4株紫苏幼苗。育苗15 d后,选取长势良好的幼苗移栽至花盆中,实验期间花盆摆放位置随机。每个花盆继续加入对应浓度的苯甲酸5 mL,对照组加入等量蒸馏水。实验期间保持土壤湿润,连续观察幼苗生长情况。45 d后测量幼苗根重及叶片抗氧化酶活性,包括超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)。叶片酶活性采用张治安等[18]的方法测定。
1.4 数据处理
使用SPSS 22.0 版(SPSS Inc.,Armonk,NY,USA)选用单因素方差分析(ANOVA)和显著差异(LSD)检验对所有参数进行统计学分析,P<0.05 作为显著性水平,应用Excel软件绘图。
2 结果与分析
2.1 苯甲酸对紫苏种子萌发的影响
由表1 可以看出,不同处理紫苏种子的发芽率和发芽势变化不显著,发芽指数和活力指数有显著变化,总体表现为低浓度促进高浓度抑制。发芽率在低浓度条件下上升,1.5 mmol/L 苯甲酸处理达到最大,2.5 mmol/L 时抑制率达到50%。发芽势在苯甲酸0~2.5 mmol/L 浓度范围内增加,1.5 mmol/L 时发芽势达到最高(P<0.05)。当苯甲酸浓度为1.5 mmol/L 时,紫苏种子发芽指数和活力指数表现一致均达到最高,即紫苏种子萌发效果最好。结果表明,紫苏种子在低浓度的苯甲酸条件下更易萌发,随着苯甲酸浓度的增加发霉和死亡的种子数目逐渐增多,说明高浓度的苯甲酸严重损害了紫苏种子的活性导致种子霉变甚至死亡,抑制种子萌发。

表1 苯甲酸浓度对紫苏种子萌发的影响
2.2 苯甲酸对紫苏幼苗生长的影响
由表2 可以看出,紫苏幼苗的胚根长、胚轴长和鲜重受到苯甲酸的抑制,随着苯甲酸浓度的增加逐渐降低,与对照组具有显著差异(P<0.05),说明苯甲酸能够抑制紫苏幼苗的生长,且浓度越高抑制效果越严重。
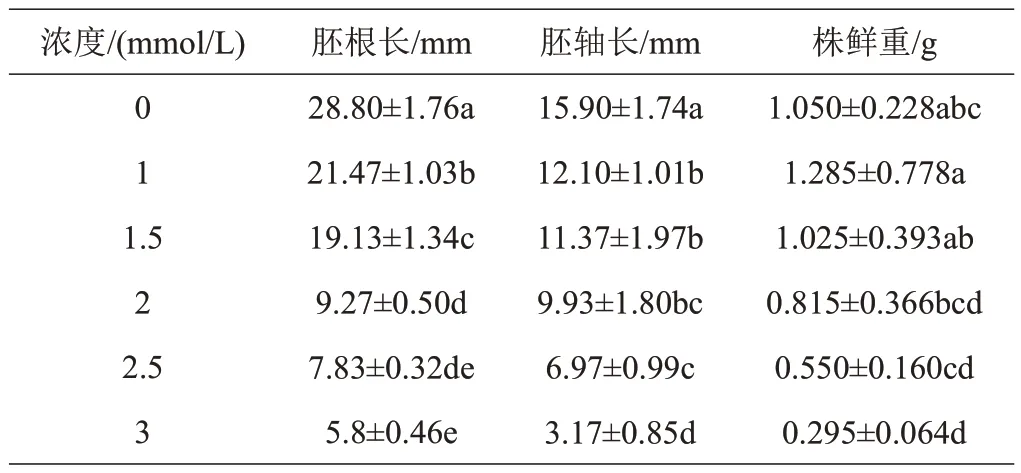
表2 苯甲酸浓度对紫苏幼苗生长的影响
由图1可知,随着苯甲酸浓度的升高,紫苏幼苗根重明显下降,且与对照组相比具有显著差异(P<0.05),根重较对照组分别降低了15.79%、23.68%、28.95%、33.79%和46.84%。结果表明,不同浓度苯甲酸对紫苏根的生长起到显著的抑制作用。

图1 不同浓度苯甲酸对紫苏幼苗根重的影响
2.3 苯甲酸对紫苏叶片抗氧化酶活性的影响
2.3.1 紫苏叶片SOD 活性SOD 酶在细胞中起着清除超氧阴离子自由基的作用,广泛存在于动植物和微生物细胞中。如图2所示,随着外源苯甲酸浓度的增加,紫苏叶片SOD酶活性呈先上升后下降的趋势,苯甲酸浓度1.5 mmol/L时紫苏叶片SOD活性最高,比对照组增加20.26%(P<0.05)。苯甲酸浓度超过2.5 mmol/L,SOD活性比对照组显著降低,表明紫苏叶片SOD活性受到显著抑制。
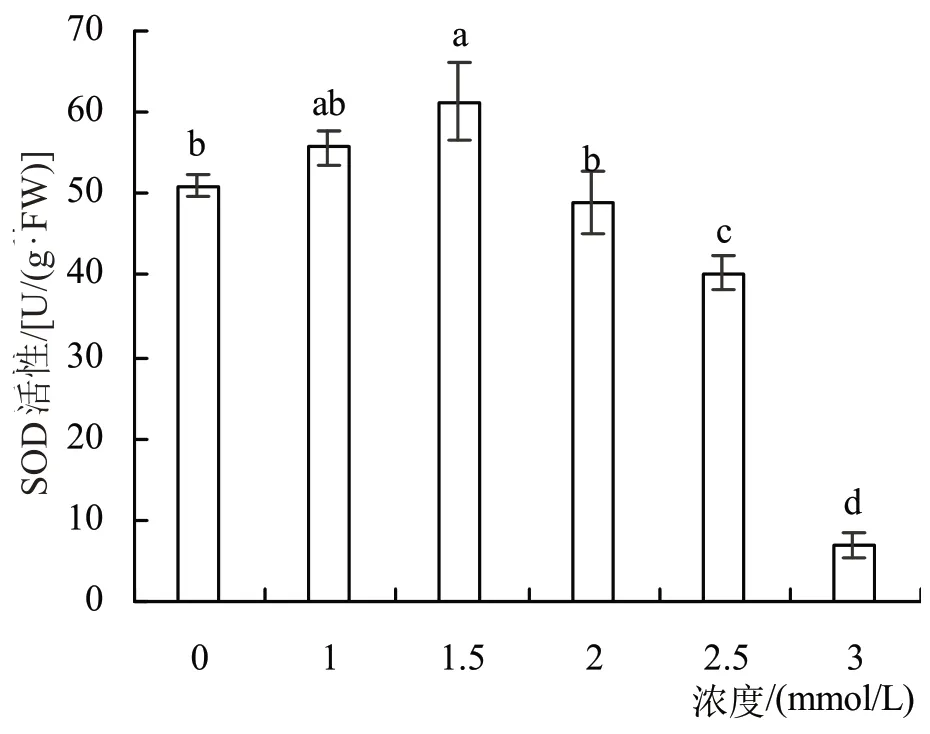
图2 不同浓度苯甲酸对紫苏叶片SOD酶的影响
2.3.2 紫苏叶片POD活性POD 是以电子受体催化氧化底物的一种氧化还原酶,能将自由基转变为羟基自由基或氧负离子而清除,从而保持细胞内环境稳定,维持正常生命活动。同时,还具有抗氧化作用,对生物体的许多生理生化过程有着重要影响[19]。如图3所示,随着外源苯甲酸浓度的升高,紫苏叶片POD 活性呈下降趋势,较对照组分别降低了13.93%、18.22%、19.29%、22.14%和30.36%,与对照组存在显著差异(P<0.05)。
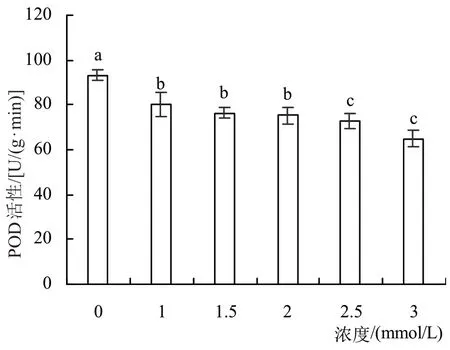
图3 不同浓度苯甲酸对紫苏叶片POD酶的影响
2.3.3 紫苏叶片CAT 活性CAT 酶普遍存在于植物组织中,是重要的酶促防御系统之一,能够清除代谢中产生的H2O2,避免过氧化氢积累对细胞造成损伤,其是与植物抗逆性相关的酶。如图4 所示,随着外源苯甲酸浓度的增加,紫苏叶片CAT 活性呈下降趋势,较对照组分别降低了4.22%、8.41%、19.55%、31.31%和54.13%,与对照组差异显著(P<0.05)。
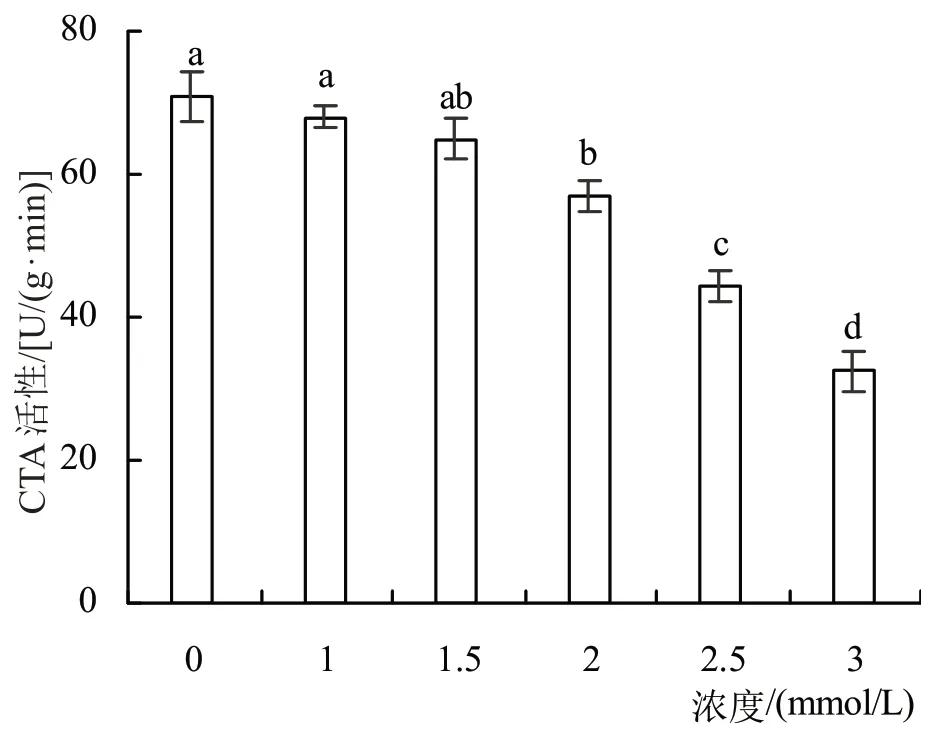
图4 不同浓度苯甲酸对紫苏叶片CAT酶的影响
3 讨论
连作障碍是影响农作物产量和质量的重要原因之一,其中,以酚酸类物质的影响最大,已成为研究连作障碍问题的典型代表物质[19-20]。紫苏种子粒径小、种皮较薄,易受化感物质作用,故本实验探讨外源添加不同浓度苯甲酸对紫苏种子萌发和幼苗生长的影响。本研究结果表明,随着苯甲酸浓度的增加,紫苏种子的萌发呈现低浓度促进和高浓度抑制的现象,这一结果与韩春梅[21]的研究结果一致,具体表现为1.5 mmol/L 达到最大促进浓度,2.5 mmol/L达到半数抑制浓度,随着苯甲酸浓度的继续增加,发霉和死亡的种子数目逐渐增多,说明高浓度苯甲酸对紫苏种子萌发有抑制作用。
根际是植物进行营养摄取最主要的器官[22],根部重量在一定程度上能够反映植物的生长速度[23]。本研究结果表明,随着苯甲酸浓度的升高,与对照组相比,紫苏幼苗根重有明显下降的趋势(P<0.05),对紫苏幼苗的胚根长、胚轴长和植株鲜重均表现出明显的抑制作用,整体呈现显著下降的趋势(P<0.05),说明苯甲酸抑制紫苏幼苗的生长,且浓度越高抑制作用越明显。
H2O2、O2-、-OH等是植物生长代谢过程中产生的活性氧,植物通过自身的活性氧产生与消耗体系,使活性氧保持动态平衡[24]。有研究表明,环境胁迫条件下活性氧平衡失调,诱导生物膜过氧化,最终导致细胞膜的损伤乃至植株死亡[25]。酶促防御体系是膜保护系统较为重要的环节,SOD 酶在平衡体系中起到基础的作用,将毒性较强的超氧物阴离子转化成为次级毒性的过氧化氢[26],在POD、CAT酶的配合下将过氧化氢催化分解,避免过氧化氢与超氧物阴离子相互作用形成更多的氧自由基,导致毒害植物本身[27]。当植物处于轻度胁迫下,植物细胞通过自身酶的调节和释放,避免严重的氧化损伤[28]。因此,SOD、POD、CAT 等酶活性可以客观反映植株受损伤的程度。
许多研究表明,酚酸类化感物质的积累会诱发活性氧平衡失调[29-31],如低浓度苯甲酸处理的西瓜幼苗,根际POD 活性显著升高,高浓度下则促进作用消失,表现为抑制作用[32]。本研究发现,随着苯甲酸浓度的增加,SOD、POD和CAT活性均发生了变化,SOD活性先升高后降低,POD 和CAT 活性呈直线下降趋势,说明低浓度苯甲酸激发了植物酶促防御系统,提高了SOD 活性,在苯甲酸浓度达到2.5 mmol/L 时,胁迫作用增强,SOD活性显著降低,可能是由于POD、CAT等酶活性持续降低,无法清除SOD活性升高带来的更多的过氧化氢,导致无法阻止过氧化氢与O2-相互作用形成的大量氧自由基,导致膜过氧化,破坏了细胞膜脂结构,从而抑制了幼苗的生长。
在自然条件下,化感物质在土壤中能够发生转移、转化和微生物降解,会改变其作用强度。由于本实验在室内进行,与田间情况存在一定的差异,因此,设计田间试验进一步验证苯甲酸作为化感物质的实际临界浓度具有更重要的实践意义。
4 结论
本研究证明,外源添加苯甲酸对紫苏种子发芽表现为低浓度促进高浓度抑制,对紫苏幼苗的胚根长、胚轴长和植株鲜重均表现出明显的抑制作用。苯甲酸作为一种信号因子,在一定阈值内能够启动植株的酶促保护系统,使植株做出适应性调整,当浓度超过防御系统保护阈值,活性氧平衡严重失调,最终导致紫苏幼苗生长受到抑制。因此,笔者推测苯甲酸是紫苏连作障碍的化感物质之一,它破坏植物酶促防御系统,抑制紫苏种子萌发和幼苗生长,在多年连作土壤中积累造成作物产量和质量的下降,这为采取有效措施缓解紫苏连作障碍提供了理论依据。
