小鼠原代腹腔巨噬细胞外泌体的分离及鉴定
2024-04-19刘玉国罗惠瑜林凤涓王洁娴莫嘉琦苏楚红陈俊斌郑钟黛西查龙应
刘玉国,罗惠瑜,林凤涓,王洁娴,莫嘉琦,苏楚红,陈俊斌,郑钟黛西,查龙应
南方医科大学公共卫生学院营养与食品卫生学系广东省热带病研究重点实验室,广东 广州 510515
外泌体是一种由各种活细胞分泌的直径为30 ~200 nm 的细胞外囊泡。外泌体经内吞-融合-外排等一系列复杂的生物学机制产生,通过主动分泌方式排出细胞膜外,具备脂质双分子层膜结构,能稳定存在于血液、尿液、乳汁等各种体液中[1]。一般而言,外泌体呈茶托样或双凹碟形,在人体体液中呈球状[2]。
1983 年,PAN 等[3]首次在绵羊网织红细胞中发现外泌体,最初被认为是细胞排泄的废弃物。之后发现,来源于B 细胞的外泌体能够激活T 细胞,调节免疫细胞功能。随着蛋白质组学、脂质组学、二代测序等技术的进步,发现外泌体含有丰富的蛋白质、脂类、核酸(miRNA、mRNA、DNA 等)等生物分子,且由于外泌体具有脂质双分子层结构,包裹在其内的蛋白质、核酸等生物分子能保持稳定活性,当其被转运至受体细胞时,能被受体细胞摄取,进而调控受体细胞功能,发挥细胞间通讯作用[2]。越来越多的研究发现,外泌体在疾病的预防、诊断、治疗及预后判定中具有良好的应用前景,已经成为生物医学研究的前沿热点领域[4-6]。
巨噬细胞是在维持机体稳态和调节免疫反应中发挥关键作用的免疫细胞,分布广,可塑性强,应激条件下可极化为M1、M2型等巨噬细胞亚型[7]。巨噬细胞可产生促炎细胞因子(如TNF-α、IL-1β 等)诱导机体炎症的发生,也可在机体炎症恢复过程中,产生促纤维化因子、血管内皮生长因子等,从而积极抑制炎症并促进组织修复[8-9]。最新研究显示,巨噬细胞可通过外泌体介导某些疾病的发生发展,将经IL-4极化的巨噬细胞产生的外泌体注射入ApoE-/-小鼠中,可缓解其动脉粥样硬化程度[10];巨噬细胞外泌体可明显减轻葡聚糖硫酸钠诱导的小鼠结肠炎[11],可提供一个促炎环境,通过caspase-3 介导的途径增强抗肿瘤活性,并可作为载体将紫杉醇运输至肿瘤组织中,增强药物抗肿瘤作用[12]。以上研究表明,外泌体也是巨噬细胞发挥细胞间通讯的重要方式。但目前研究中使用的巨噬细胞外泌体多分离自传代培养的巨噬细胞,原代培养巨噬细胞外泌体方面的研究较少。
原代巨噬细胞刚从体内转移至体外培养尚具有一部分体内活性,比起遗传物质已经改变的细胞系,能更加真实地反映体内细胞的代谢情况[13]。原代腹腔巨噬细胞是一种分化较为成熟的细胞,体外培养分裂增殖速度十分缓慢[14]。传统方法分离外泌体需较大数量的细胞,因此提取原代腹腔巨噬细胞外泌体成本较高。本研究建立了一种高效提取小鼠腹腔巨噬细胞及其外泌体的方法,可制备足够数量的小鼠腹腔原代巨噬细胞及其外泌体,为后续原代巨噬细胞外泌体生物学功能的研究奠定了基础。
1 材料与方法
1.1 实验动物 洁净级C57BL/6 小鼠,雄性,5 只,8 ~10 周龄,体质量为22 ~25 g,购自广东省实验动物中心,动物合格证号:44007200093999。本实验均以科研为目的进行小鼠养殖和使用,且按照南方医科大学动物伦理相关规定进行(SMUL2020133)。
1.2 主要试剂及仪器 巯基乙酸盐培养基和磷酸盐缓冲液(PBS)购自中国广州沛瑜生物科技有限公司;高糖DMEM 培养基和青霉素-链霉素购自美国Gibco 公司;胎牛血清(FBS)购自广州依科赛生物科技有限公司(Excell);5×上样缓冲液、牛血清蛋白和脱脂奶粉购自美国Panera 公司;RIPA 裂解液购自苏州凯基生物技术股份有限公司;蛋白酶抑制剂和PMSF 购自美国Sigma 公司;二辛可宁酸(bicinchoninic acid,BCA)蛋白含量测定试剂盒购自南京百泰克生物技术有限公司;ExoQuick TC 外泌体提取试剂盒购自美国SBI公司;兔抗鼠TSG101、CD9和β-actin单抗购自美国ProteintechGroup公司;兔抗鼠CD63单抗购自美国Santa cruz公司;AP-F4/80+购自美国Biolegend 公司;羊抗兔IgG 二抗购自美国CST 公司;流式细胞仪(BD LSRFORTESSA X-20)购自美国BD公司;纳米颗粒跟踪分析仪购自德国Particle Metrix公司。
1.3 溶液配制
1.3.1 巯基乙酸盐培养基溶液 取3 g 巯基乙酸盐培养基溶于100 mL 去离子水中,于121 ℃,20 min 灭菌,配制成3%巯基乙酸盐培养基。
1.3.2 完全培养基 在高糖DMEM 培养基中加入FBS和青霉素-链霉素,配制成含10%FBS和1%青霉素-链霉素的完全培养基。
1.3.3 无外泌体完全培养基 将FBS于4 ℃,100 000×g超速离心18 h;弃沉淀,上清液经0.22 μm 滤膜过滤除菌,获得无外泌体血清,将其和青霉素-链霉素加入高糖DMEM 培养基中,配制成含10%无外泌体血清和1%青霉素-链霉素的无外泌体完全培养基。
1.3.4 裂解液 在RIPA 裂解液中加入1% PMSF 和1%蛋白酶抑制剂。
1.4 小鼠原代腹腔巨噬细胞的提取 经小鼠腹腔注射3%巯基乙酸盐培养基溶液,1 mL/10 g,观察72 h;断颈处理后,浸入75%酒精消毒5 min;固定小鼠,剪开腹部表皮,暴露腹膜(腹膜需保持完整),用5 mL无菌注射器腹腔注射5 mL 完全培养基,腹部按摩10 min,用5 mL无菌注射器于左下腹进针,回抽完全培养基(约4 mL)至无菌离心管中;用5 mL 无菌注射器继续腹腔注射5 mL 无菌PBS,腹部按摩5 min,用5 mL 无菌注射器于左下腹进针,回抽PBS(约5 mL)至无菌离心管中,获得9 mL淡黄色细胞悬液。
1.5 小鼠原代腹腔巨噬细胞的纯化 将细胞悬液于500×g离心10 min,弃上清,用完全培养基重悬细胞,铺板于60 mm 培养皿,待细胞贴壁2 h,进行换液,去除未贴壁红细胞、淋巴细胞等,获得纯化的小鼠原代腹腔巨噬细胞,显微镜下观察细胞形态及数量。
1.6 小鼠原代腹腔巨噬细胞纯度分析 采用流式细胞术。将纯化后的巨噬细胞用预冷PBS 吹打、收集至避光无菌离心管中,用APC-F4/80+荧光抗体常温孵育30 min;上流式细胞仪,检测带有荧光的细胞的比例,结果经FlowJo 10软件分析。
1.7 小鼠原代腹腔巨噬细胞外泌体的提取 对纯化后的小鼠原代腹腔巨噬细胞进行换液,PBS 洗涤3次(充分去除完全培养基含有的外泌体),加至无外泌体完全培养基中,培养细胞24 h;收集上清液,4 ℃,3 000×g离心15 min;收集上清液,按体积分数1∶5加入ExoQuick TC外泌体提取试剂盒试剂,上下颠倒,轻弹离心管混匀,4 ℃放置过夜(12 h 以上);4 ℃,1 500 ×g离心30 min;弃上清,用100 μL 无菌PBS重悬沉淀,获得外泌体悬液,于-80 ℃保存。
1.8 小鼠原代腹腔巨噬细胞外泌体含量的测定 于外泌体悬液中加入等量裂解液,冰上裂解15 min;4 ℃,12 000×g离心5 min;取上清液,采用BCA 蛋白检测试剂盒检测外泌体蛋白浓度。
1.9 小鼠原代腹腔巨噬细胞外泌体形态的透射电镜观察 取外泌体悬液10 μL,滴加至铜网上沉淀1 min;滤纸吸去浮液,取醋酸双氧轴10 μL,滴加至铜网上沉淀1 min;滤纸吸去浮液,常温干燥数分钟。在100 kV进行透射电镜检测成像。
1.10 小鼠原代腹腔巨噬细胞外泌体粒径分析 取冻存的外泌体悬液,室温解冻,待样品温度达25 ℃时放置2 min后,用纳米颗粒跟踪分析仪检测粒径。
1.11 小鼠原代腹腔巨噬细胞外泌体标志物的鉴定在裂解后的外泌体悬液中按体积分数1∶5 加入5×上样缓冲液,95 ℃金属浴孵育7 min,待冷却后,根据BCA试剂盒测定结果,取80 g蛋白上样,经12%SDSPAGE 分离后,以CD9、TSG101、β-actin、CD63 抗体为一抗(1∶500稀释),羊抗兔IgG为二抗(1∶5000稀释),进行Western blot分析
1.12 数据采集及分析 使用一体式酶标仪(Limited ELX808)采集数据,GraphPad Prism 8软件处理数据。
2 结果
2.1 小鼠原代腹腔巨噬细胞数量及形态特征 腹腔注射巯基乙酸盐肉汤可分离获得足够数量的小鼠原代腹腔巨噬细胞,约5×106个/只;倒置显微镜下观察可见,细胞形态为圆形或卵圆形,贴壁纯化培养3 d,细胞伸出伪足黏附在培养皿上,符合巨噬细胞形态特征。见图1。

图1 小鼠原代腹腔巨噬细胞的显微镜观察Fig.1 Microscopic morphology of mouse primary peritoneal macrophages
2.2 小鼠原代腹腔巨噬细胞纯度 F4/80+阳性细胞占比为(99.17 ± 0.65)%,见图2。表明贴壁纯化后的小鼠原代腹腔巨噬细胞纯度较高。
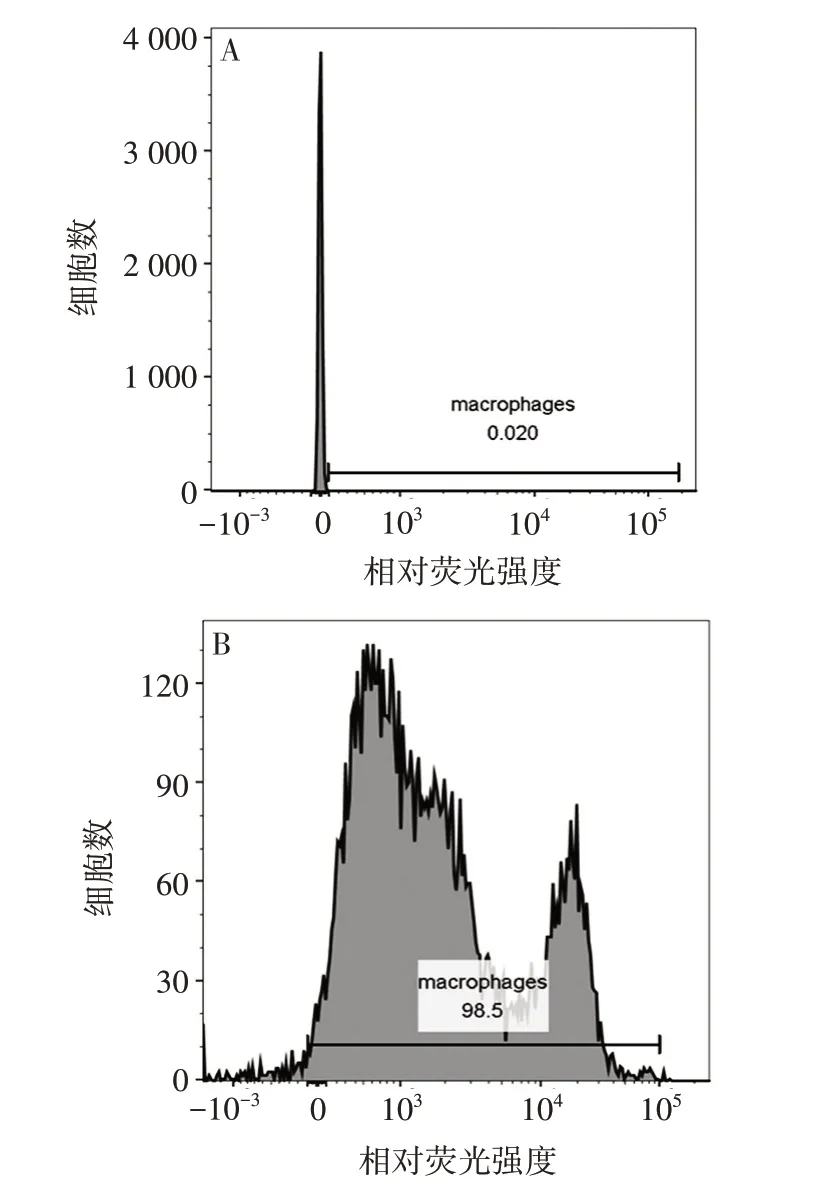
图2 小鼠原代腹腔巨噬细胞F4/80+的表达情况Fig.2 Expression of F4/80+ in mouse primary peritoneal macrophages
2.3 小鼠原代腹腔巨噬细胞外泌体含量 外泌体蛋白浓度为4.347 μg/μL,体积为200 μL,外泌体总蛋白为869 μg。
2.4 小鼠原代腹腔巨噬细胞外泌体形态 透射电镜观察可见,小鼠原代腹腔巨噬细胞为折光性较强、茶托样形态的囊泡状结构,粒径约100 nm,呈典型的外泌体形态,见图3。
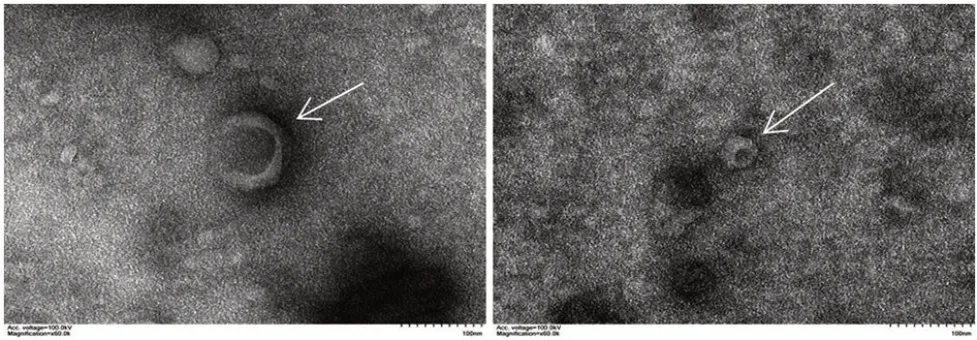
图3 小鼠原代腹腔巨噬细胞外泌体形态的透射电镜观察(×60 000)Fig.3 Morphologyofexosomesfrom mouseprimaryperitoneal macrophages under transmission electron microscope(×60 000)
2.5 小鼠原代腹腔巨噬细胞外泌体粒径 外泌体粒径分布集中在100 ~200 nm,平均为175.2 nm,见图4。表明分离提取的外泌体符合外泌体粒径标准,且纯度较高。

图4 小鼠原代腹腔巨噬细胞外泌体粒径Fig.4 Particle size of exosomes from mouse primary peritoneal macrophages
2.6 小鼠原代腹腔巨噬细胞外泌体标志物 小鼠腹腔巨噬细胞外泌体中高表达外泌体特异性标志物TSG101、CD63 和CD9,且不表达或低表达β-actin,见图5。表明提取的外泌体纯度较高,且未受到细胞及细胞碎片污染。
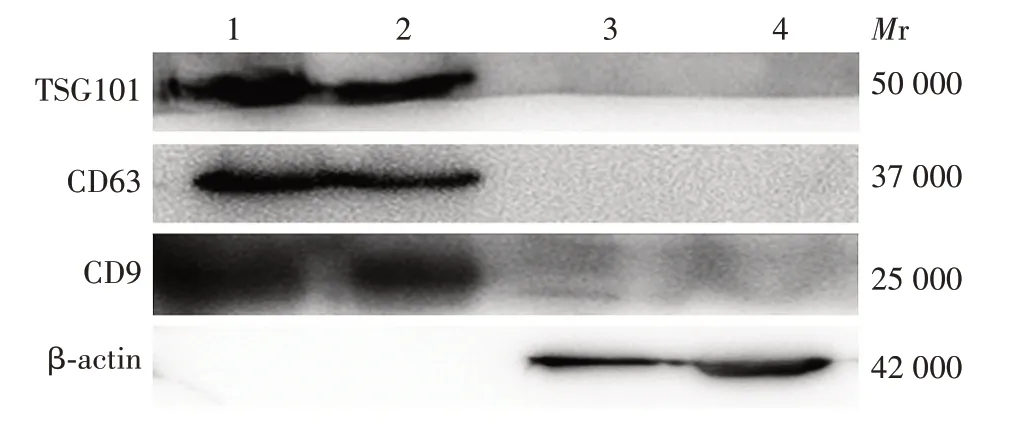
图5 小鼠原代腹腔巨噬细胞外泌体标志物的Western blot分析Fig.5 Marker identification in exosomes from mouse primary peritoneal macrophages by Western blot
3 讨论
外泌体通过转运其内含物(蛋白质、脂类、核酸等)发挥细胞间通讯功能,作为新近发现的细胞间通讯的一种新方式,已成为近年来生物医学研究的热点领域[15]。外泌体主要来源于细胞内溶酶体微粒内陷形成的多囊泡体[16]。外泌体的功能主要取决于其内含物,而外泌体包含内含物的过程并不是随机的,而是具有严格的筛选机制。研究表明,细胞所处的生理或病理状态是影响外泌体内含物及其功能的主要因素[2]。
外泌体相关研究的一个重要前提是需要获得足够数量的细胞,由于传代细胞的无限传代和增殖快速特性,已被广泛应用于外泌体相关研究。但传代细胞与原代培养细胞的大多数蛋白质分布不对称,且许多蛋白质在细胞系中表达下调[17]。由于原代细胞离体时间短,未经过永生化过程,其生物学特性未发生很大变化,仍能保持原有的遗传特征,可更好地反映细胞在体内的状态及活性[13,18]。外泌体作为一种具有生物学活性的细胞间通讯工具,受到其母源细胞状态的直接影响。因此,分离纯化原代细胞分泌的外泌体,能够为真实地反映外泌体的特征及其生物学作用提供研究材料。
直接灌洗法是一种被广泛用于分离小鼠腹腔巨噬细胞的经典成熟方法,但直接灌洗小鼠腹腔获得的巨噬细胞数量较少,且离体培养的细胞状态较差。因此,本研究预先给小鼠腹腔注射巯基乙酸盐肉汤,募集血液中的巨噬细胞至腹腔,大大增加了巨噬细胞的提取数量。流式细胞分析结果显示,注射了巯基乙酸盐肉汤后提取的小鼠腹腔巨噬细胞具有有2个亚群,分别为腹腔驻留巨噬细胞和血液募集进入腹腔的单核巨噬细胞,二者的一些蛋白表达虽略有差异[19],但依然具有相似的吞噬功能[20]。因此,注射巯基乙酸盐肉汤可显著提高腹腔巨噬细胞的获取数量,但是否会影响后续试验仍需进一步探讨。
随着外泌体研究的不断深入,涌现出较多分离纯化外泌体的方法,常用的包括超速离心法、PEG 沉淀法、免疫磁珠法、试剂盒法。超速离心法提取的外泌体纯度最高,但其产量却大大降低[21];PEG 沉淀法获得的外泌体杂蛋白较多,纯度很低;免疫磁珠法成本较高,且提取过程中pH 值和盐浓度可能会改变外泌体的生物活性[22-23]。本研究最初使用传统的超速离心法提取小鼠原代腹腔巨噬细胞外泌体,结果并不理想,Western bolt法很难检测到其标记蛋白,可能是由于原代腹腔巨噬细胞数量少,或者其离体培养后,状态逐渐变差,外泌体分泌量减少。因此,本研究采用ExoQuick TC 外泌体试剂盒提取的腹腔原代巨噬细胞外泌体,作用于细胞不会对细胞增殖产生影响,并且该试剂盒提取的外泌体与传统的超离方法提取的外泌体最为接近[24-26]。本研究从5 mL小鼠原代腹腔巨噬细胞培养上清中可获得蛋白含量为869 μg的外泌体,通过电镜、粒径分析和Western blot综合鉴定其符合外泌体典型特征,且纯度较高,而采用超离方法分离Raw264.7 传代小鼠巨噬细胞的外泌体,从325 mL 细胞培养上清液中仅能获得446 μg外泌体。因此,ExoQuick TC 外泌体试剂盒更适用于小鼠原代腹腔巨噬细胞外泌体的提取。
