发热伴血小板减少综合征病毒Gn蛋白的表达及其免疫原性
2024-04-19韩越田莉杨盼刘乐乐赵忠欣王铁成郑学星郑文文
韩越,田莉,杨盼,刘乐乐,赵忠欣,王铁成,郑学星,郑文文
1.山东大学齐鲁医学院公共卫生学院,山东 济南 250012;2.山东省临沂市人民医院,山东 临沂 276034;3.军事科学院军事医学研究院军事兽医研究所,吉林 长春 130062
发热伴血小板减少综合征病毒(severe fever with thrombocytopenia syndrome virus,SFTSV)属于布尼亚病毒目(Bunya viridae)白纤病毒科(Phenui viridae),是一种球形、包膜、分节段的负链RNA 病毒[1],由L、M和S 3个基因组片段组成[2],其中,M段编码病毒表面糖蛋白Gn 和Gc[3]。SFTSV 感染可引起发热、血小板和白细胞减少及多器官功能衰竭等临床症状,多数感染者有蜱虫叮咬史[4],存在人传人现象[5],无症状感染可能与继发患者的体液和黏膜密切接触有关[6]。另外,携带感染SFTSV 蜱虫的候鸟也具有跨区域传播的潜在风险[7-8]。经实验室检测,发现SFTSV 感染患者血清、呼吸道分泌物、唾液、脑脊液和尿液中病毒载量较高[9-11]。SFTSV 感染严重威胁人类及动物健康,亟待研发有效的SFTSV疫苗。
WU等[12]通过解析糖蛋白Gn的原子水平结构及其与中和抗体结合的结构,确定SFTSV 特异性中和抗体结合位点位于Gn头部的结构域Ⅱ。SONG 等[13]通过对SFTSV 感染恢复期及死亡病例血清进行特异性Ig分析,发现Gn 特异性Ig的缺失与病例的死亡相关。因此,SFTSV Gn 是SFTSV 疫苗研究的重要抗原位点。与其他载体比较,腺相关病毒(adeno-associated virus,AAV)具有结构简单、便于操作的优点,可在动物体内进行长期高水平表达[14],基于此,重组AAV可作为病毒载体用于疫苗研究领域[15]。LIU 等[16]研发的SARS-CoV-2 刺突蛋白RBD结构域的AAV疫苗[包括AAV-RBD(max)、AAV-RBD(wt)、AAV-2xRBD和AAV-3xRBD]可诱导体内产生强烈且持续的免疫反应。PARK等[17]以AAV为载体建立表达人C型凝集素(human dendritic cell-C-type lectin,hDC-SIGN)的小鼠模型,小鼠对SFTSV 非常敏感,对SFTSV 治疗和疫苗临床前评估有一定价值。目前,以SFTSV Gn 蛋白为靶点的AAV 疫苗研究尚未见报道。因此,本研究用AAV9 载体表达SFTSV Gn,通过细胞试验和动物试验分析其生物学特性和免疫效果,以期为SFTSV疫苗的研发提供实验依据。
1 材料与方法
1.1 基因、质粒、菌株、病毒及细胞 SFTSVGn基因[参照GenBank SFTSV JS2011株基因组序列(KC505-127.1)]由南京金斯瑞生物科技有限公司合成;辅料质粒Ad Helper Vector、pAAV-rep/cap Vector、E.coli及载体pAAV-CMV-FH 均由山东维真生物科技有限公司提供;SFTSV JS2011 株由武汉大学公共卫生学院于学杰教授惠赠;HEK293T 及Vero 细胞均由山东大学公共卫生学院微生物检验科室保存。
1.2 主要试剂 AAV 包装系统购自山东维真生物科技有限公司;胎牛血清(fetal bovine serum,FBS)、DMEM培养基、青-链霉素及ECL 化学发光剂均购自美国赛默飞世尔科技有限公司;原核表达Gn 蛋白刺激物由山东大学公共卫生学院微生物检验科室制备;小鼠抗SFTSV Gn 单克隆抗体由武汉大学公共卫生学院于学杰教授惠赠;小鼠抗β-actin 单克隆抗体、Alexa Fluor 488 标记的山羊抗小鼠IgG 及HRP 标记的驴抗小鼠IgG 均购自艾博抗(上海)贸易有限公司;0.5%埃文斯蓝染液、RIPA 裂解液、30%制胶液、Tris、Tris-HCL 8.8/6.8 及Loading Buffer 均购自上海碧云天生物技术有限公司;甲醇购自天津富宇精细化工公司;脱脂奶粉、SDS、Tween-20 及甘氨酸均购自北京索莱宝科技有限公司;ABTS 购自美国Sigma-Aldrich 公司;HRP标记的山羊抗鼠IgG1/IgG2a购自美国Southern Biotech公司。
1.3 实验动物 SPF 级BALB/c 小鼠,雌性,6~8 周龄,体质量18~20 g,购自山东省济南朋悦实验动物公司,动物合格证号为:SYXK(鲁)20230003。本实验对小鼠的所有处理均以科研为目的,且按照动物伦理相关规定进行(文件号:LL20220603)。
1.4 细胞培养 将Vero 及HEK293T 细胞分别用含5%及10%FBS 的DMEM 培养基,于37 ℃,5%CO2培养箱培养,传代,取第2代细胞用于后续试验。
1.5 AAV9-Gn 的获取 将目的基因SFTSVGn及载体pAAV-CMV-FH 分别经AsiS 和MIuⅠ双酶切后,回收目的基因及载体片段,以T4 DNA连接酶于16 ℃连接过夜;连接产物转化至E.coli进行同源重组;提取质粒,命名为重组质粒pAAV-CMV-Gn。以未插入目的基因的载体pAAV-CMV-GFP 为对照。将重组质粒pAAV-CMV-Gn及其对照分别与辅助质粒Ad Helper Vector、pAAV-rep/cap Vector共转染至HEK293T细胞,于37 ℃培养72 h;收集两组细胞培养液,经碘克沙醇密度梯度离心法纯化,获得AAV9-Gn 和AAV9-GFP,于-80 ℃保存。
1.6 Gn蛋白的鉴定
1.6.1 免疫荧光法 将Vero 细胞经0.25%胰酶消化后,接种于24孔板中,1×105个/孔,于37 ℃,5%CO2培养箱培养12 h;按MOI=2×105分别转染AAV9-Gn和AAV9-GFP,同时设细胞对照(不转染),每组设4个复孔,继续培养72 h 以上;加入丙酮,1 mL/孔,-20 ℃固定16 h;加入小鼠抗SFTSV Gn 单克隆抗体(1∶400 稀释),150 μL/孔,37 ℃,5%CO2培养箱孵育1 h;PBS 洗涤5 次,每次5 min,加入Alexa Fluor 488标记的山羊抗鼠IgG(1∶800稀释),150 μL/孔,再加入0.5%埃文斯蓝染液,0.1 μL/孔,继续孵育1 h;PBS 洗涤5 次,每次5 min,取特异性抗体孵育显色前后样品,置倒置荧光显微镜下观察并拍照。
1.6.2 Western blot法 将Vero细胞经0.25%胰酶消化后,接种至6孔板中,3×105个/孔,于37 ℃,5%CO2培养箱培养16 h;按MOI=2×105分别转染AAV9-Gn和AAV9-GFP,同时设细胞对照(不转染),继续培养72 h;加入RIPA 裂解液(含PMSF),150 μL/孔,10 000×g离心15 min;取上清,经10%SDS-PAGE 分离后,转移至PVDF 膜,常温封闭2.5 h;分别加入小鼠抗SFTSV Gn 单克隆抗体及小鼠抗β-actin 单克隆抗体(均1∶2 000 稀释),2 mL/孔,常温孵育1 h,再于4 ℃孵育过夜;TBST 洗涤3 次,每次5 min,加入HRP标记的驴抗小鼠IgG(1∶5 000稀释),2 mL/孔,常温孵育1 h;TBST 洗涤3 次,每次5 min,加入ECL化学发光试剂,显色。
1.7 SFTSV 毒力的评价 将小鼠随机分为Mock 组(无血清DMEM)、AAV9-GFP组(1×1011vg)和AAV9-Gn组(1 × 1011vg),每组6 只,均经小鼠右后肢肌内注射,100 μL/只。连续21 d 监测各组小鼠体质量、进食及精神状态,并按下式计算体质量变化率。
体质量变化率(%)=免疫后每日体质量/初始体质量×100%
1.8 小鼠血清中和抗体效价的检测 按1.7 项方法进行小鼠分组免疫,每组24只。于免疫后2、4、8、16周,经眼球采血,分离血清,采用标准荧光灶减少中和试验(fluorescent reduction neutralization test,FRNT)进行检测,以血清样本孔荧光灶数目比病毒对照孔荧光灶数目减少50%的稀释度作为中和抗体效价[22]。
1.9 小鼠血清特异性IgG1 和IgG2a抗体水平的检测取1.8项AAV9-Gn组各时间点的小鼠血清,采用ELISA法检测特异性IgG1和IgG2a抗体水平。将6 μg/mL原核表达Gn 蛋白刺激物加入96 孔板,100 μL/孔,4 ℃包被过夜;PBST 洗涤3 次,1% BSA 封闭2 h;PBST 洗涤3 次,加入小鼠血清(100 倍稀释后再进行3 倍系列稀释,共10 个稀释度),100 μL/孔,4 ℃孵育过夜;PBST 洗涤3 次,加入HRP 标记的山羊抗鼠IgG1/IgG2a(1∶500稀释),100 μL/孔,4 ℃孵育过夜;PBST洗涤3次,加入ABTS显色液,100 μL/孔,37 ℃避光孵育30 min;加入1% SDS,100 μL/孔,终止显色;用酶标仪检测A405。若试验孔A405- 背景孔A405≥Cutoff 值[(阴性对照组A405-背景孔A405)×2.1]为阳性,<Cutoff值为阴性。
1.10 统计学分析 应用SPSS 26.0 软件进行统计学分析,试验结果以均数±标准差(±s)表示,组间比较采用单因素方差分析及非参数检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Gn蛋白的鉴定
2.1.1 免疫荧光法 荧光显微镜下观察发现,特异性抗体孵育显色前仅有AAV9-GFP组可见绿色荧光,其他两组未见绿色荧光;显色后,AAV9-Gn组可见特异性绿色荧光,其他两组未见特异性荧光。见图1。表明转染的HEK293T细胞可正确表达Gn蛋白。

图1 免疫荧光法鉴定Gn蛋白的表达情况(标尺:50 μm)Fig.1 Identification of Gn protein expression by immunofluorescence(bar:50μm)
2.1.2 Western blot法 AAV9-Gn组Vero细胞可与小鼠抗SFTSV Gn 单克隆抗体发生特异性结合,且于相对分子质量约61 000 处可见特异性结合条带,细胞对照组和AAV9-GFP 组未见该特异性条带,见图2。表明AAV9-Gn 感染Vero 细胞后可正确表达SFTSV Gn蛋白。

图2 Western blot法鉴定Gn蛋白的表达情况Fig.2 Western blot identification of Gn protein expression
2.2 SFTSV 毒力的评价 3 组小鼠体质量均呈增长趋势,AAV9-Gn组小鼠体质量与其他两组比较,差异无统计学意义(F=0.158 ~2.621,P均>0.05),见图3。且3组小鼠饮食、行为及精神状态均表现正常。表明AAV9-Gn具有良好的安全性。
图3 各组小鼠的体质量变化Fig.3 Changes of body mass of mice in various groups
2.3 小鼠血清中和抗体效价 免疫后2、4、8和16周,AAV9-Gn组小鼠血清中SFTSV中和抗体效价均值分别为1∶238、1∶778、1∶5 249、1∶1 555,各时间点均明显高于Mock 组和AAV9-GFP 组(H= 13.332 ~14.538,P均<0.001),且效价峰值出现在第8周,见图4。表明AAV9-Gn 具有良好的免疫原性,可诱导小鼠产生长期且有效的免疫保护作用。

图4 各组小鼠血清SFTSV中和抗体效价的比较Fig.4 Comparison of serum neutralizing antibody titers of SFTSV in mice of various groups
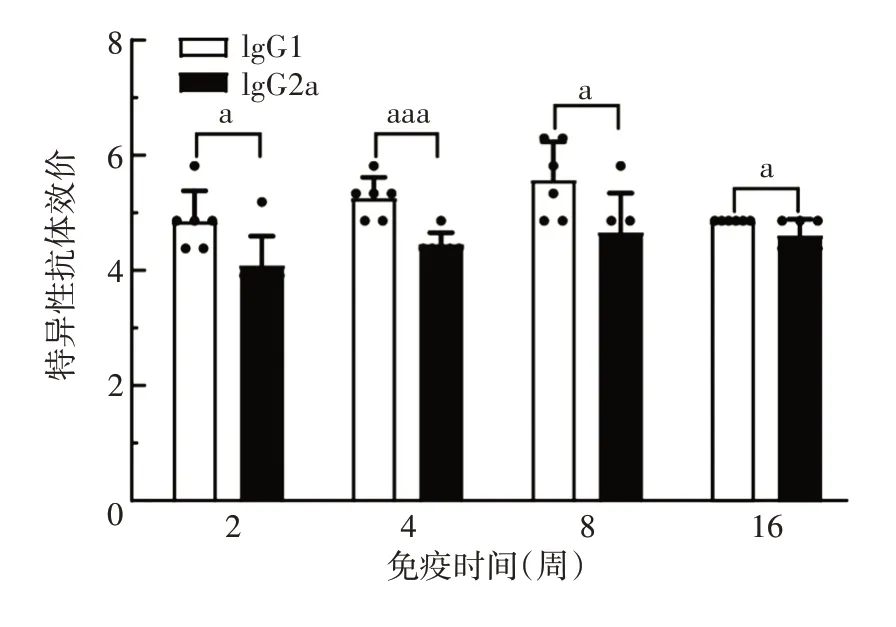
图5 各组小鼠血清IgG1及IgG2a抗体水平的比较Fig.5 Comparison of serum IgG1 and IgG2a antibody levels of mice in various groups
2.4 小鼠血清特异性IgG1和IgG2a抗体水平 免疫后2、4、8 及16 周,AAV9-Gn 组小鼠血清中IgG1 抗体水平均值分别为1∶153 900、1∶243 000、1∶826 200及1∶72 900,IgG2a 抗体水平均值分别为1∶11 340、1∶40 500、1∶75 483及1∶37 800。各时间点IgG1抗体水平均明显高于IgG2a(F=4.373 ~12.975,P均<0.05)。表明AAV9-Gn 可诱导小鼠产生Th1 型和Th2型免疫应答,且后者更强。
3 讨论
2010 年,SFTSV 在中国首次分离并命名,其感染病例以老年人为主,多散发于山区、林地和丘陵地区居住的农民[1],女性略多于男性[18],病死率随年龄的增长而增加[19]。SFTS多暴发于3—11月,主要流行期为5—8 月,5 月为高峰期[20]。SFTSV 作为新发传染病的病原体导致SFTS 的病死率较高,为2.8% ~47%[21],严重威胁公共卫生安全。SFTSV感染细胞主要依赖于其囊膜表面Gn 和Gc 两种糖蛋白,其中Gn蛋白可与中和抗体及特异性抗体结合,是SFTSV 疫苗研制中主要的抗原蛋白[22-24]。IgG主要分布于小鼠的血清中,由于其相对分子质量小且半衰期长,在血清中含量最多,是小鼠体内主要的抗病毒抗体成分。小鼠的IgG 共有5 种亚型(IgG1、IgG2a、IgG2b、IgG2c及IgG3)[25]。多项研究显示,通过比较IgG1 与IgG2a水平,可判断免疫原诱导的免疫类型[26-27]。目前,STFSV 的致病机制尚未明确,仅有几种治疗药物和疫苗在细胞水平和动物模型中对SFTSV 感染有一定的抵抗作用,但尚无有效的SFTSV 疫苗或药物获批用于临床预防或治疗。
AAV 是一种免疫表达水平高、可长期持续性表达目的基因蛋白的免疫缺陷型病毒,是免疫领域研究中一种重要的载体。XU 等[28]以AAV 为载体构建了AAV-HBV1.04 小鼠模型,小鼠体内可长期复制HBV,对抗病毒药物的治疗具有强烈反应。LI 等[29]研发出一种以AAV 为载体,表达登革病毒羧基末端包膜蛋白(79E)的基因疫苗,该疫苗可长期表达特异性抗体,具有良好的免疫原性,可用于研制有效的登革疫苗。目前,鲜有AAV重组表达SFTSV-Gn蛋白的报道。本研究将目的基因SFTSVGn插入载体pAAVCMV-FH,构建重组质粒pAAV-CMV-Gn,经HEK293T细胞表达SFTSV Gn,通过免疫荧光和Western blot法检测蛋白表达情况,结果表明,正确表达了AAV9-Gn蛋白。动物试验结果显示,单次免疫AAV9-Gn后,该病毒可在小鼠体内长效且安全地产生高滴度中和抗体,并能诱导产生Th1型和Th2型免疫应答,其中诱导Th2 型体液免疫应答能力更强,表明重组AAV9-Gn具有作为STFSV 疫苗候选毒株的潜力。目前,已开发的SFTSV 疫苗动物模型包括先天性免疫缺陷小鼠模型、仓鼠模型、免疫活性雪貂模型和猫模型[30],但均不能用于全面评价疫苗效果,仍需进一步深入研究,验证其实际应用效果。
综上所述,本研究以AAV9 为载体可正确表达SFTSV Gn 蛋白,且具有良好的免疫原性,有望作为SFTSV疫苗的候选成分。
