伴有焦虑抑郁的OSA患者血清IL-18、EDS状态与不良情绪的相关性
2024-04-16梁胤褚昭萍舒念齐文耀齐钢桥
梁胤 褚昭萍 舒念 齐文耀 齐钢桥
某些原因会导致睡眠呼吸暂停综合症,在睡眠过程中突发呼吸暂停或呼吸困难[1-2]。阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是其中的一种类型,患者常有精神的异常[3-4]。OSA患者伴发焦虑抑郁情绪的发生率明显高于普通人群,表明两者间存在一定的相关性。目前尚不清楚OSA患者焦虑和抑郁的机制。研究发现OSA患者的血清白介素18(interleukin-18,IL-18)升高[5-6]。OSA患者反复间歇性缺氧可激活氧化应激并引起体内炎症反应相关因子水平显著增加,而细胞因子在免疫调节机制中具有传递信息的作用,可参与神经内分泌等调节过程[7-8]。OSA与其合并症间的关系受到一系列复杂因素的影响[9]。白日嗜睡(excessive daytime sleepiness,EDS)是OSA患者的重要特征,以往研究表明,EDS可引起焦虑和抑郁[10]。本研究探讨伴有焦虑抑郁的OSA患者血清IL-18、EDS状态与不良情绪的相关性。
1 资料与方法
1.1 临床资料 选取2020年5月至2022年5月本院确诊的OSA且伴有抑郁焦虑情绪的患者96例为观察组、另选取年龄及性别基本匹配的100例单纯OSA患者为对照组。纳入标准:①OSA患者的诊断标准参考中华医学会呼吸病学分会睡眠呼吸障碍学组制定的《阻塞性睡眠呼吸暂停低通气综合征诊治指南》2011年版中的标准[11];②抑郁、焦虑情绪的判断标准依据国际疾病分类第10版中的标准,患者HDMA评分≥7分、HAMA评分≥7分;③年龄19~65岁;④EDS状态判断标准为患者具有日间嗜睡的典型症状,同时ESS评分>9分。排除标准:①神经系统器质性病变;②恶性肿瘤;③成瘾性药物应用史(酗酒、吸毒史);④认知障碍、药物中毒等;⑤自身免疫系统疾病;⑥伴有其他系统的重大疾病。观察组男80例,女16例;年龄32~65(49.1±8.0)岁。对照组男85例,女15例;年龄28~65(47.4±10.2)岁。两组年龄、性别差异无统计学意义(P>0.05)。本研究经医院伦理委员会批准,患者均签署知情同意书。
1.2 方法 (1)血清IL-18检测:入院后次日清晨空腹抽取患者静脉血4 mL,离心(2,000 r/ min,10 min)后取上清液,采用ELISA法检测IL-18水平。(2)AHI及SaO2测定:采用多导睡眠监测仪监测并记录患者夜间睡眠过程中睡眠呼吸暂停低通气指数(apnea-hypopnea index,AHI)、最低血氧饱和度(blood oxygen saturation,SaO2)等。(3)汉密尔顿焦虑量表(HAMA)[12]:该量表包含14个问题,每一个问题依据回答情况分别给予1、2、3、4分,总分56分,总分≥7分时,可诊断有焦虑。(4)汉密尔顿抑郁量表(HAMD)[13]:该量表包含17个问题,其中10个问题,每个问题依据回答情况分别给予1、2、3、4分,另外7个问题分别给予1、2分,总分54分,HAMD≥7分时可诊断为抑郁。(5)Epworth嗜睡量表[14]:该量表共涉及在10种情况下患者的精神状态,分别为从不打瞌睡(0分)、轻度可能打瞌睡(1分)、中度可能打瞌睡(2分)、很可能打瞌睡(3分);得分越高表示患者的嗜睡情况越严重。(6)匹兹堡睡眠质量指数(PSQI)[15]:该量表由19个自评和5个其他评价条目构成,总分0~21分,评分与睡眠障碍呈正比。
1.3 统计学方法 采用SPSS 21.0统计软件。计量数据以(±s)表示,用t检验;计数资料用χ2检验;SDS评分与各项因素的相关性采用多元线性逐步回归法;以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较 见表1。
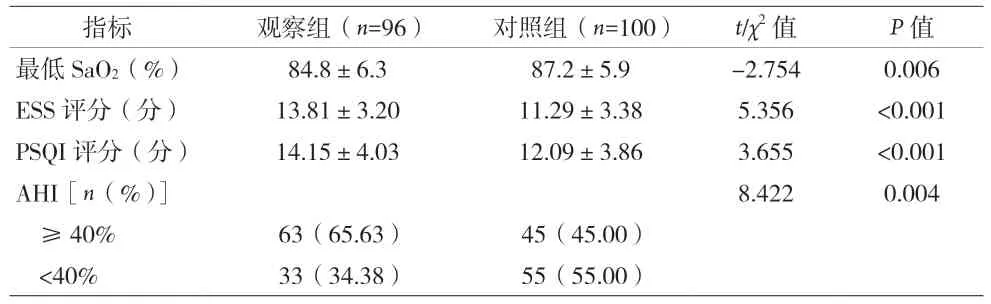
表1 两组患者一般资料比较
2.2 两组患者血清IL-18、合并ESD情况比较 见表2。

表2 两组血清IL-18、合并ESD情况比较
2.3 HAMA评分与各项因素相关性的多元线性回归分析 SaO2与HAMA评分呈负相关关系(P<0.05),ESS评分、PPSQI评分、IL-18水平、合并ESD、AHI与HAMA评分呈正相关关系(P<0.05),表3。
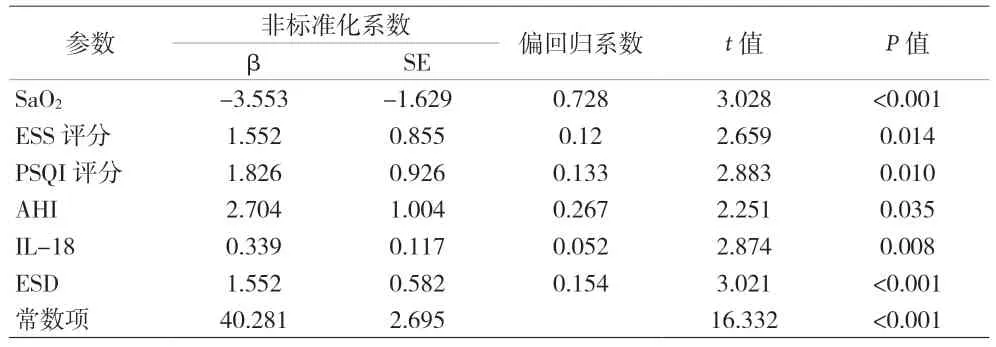
表3 HAMA评分与各项因素相关性的多元线性回归分析
2.4 HAMD评分与各项因素相关性的多元线性回归分析 SaO2与HAMD评分呈负相关关系(P<0.05),ESS评分、PPSQI评分、IL-18水平、合并ESD、AHI与HAMD评分呈正相关(P<0.05),见表4。

表4 HAMD评分与各项因素相关性的多元线性回归分析
3 讨论
OSA患者常存在焦虑和抑郁症状,其与睡眠质量密切相关。有研究[16]认为,EDS患者出现焦虑和抑郁的情况比健康者严重,有较高的ESS评分。IL-18是一种可被半胱氨酸蛋白酶催化的促炎因子,其在抑郁症患者血清中升高,参与机体一系列应答反应[17-18],本研究结果显示,观察组IL-18和ESD的总发生率高于对照组。进入神经系统后,IL-18似乎对维持神经细胞的内部环境具有保护作用。另一方面,如反应过度,会损害正常细胞的成熟作用,过高的IL-18可能会通过细胞因子引起抑郁,IL-18过表达会促进NLRP3 炎症小体的激活,影响机体相关营养因子与神经递质水平,导致外周5-HT水平升高,增加抑郁程度。抑郁症出现时意味着神经胶质细胞发生不同程度的损害,会激发机体中大量细胞因子的产生。释放适当浓度的IL-18可以修复神经细胞,但过高的IL-18可以通过NO依赖性途径导致神经元死亡。此外,IL-8还可以改变脑神经细胞的结构,影响脑神经功能。
以往研究表明[19],OSA本身可通过慢性间歇性缺氧引起EDS。提示EDS与OSA患者慢性间歇性缺氧有关。本研究显示,观察组最低SaO2较对照组降低。观察组IL-18和ESD的发生率高于对照组。分析原因:反复缺氧既可以对神经细胞造成直接损害,也可能介导机体氧化应激及炎症反应损害中枢神经系统,进而引起ESD。本研究显示,观察组患者ESS评分、PPSQI评分和AHI值与对照组比较,差异有统计学意义(P<0.05)。表明EDS患者的主观睡眠质量较差,焦虑和抑郁评分与PSQI密切相关。分析原因:失眠会加重焦虑、抑郁的程度;失眠患者的睡眠结构彻底被破坏,会感到注意力不集中,患者也可能担心入睡,加重焦虑和沮丧情绪;另外,OSA患者EDS症状得不到缓解,会使焦虑与抑郁情绪更加严重。
本研究结果显示,SaO2与HAMA、HAMD评分呈负相关(P<0.05),ESS评分、PPSQI评分、IL-18水平、合并ESD、AHI与HAMA、HAMD评分呈正相关(P<0.05)。无论轻中度还是重度OSA,一旦合并有EDS,抑郁和焦虑程度均会加重。而EDS和睡眠质量下降与OSA无关,后者引起焦虑和抑郁。研究表明[20],OSA本身可通过慢性间歇性缺氧引起EDS,且OSA伴EDS的患者生活质量降低,这也可能诱发或加剧焦虑和抑郁。IL-18高表达,可作用于下丘脑-垂体-肾上腺素能轴等途径,使神经元功能和结构发生变化,导致抑郁的发生,IL-18水平与发生抑郁患者的病情呈正相关。
综上所述,伴有焦虑、抑郁情绪的OSA患者IL-18水平升高,ESD合并率较高,IL-18升高及合并ESD与患者焦虑抑郁情绪严重程度有关。
