单细胞测序和空间转录组技术在口腔医学的应用进展
2024-04-16张夏桐吴文治
张夏桐,吴文治,陈 卓
随着生物信息学、材料科学和计算机科学的飞速发展,高通量测序技术出现了巨大的进步。传统的RNA-seq测序(bulk RNA-seq)通过从组织或细胞中提取RNA,将所有的RNA混合进行测序,所获得的是整个细胞群体中基因表达水平,无法研究组织内细胞的异质性;单细胞RNA测序(single-cell RNA sequencing,scRNA-seq)对单个细胞进行高通量和高分辨率的组学分析,能够鉴定异质细胞群体、重建细胞发育轨迹、模拟基因转录动力学以及推断基因调控网络。但是单细胞RNA测序的数据不能反映细胞的空间信息,而空间转录组(spatial transcripto-mics,ST)技术能将组织内不同细胞的基因表达信息定位到组织的原始空间位置上,进而能直观观测到组织中不同部位基因表达的差异。空间转录组技术通过成像和测序的结合,能够弥补单细胞测序的不足。单细胞测序技术在口腔医学领域已有很多研究,其与空间转录组的结合也逐渐受到关注。本文主要综述了单细胞测序和空间转录组技术在口腔医学领域的研究应用及主要进展。
1 单细胞测序技术概况
单细胞测序技术首先由Tang等[1]报道,对单个细胞遗传物质均匀扩增、标记建库后进行测序,主要步骤为单细胞分选、核酸提取、文库构建、高通量测序和数据分析等,包括单细胞转录组、基因组、表观组和代谢组测序等,目前已在生命科学等领域广泛应用。近年来,以单组学技术为基础的单细胞多组学技术[2]能在同一细胞中捕获多个组学信息,从而更全面地反映细胞特性及其分子机制。如联合单细胞转录组和表观组的双组学技术,包括scM&T-seq技术[3]、SNARE-seq技术[4]、scCAT-seq技术等[5],从而进一步揭示细胞遗传信息及基因表达变异对细胞变化的影响;联合单细胞转录组和蛋白组的双组学技术,包括REAP-seq技术[6]、CITE-seq技术等[7],提供了更为精确的蛋白表达差异。相比较于单组学数据,多组学技术提供了更为全面、准确的生物信息,也是单细胞分析技术的发展趋势。
2 空间转录组技术概况
2016年,Joakim Lundeberg课题组[8]首次提出了空间转录组的概念,空间转录组技术[9]能够获得组织样本中不同空间位置的转录组数据信息,在单细胞测序的基础上进一步鉴定和区分功能基因在不同的空间位置上的表达,2020年被Nature Methods评为年度技术[10]。当前,根据空间转录组技术获取空间信息的原理不同,主要分为基于原位捕获和测序的空间转录组学技术,基于显微切割的空间转录组学技术和基于原位杂交的空间转录学技术等。其中,激光捕获显微切割术(laser capture microdissection,LCM)利用激光束切除识别组织区域,其精确性高便捷性好,被广泛应用于活细胞、新鲜冷冻组织等。Chen等[11]将激光捕获显微切割术与单细胞RNA测序技术结合,通过整合与优化单细胞测序和激光显微切割技术,构建了一种能够获得少量细胞转录组信息、同时保留细胞原有位置信息的测序方法,这一技术又称为Geo-seq(geographical position sequencing)。此外,原位杂交技术常用的包括MERFISH[12](multiplexed error-robust fluorescence in situ hybridization)和seqFISH等技术[13]。Eng等[14]基于原有的seqFISH技术,设计了一种可以检测到单个细胞内10 000个基因的超高成像技术,被称为seqFISH+。与seqFISH技术相比,其成像效率提高了8倍,具有高通量、高精度和亚衍射极限分辨率的特点,是揭示基因空间信息的重要研究技术。
3 单细胞测序与空间转录组的联合应用
随着单细胞测序技术的发展成熟,空间转录组技术在分辨率和通量上也得到了大幅度提升。如表1所示,空间转录组技术能够捕获细胞的空间位置信息及相关的基因表达数据,但是目前无法达到单细胞分辨率,而单细胞测序技术能够在单个细胞水平构建各个细胞的表达谱及其基因表达,却丢失了细胞的原始空间分布及通信网络。两者的结合实现互补,能够在单细胞水平描绘组织的空间图谱及细胞的空间交互。目前,将单细胞数据和空间转录组数据整合的方法主要包括两种:去卷积[15](deconvolution)和映射[16](mapping)。去卷积是指从单个空间捕获点中根据单细胞数据分离出离散的细胞亚型,而映射是指将单细胞数据定位到HPRI(high-plex RNA imaging)图谱上或组织的特定区域中。随着空间转录组技术的更迭与发展,可以根据不同的实验需要整合各种空间转录组技术与单细胞测序数据,在空间上揭示组织单细胞水平的全转录组信息,以进一步描绘组织发生发育与疾病微环境中的特定细胞亚群及其空间位置上的通信网络。

表1 单细胞测序与空间转录组技术的原理与特点
4 单细胞测序和空间转录组技术在口腔医学领域的应用现状
口腔医学领域对测序技术的要求具有特殊性,主要表现为口腔组织如牙周、牙髓组织量较小,在传统测序背景下,组织样本量及样本活性较难达到要求,且口腔微生物菌群较复杂、难以实验室培养、对微生物的测序分析尚存在困难。而单细胞测序技术能突破传统测序的局限,使口腔组织的测序更为精确便捷。目前,随着测序技术的进展,常将单细胞测序技术与空间转录组技术结合,以获得高通量水平的单细胞分子信息及空间位置信息。在口腔医学领域,主要应用于口腔间充质干细胞、口腔微生物、口腔组织发生发育和多种口腔疾病的研究中。
4.1 口腔间充质干细胞
间充质干细胞(mesenchymal stem cells,MSCs)是具有自我更新能力的基质细胞[17]。口腔间充质干细胞包括牙周干细胞、牙髓干细胞、牙龈干细胞、来源于脱落乳牙的干细胞以及牙乳头干细胞等[18]。间充质干细胞具有异质性,表现在不同供体、不同组织来源、克隆亚群以及单细胞水平,而传统的bulk测序难以区分出细胞亚群、揭示细胞的异质性。
单细胞转录组测序作为研究干细胞异质性的重要手段,在口腔间充质干细胞领域已有初步应用。牙周膜干细胞及牙髓干细胞是口腔间充质干细胞的重要组成部分,Pagella等[19]通过单细胞转录组测序发现两者具有极相似的分子特性,相比于其他亚群更高表达MYH1和THY1。而两者的主要差别表现在牙周MSCs中高表达CCL2和编码胶原蛋白的基因及SPARC/Osteonectin,这表明牙周微环境有利于MSCs向成纤维细胞样分化,而牙髓MSCs中高表达CXCL14和RARRES1及KRT18,表明牙髓微环境中有利于MSCs的成骨分化。此外,Lee等[20]发现人牙髓干细胞(human dental pulp stem cells,hDPSCs)主要表现为具有成骨分化潜能及成神经分化潜能的亚群,并且高表达神经和内源系统相关基因;而人牙周膜干细胞(human dental periodontal ligament cells,hPDLSCs)主要为具有成肌分化潜能和成骨分化潜能的亚群,高表达成骨和成软骨基因。
除了对牙髓、牙周膜干细胞进行单细胞分析外,单细胞测序也应用于颌骨骨髓干细胞及其与骨免疫微环境的相关研究。Lin等[21]发现与长骨相比,牙槽骨中的免疫微环境更为活跃,免疫细胞的占比也更高。在牙槽骨的免疫细胞亚群中,单核/巨噬细胞亚群与间充质干细胞亚群的联系最为密切,在长骨中,单核/巨噬细胞更高表达抑瘤素M以促进MSCs的成骨分化且抑制MSCs的成脂分化。
目前,单细胞测序技术在口腔间充质干细胞中的应用主要集中在干细胞亚群的区分及生物信息分析,值得注意的是,在疾病微环境下,干细胞的异质性是否会发生变化,干细胞与其他细胞之间的通信是否会受到影响,尚需要进一步的研究。
4.2 口腔微生物
口腔微生物群是仅次于肠道微生物群的第二复杂的人体微生物群落,包含700种细菌,也包括真菌、病毒等[22]。口腔微生物群与宿主的口腔健康及全身健康或疾病密切相关。研究表明口腔微生物与龋齿、牙周病、口臭等口腔问题关系密切,同样也和心血管疾病、糖尿病等全身系统性疾病的发生发展有关。传统的口腔微生物测序方法主要是以16S核糖体核糖核酸基因特征区域测序和宏基因组测序为主,但是其提供的生物学信息有限,尚难以对不易培养的微生物进行测序。
近年来,随着单细胞测序技术的发展,其在微生物领域的应用也日益普遍。Cross等[23]应用单细胞测序和反向基因组学的方法培养了人口腔Sacchari bacteria菌门(TM7)的三个不同菌种,发现其均为放线菌的体表寄生物种,并且利用相同的方法,分离并培养出了一种先前无法培养的人口腔细菌SR1。Campbell等[24]通过单细胞基因组学测序首次从牙周炎患者口内分离出绿湾菌。Beall等[25]通过单细胞测序发现了与福赛坦纳菌亲缘关系相近的坦纳菌BU063和坦纳菌BU045,其中坦纳菌BU063主要存在于健康牙周组织中,而坦纳菌BU045则和牙周炎的发展密切相关,为慢性牙周炎发病机制提供了新依据。口腔脱硫菌作为一种新的牙周致病菌,属于难以分离培养的口腔微生物,传统方法是通过硫酸盐还原生理学的原理,在纯培养中富集并随后分离而得,而Cross等[26]根据单细胞基因组数据分析微生物的生理特性分离出了口腔脱硫菌,并发现口腔脱硫菌主要依赖梭杆菌产生的营养物质生长,其毒性及促炎特性也是由其他的口腔微生物转移获得。
由于微生物的体积较小、存在细胞壁且mRNA缺乏polyA尾等因素,使得对细菌等微生物的测序存在一定的局限性。目前,针对原核细胞RNA的测序方法包括Split-pool[27]和BacDrop[28]等,分别刊登在Science和Cell上。随着微生物单细胞测序(MsRNA-seq)的更新及应用,细菌群体耐药、细菌与宿主相互作用及微生物时序表达等研究在未来会取得新的突破。特别在口腔微生物领域,可应用于如单个牙周致病菌与宿主之间的相互作用机制、龋病致病菌的时序表达差异等,进一步揭示口腔微生物的致病机制及其与宿主之间的相互作用关系。虽然目前尚无口腔微生物的空间转录组测序,新的高通量空间转录组成像方法已能观察铜绿假单胞菌生物膜在微尺度上的空间信息[29]。
4.3 口腔组织发生发育
牙发育依赖于来自颅神经嵴的间充质细胞和来源于外胚层的上皮细胞相互作用,原发性上皮带增厚向结缔组织内增生,其周围的间充质聚集形成上皮芽最终发育成釉质、牙本质、牙髓和牙周膜。在这一过程中,大量信号分子参与形成复杂调控网络[30]。
目前,单细胞测序已被广泛应用于揭示牙发育的轨迹以及发育过程中的细胞间通信。Shi等[31]通过对未成熟恒牙牙胚进行单细胞测序,发现免疫细胞占大多数,并通过分泌转化生长因子-β、肿瘤坏死因子(TNF)和白细胞介素-1调节其他细胞。Matsubara等[32]借助成像技术,在单细胞水平上可视化牙齿血管系统的3D结构,鉴定出一种独特牙周尖样内皮细胞,其参与牙本质生成及牙齿矿化过程。在成牙本质细胞的控制下,牙周尖样内皮细胞表现出较高的血管生成活性和可塑性,正反馈促进成牙本质细胞的成熟。以上研究表明,单细胞测序有助于探究牙发育过程中牙本质分泌矿化与血管、神经和免疫细胞发育的耦联。
此外,单细胞测序也有助于进一步揭示调控牙发育的关键基因及信号通路。Chiba等[33]结合使用单细胞RNA测序及CAGE-seq技术鉴定参与牙齿发育的基因,发现成釉细胞新标记基因FXYD4和ACPP,在成釉细胞的分化过程中发挥重要的功能。神经嵴细胞是颌面部生长发育的基础,但是其迁移分化等具体机制尚不清楚,Jing等[34]选取不同发育阶段的小鼠磨牙进行分析,发现IGF信号介导的细胞间相互作用扰乱了牙周膜细胞的发育,并且发现关键调节因子Foxp4的缺失可导致牙周膜细胞的发育缺陷。Takada等[35]发现转录因子Mkx通过调节特定细胞群和基因表达来维持牙周膜内的平衡,并且在Mkx缺失的牙周膜中间充质细胞和成骨细胞中的骨化相关基因表达增高且巨噬细胞和炎症介质数量增加。
目前空间转录组技术尚未应用于牙发育的研究,主要是由于当前的空间转录组以基于新鲜的超薄冷冻组织切片为主,牙和骨等硬组织的冷冻切片和组织透明化存在难度,导致分辨率和基因检测效率不足。然而随着针对石蜡组织切片的空间转录测序技术的突破[36],未来这一方面的研究将获得更多的关注。
4.4 口腔疾病
4.4.1 牙周炎
在牙周炎发生发展的过程中,宿主的免疫炎症反应是决定其严重程度的重要因素。Lee等[37]通过构建牙周炎患者及健康对照组外周血单核细胞表达谱,发现在牙周炎疾病状态下,CRIP1可作为特异性全身炎症指标在各细胞类型中明显增加,同时BTLA和IFNG信号网络在疾病状态下也明显增强。Qian等[38]通过对牙周炎患者及健康人群的牙周组织进行单细胞分析发现表达HLA-DR的内皮细胞和CXCL13+的成纤维细胞与宿主免疫调节密切相关,而促炎性NLRP3+巨噬细胞在牙周炎进展中发挥重要作用。Chen等[39]构建了牙周骨免疫微环境的细胞图谱以进一步观察在牙周炎疾病背景下骨免疫细胞类型的改变,发现牙周炎患者中高表达趋化因子的TNFRSF21+成纤维细胞富集,而随着牙周基础治疗的进行,CD55+间充质干细胞、APOE+前成骨细胞和IBSP+成骨细胞逐渐降低。此外,Caetano等[40]发现在牙周炎环境中巨噬细胞比其他细胞表达更高的相关易感基因,如IL1B、PTGS2/COX2、FCGR2A、IL10 和IL1A等在巨噬细胞亚群中有更为特异性的表达。而对于患有全身系统性疾病的牙周炎患者,其机体的免疫应答也有所不同。Agrafioti等[41]通过研究患有或不患有2型糖尿病的牙周炎患者,发现患有2型糖尿病的牙周炎患者巨噬细胞中高表达NF-κB转录因子复合物亚单位RELA,这表明巨噬细胞在牙周炎中的异质性和过度活化可能与牙周炎的发病机制及进展相关,并可能在2型糖尿病患者中进一步增强。
单细胞测序技术虽能鉴别健康及炎症牙周组织中的基因表达差异,但是尚不能将基因表达定位到特定的细胞区域。Lundmark等[42]联合应用单细胞测序与空间转录组技术,在高通量的水平定量且定位了牙周炎时牙龈组织中的基因表达,发现上皮及结缔组织炎性浸润区和非浸润区三个区域的基因表达差异,其中在结缔组织炎性浸润区中IGLL5、SSR4、M2B1、XBP1四个基因表达上调最为明显。
4.4.2 口腔癌
肿瘤异质性普遍存在于肿瘤细胞间,同一肿瘤内存在不同的细胞亚型,表现为细胞形态、基因表达、增殖和转移潜力不同,其通过与肿瘤微环境相互作用促使肿瘤分化形成不同细胞亚型并发生转移扩散。因此,了解肿瘤细胞的异质性及肿瘤微环境对肿瘤的诊断、明确肿瘤性质以及针对性治疗均有重要影响。
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)作为头颈部鳞状细胞癌中最常见的亚型,其诊断及防治是口腔癌诊疗的关键。单细胞技术已被应用于探究OSCC中的肿瘤细胞和肿瘤微环境的异质性。已知在上皮癌发生发展过程中,部分上皮-间充质转化(partial epithelial-mesenchymal transition,p-EMT)是上皮-间充质转化(epithelial-mesenchymal transition,EMT)的中间状态,此时癌细胞同时表现出间充质和上皮特征[43]。Huynh等[44]通过整合分析OSCC的单细胞数据,探究肿瘤微环境中p-EMT亚群以及与其密切相关的癌相关成纤维细胞亚群间的细胞通信网络,发现两者之间的靶向性受配体交互作用与OSCC的转移状态有关。Puram等[45]通过对比分析未治疗的OSCC原发性肿瘤以及已发生淋巴结转移肿瘤的单细胞数据,发现恶性细胞在表达与细胞周期、应激、缺氧、上皮分化和部分上皮-间充质(p-EMT)转化相关的信号方面有所差异,这进一步提示p-EMT可作为淋巴结转移、分级和不良病理特征的独立预测因素。Chen等[46]从OSCC患者的肿瘤和邻近正常组织中分离出T细胞进行测序鉴定并描绘了它们的发育轨迹,发现在OSCC肿瘤中可见耗竭CD8+T细胞和调节性CD4+T细胞富集,且TOX是肿瘤微环境中T细胞功能障碍的关键调节因子并参与介导肿瘤免疫抑制。Hsieh等[47]发现在白念珠菌感染的情况下OSCC的癌变机制与未感染者不同,在无白念珠菌感染的OSCC中,IL2/STAT5、TNFα/NFκB和TGFβ信号通路是其主要癌变机制,而有白念珠菌感染的情况下可发现KRAS信号通路和E2F下游靶基因,Stratifin是感染白念珠菌OSCC的特异性标志物。因此,单细胞测序不仅为理解OSCC的发生、发展机制提供了新策略,还为OSCC的检测、分类和预后分析提供了新依据。
口腔鳞状细胞癌具有神经周浸润(perineural invasion,PNI)特性,但尚未有明确的PNI诊断标准。Schmitd Ligia等[48]利用空间转录组技术分析了PNI阳性与PNI阴性患者神经的转录组学特征,发现神经与肿瘤之间的距离不同其基因表达也有差异,这进一步证明了PNI是无淋巴结转移患者预后不良的独立预测因子,且神经-肿瘤距离越近预后越差,这些结果也支持基于神经-肿瘤距离对PNI的分类。单细胞测序和空间转录组的应用为挖掘时空特异性的口腔癌标志物和治疗靶标提供了可行性。
4.4.3 口腔黏膜病
口腔黏膜由上皮及上皮下结缔组织构成,作为人体的第一道防线,主要功能是屏障、感觉及分泌功能,其中,黏膜的保护屏障功能尤为重要。口腔黏膜屏障包括理化屏障和免疫屏障,主要由上皮细胞及免疫细胞维持,同时,基质细胞也发挥着重要功能。因此,口腔黏膜内各细胞间的平衡及通信对维持口腔黏膜微环境的稳定及口腔黏膜疾病的发生发展极为重要,特定口腔黏膜位置单细胞水平的高通量测序能更进一步揭示其内在联系。
Zhao等[49]描绘了人正常口腔黏膜的单细胞图谱,发现其中一半为免疫细胞,其次为基质细胞(成纤维细胞和内皮细胞)和上皮细胞,通过亚群分析发现T细胞构成免疫细胞的主要成分,其中主要是γδ T细胞,而巨噬细胞包括有两种不同的激活状态及静息状态;此外,成纤维细胞作为主要的基质细胞,其与其他细胞间的通信最为频繁,这也进一步表明了上皮-基质-免疫细胞间通信在维持黏膜内环境稳定的重要作用。而当牙周炎存在时,口腔黏膜(牙龈)出现炎症表现,Williams等[50]通过构建健康人和牙周炎患者口腔黏膜的单细胞图谱(图1),发现基质细胞在牙周炎中过度活化,进而招募免疫细胞尤其是中性粒细胞,从而促进炎症发生,揭示了基质细胞-免疫细胞轴在疾病发生发展中的重要作用。在机体疾病状态下,细胞间的平衡同样被打乱,Wang等[51]发现在2型糖尿病(T2DM)的背景下,口腔黏膜的屏障功能发生障碍,上皮/基质比率降低,成纤维细胞中的炎性因子增加。这种具有转录多样性及与中性粒细胞、γδ T细胞等固有免疫细胞相互作用的成纤维细胞亚群被定义为“免疫样”基质细胞。这也从上皮-基质-免疫轴的角度阐明T2DM与口腔黏膜疾病及牙周损害之间的潜在联系。而在特定的口腔黏膜疾病中,也存在不同的免疫微生态,Li等[52]发现口腔黏膜扁平苔藓(oral lichen planus,OLP)组织中的免疫激活状态,主要表现为以Trm和Tem细胞为主的T细胞富集以及表现出的更高的细胞毒性,同时淋巴细胞迁移相关通路也被激活。成纤维细胞通过促进免疫细胞向结缔组织外渗参与到免疫过程中,这为OLP的诊断及干预提供了新的见解。
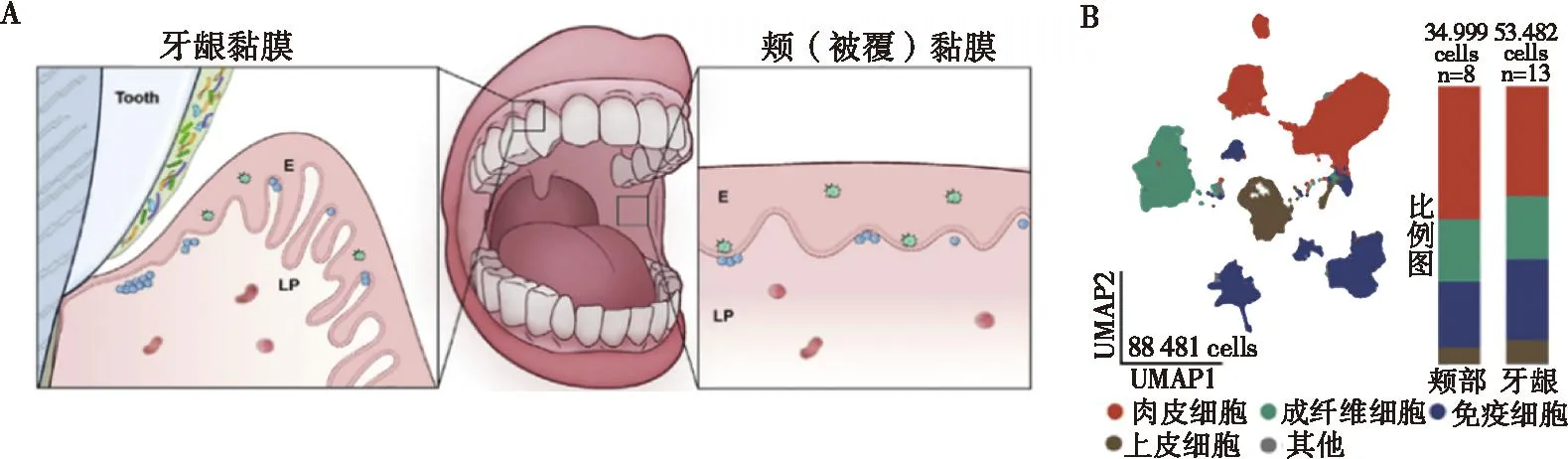
A:口腔黏膜组织的示意图,E:上皮,LP:固有层;B:通过单细胞测序鉴定的主要细胞类型的UMAP图示(左)和按组织类型排列的相对细胞比例条形图(右)。
为进一步揭示口腔黏膜疾病的发生发展机制,Caetano等[53]将单细胞测序与空间转录组技术结合(图2),研究细胞间的空间交互作用,并且联合高分辨率多重荧光杂交技术,发现了一群位于高度免疫原性区的成纤维细胞亚群,其通过CXCL8和CXCL10招募淋巴细胞,这也进一步表明了基质细胞在局部免疫反应中的作用,揭示疾病状态下口腔黏膜细胞的区域异质性。

A:人类口腔黏膜的示意图,显示不同的上皮区域,口腔上皮(OE),口腔沟内上皮(OSE)和连接上皮(JE);B:典型的口腔黏膜炎症切面的H&E图像,显示了上皮和结缔组织区域之间的界限;C:使用BayesSpace分析切片中人类口腔黏膜区域。
5 未来展望
单细胞测序技术使生命科学领域中各学科的研究取得巨大进步,通过单细胞水平的高通量测序分析能够揭示新的细胞亚群、识别细胞分化轨迹、鉴别不同疾病背景下的细胞信号通路。单细胞测序技术目前已经能够检测几乎所有的组学,包括全基因组、代谢组、蛋白组等,多组学研究也更深入地揭示组织细胞基因表达。然而,在单细胞悬液制备过程中其组织空间信息也会丢失,空间位置信息也是决定细胞命运的重要因素。在2022年空间转录组学技术入选为Nature值得关注的七大技术之一,空间转录组技术与单细胞测序技术的联合应用也逐渐受到关注。目前,单细胞测序与空间转录组的联合已应用于研究不同领域的基因表达差异对疾病发生发展的影响,包括肝病的病理生理机制研究[54]、结直肠癌病理机制[55]、肠道发育[56]、心血管疾病发生发展等[57]。
在口腔医学领域,单细胞测序技术的应用已日渐普遍,在口腔组织的发育与口腔疾病的发展研究中发挥了重要作用,但空间转录组技术相关的口腔研究仍在起步阶段。通过联合两种技术,未来可用于构建口腔组织发育的动态表达图谱与口腔疾病的分子差异表达的空间图谱;探索口腔组织发生过程中细胞的形态学,分子特性的差异,以及在不同发育阶段的空间分布及基因表达;研究牙周炎症微环境下不同细胞之间的相互作用,探究炎症区域与正常组织的细胞构成及基因表达特征;研究口腔癌的肿瘤内空间分布异质性,通过分析邻近肿瘤区域的基因表达分布对肿瘤进行重新分层并识别诊断标志物等。
未来,随着单细菌测序、石蜡组织切片空间转录组测序等技术的突破和测序分辨率的提高,探究组织、细胞和微生物的空间位置信息及不同空间位置的基因表达差异将成为研究的热点,也将为临床疾病的诊断治疗带来新的参考。
